






人教版 (2019)选择性必修1第二节 电解池一等奖ppt课件
展开1.了解电解的概念,熟悉电解池的构成条件。2.理解电解原理。3.掌握电解池电极反应式和反应方程式的书写。
学习任务一 电解CuCl2溶液实验探究
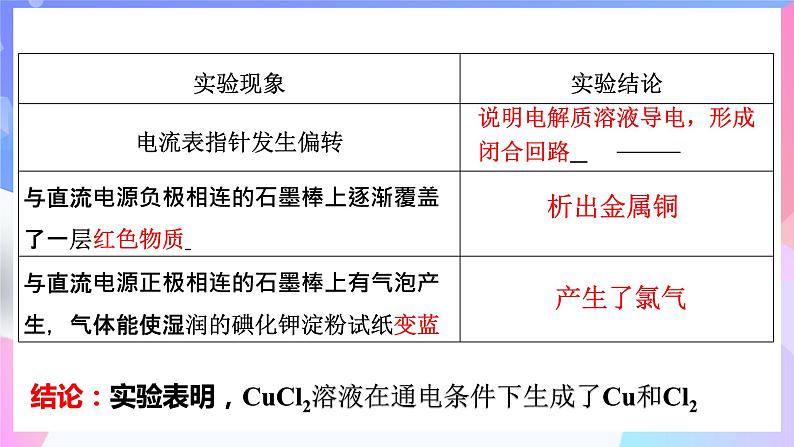
在U形管中注入质量分数为25%CuCl2溶液,插入两根石墨棒作电极材料,把湿润的碘化钾淀粉试纸放在与直流电源正极相连的石墨棒(阳极)附近。接通直流电源,观察U形管内的现象和试纸颜色的变化。
结论:实验表明,CuCl2溶液在通电条件下生成了Cu和Cl2
说明电解质溶液导电,形成闭合回路
①离子移动 通电前:CuCl2 = Cu2+ + 2Cl-,
H2O H++OH-
氯化铜溶液中存在的离子有Cu2+、Cl-、H+、OH-,通电前这些离子在溶液中作自由运动。
在电场的作用下,溶液中的离子作定向运动,即Cl-、OH-向阳极(与直流电源正极相连的石墨棒)迁移,Cu2+、H+向阴极(与直流电源负极相连的石墨棒)迁移。
2Cl- - 2e- = Cl2↑(氧化反应)
Cu2+ + 2e- = Cu(还原反应)
③结论:电解质溶液的导电过程,就是电解质溶液的电解过程。
石墨棒作电极电解CuCl2溶液的实验探究
通电后:由电源⇒电子移动方向⇒电解液中离子移动方向
移向阳极的离子失电子能力:
移向阴极的离子得电子能力:
Cu2++2e-===Cu
2Cl--2e-===Cl2↑
总反应 Cu2++2Cl- ==== Cu+Cl2↑
尝试小结电解氯化铜溶液这一过程的特点和规律。
电极、电源、离子、电子移动、电极反应关系
学习任务二 电解池的工作原理
1.电解:使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起氧化还原反应的过程。注意:①电流应是直流电 ②熔融态的电解质也能被电解2.电解池:将电能转化为化学能的装置(也称电解槽)。3.电解池的电极名称:阴极:与直流电源负极相连的电极,发生还原反应;阳极:与直流电源正极相连的电极,发生氧化反应。
4.电解池的构成条件:①具有直流电源;②两个电极(阴极、阳极);③电解质溶液或熔融电解质;④形成闭合回路。
⑤能发生氧化还原反应:
可以是自发的反应,也可以是非自发的反应
两极一液一电源,氧化还原是条件
5.电子和离子移动方向:①电子:从电源负极流向电解池的阴极,从电解池的阳极流向电源的正极。②离子:阳离子移向电解池的阴极;阴离子移向电解池的阳极。
点拨:(1)电解质溶液导电实际上是电解过程,发生氧化还原反应,是化学变化。 (2)金属导电是因为在电场作用下,自由电子发生定向移动,是物理变化。
注:电解法是一种强氧化还原手段,可以完成一个不自发的氧化还原反应
工作原理(以电解CuCl2溶液为例)
Cu2++2e-=Cu
2Cl--2e-=Cl2↑
负极→阴极,阳极→正极
正极→阳极,阴极→负极
阳离子→阴极,阴离子→阳极
注:放电:离子得失电子发生氧化还原反应的过程
6.电解过程思维程序:(1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。(2)再分析电解质水溶液的组成,找全离子并分阴、阳两组。提示:不要忘记水溶液中的H+和OH-,不要把H+、OH-误加到熔融电解质中。
注:阳极材料分为两种:
①活性电极:电极自身放电即电极自身失去电子发生氧化反应, 如:Fe、Cu、Ag
②惰性电极:电极自身不反应,由电解质中的阴离子得到电子发生氧化反应。如:Au、Pt、C
阴极材料只要导电就可以
(3)然后排出阴、阳两极的放电顺序①阴极(与电极材料无关):
最常见的阴极产物有Ag、Cu、H2
Cu2++2e-=Cu
2H++2e-=H2或2H2O+2e-=H2↑+2OH-
注:在电镀时,通过控制条件,Fe2+和Zn2+的得电子 能力会强于酸中的H+,即浓度越大,得电子能力越强
②阳极(与电极材料有关):
反应方式:M-ne-=Mn+
Fe-2e- =Fe2+
Cu-2e- =Cu2+
Au、Pt、C。溶液中的阴离子放电
常见放电顺序: 活性电极>S2- >I- >Br- >Cl- >OH- >含氧酸根>F-
2Br--2e-=Br2
2Cl--2e-=Cl2
2H2O—4e-=4H++O2↑
提醒:①“活泼电极”一般指Pt、Au以外的金属。②最常用的放电顺序:阳极:活泼金属>Cl->OH-;阴极:Ag+>Fe3+>Cu2+>H+。(4)分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。(5)最后写出电解反应的总化学方程式或离子方程式。书写反应的总离子方程式时,要注意:若参与电极反应的H+(或OH-)是由水电离出来的,应用水的分子式表示。
【例题】若通电一段时间后乙装置左侧电极质量增加,写出甲乙丙各池电极反应式及总反应式
首先要判定是否为电解池
⇒再考虑阴极阳离子放 电顺序
看电极→找离子→分阴阳→排顺序→写反应
注:①必须在总反应方程式的“=”上标明“通电”或“电解”
②只是电解质被电解,电解化学方程式中只写电解质及电解产物,无关的不写
练1. 下列叙述正确的是( )①电解池是将化学能转变成电能的装置 ②原电池是将电能转变成化学能的装置 ③金属导电均为物理变化,电解质溶液导电是化学变化 ④电解池两个电极材料可以相同A.①②③④ B.仅③④C.仅②③④ D.仅③
练习2:1、阳极为铁,阴极为铜,电解质为氯化铁 2、阳极为铜,阴极为铁,电解质为氯化铜 3、阳极为银,阴极为石墨,电解质为稀盐酸 4、阴阳极均为石墨,分别写出电解质为硫酸、氢氧化钾、 硝酸钠;溴化铜;氯化钠;硫酸铜、硝酸银
小结:电解池与原电池的比较
自发进行的氧化还原反应
非自发或自发进行的氧化还原反应
阳离子→正极,阴离子→负极
小结:原电池与电解池的电极反应:负阳氧,正阴还 原电池的离子走向:正向正,负向负;电解池的离子走向:阴阳相吸
人教版 (2019)选择性必修1第四章 化学反应与电能第二节 电解池一等奖课件ppt: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002435_t3/?tag_id=26" target="_blank">第四章 化学反应与电能第二节 电解池一等奖课件ppt</a>,文件包含43电解池ppt、实验4-2电解氯化铜溶液mp4等2份课件配套教学资源,其中PPT共24页, 欢迎下载使用。
鲁科版 (2019)选择性必修1第2节 化学能转化为电能——电池说课课件ppt: 这是一份鲁科版 (2019)选择性必修1<a href="/hx/tb_c4002574_t3/?tag_id=26" target="_blank">第2节 化学能转化为电能——电池说课课件ppt</a>,共22页。PPT课件主要包含了电解质溶液,原电池的工作原理,还原反应,氧化反应,原电池的形成条件,原电池的应用,设计原电池,原电池正负极的判断,活泼的金属,阳离子移向等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化优质ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化优质ppt课件,共27页。PPT课件主要包含了电解熔融氯化钠,课堂小结,习题探究等内容,欢迎下载使用。













