











所属成套资源:人教版化学必修第一册课件+同步练习(原卷+解析卷)
高中化学人教版 (2019)必修 第一册第二节 氯及其化合物获奖ppt课件
展开
这是一份高中化学人教版 (2019)必修 第一册第二节 氯及其化合物获奖ppt课件,文件包含人教版高中化学必修一223《氯及其化合物》课件pptx、人教版高中化学必修一223《氯及其化合物》同步练习解析版docx、人教版高中化学必修一223《氯及其化合物》同步练习原卷版docx等3份课件配套教学资源,其中PPT共25页, 欢迎下载使用。
第二章 海水中的重要元素——钠和氯
人教版高中化学必修一
2.2.3 氯及其化合物
18世纪70年代,瑞典化学家舍勒将软锰矿与浓盐酸混合加热,产生了一种黄绿色、有刺激性气味的气体。
1810年,英国化学家戴维才确认这种气体是一种新元素组成的单质——氯气。
神秘的氯气
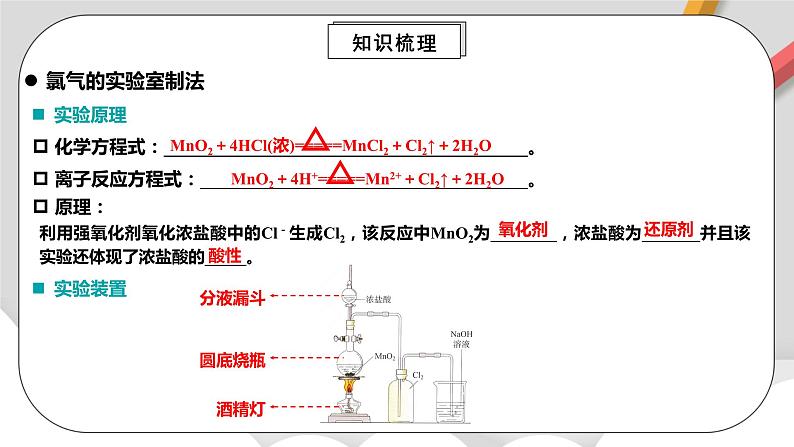
利用强氧化剂氧化浓盐酸中的Cl-生成Cl2,该反应中MnO2为________,浓盐酸为_______并且该实验还体现了浓盐酸的_____。
化学方程式:________________________________________。
氯气的实验室制法
氧化剂
还原剂
酸性
实验原理
原理:
实验装置
分液漏斗
圆底烧瓶
酒精灯
离子反应方程式:____________________________________。
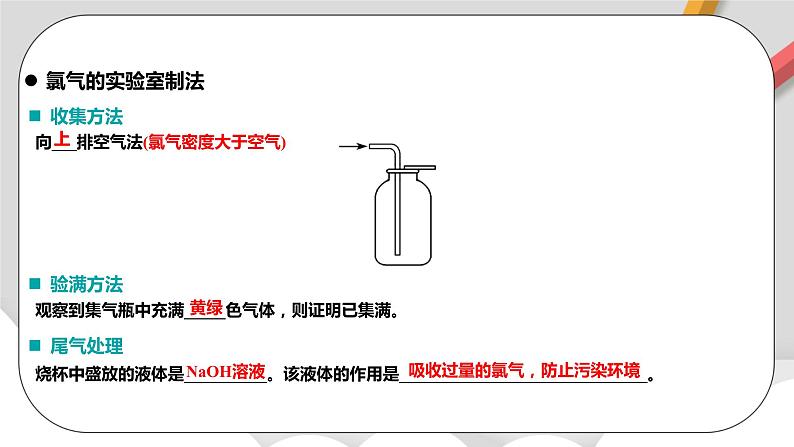
向___排空气法(氯气密度大于空气)
上
黄绿
NaOH溶液
氯气的实验室制法
收集方法
验满方法
观察到集气瓶中充满_____色气体,则证明已集满。
尾气处理
烧杯中盛放的液体是__________。该液体的作用是______________________________。
吸收过量的氯气,防止污染环境
不能,因为随着反应的进行,盐酸的浓度变小,MnO2与稀盐酸不反应,故生成的Cl2小于1 。
上述装置收集的Cl2不纯,有HCl和H2O(g)。在上述装置A、B之间依次连接盛有饱和食盐水的洗气瓶除HCl和盛有浓H2SO4的洗气瓶干燥Cl2。
将湿润的淀粉碘化钾试纸靠近盛氯气的瓶口,观察到试纸立即变蓝,则证明已集满。将湿润的蓝色石蕊试纸靠近盛氯气的瓶口,观察到试纸立即发生先变红后褪色的变化,则证明已集满。
请同学们回顾试验,思考并回答以下问题:
氯气的实验室制法
注意事项
实验结束后,先使反应停止并排出装置中残留的氯气,再拆卸装置,避免污染空气。
【例1】实验室用浓盐酸和MnO2制Cl2,并以干燥的Cl2为原料进行实验,装置如下图所示。
饱和食盐水
浓硫酸
氯化氢和水蒸气随Cl2进入D中能和铁反应生成H2,H2和Cl2混合受热会发生爆炸
(1)装置B、C中应盛放的试剂名称分别为___________、________;从A装置导出的气体若不经过B、C装置而直接进入D管,将对实验产生的不良后果是________________________________________________________________________。
(2)实验时,先点燃A处的酒精灯,让Cl2充满装置,再点燃D处酒精灯,写出D中反应的化学方程式:______________________。
(3)F装置所起的作用是______________________________________________________。
吸收多余的Cl2,防止污染环境,防止空气中的水蒸气进入D中
【例1】实验室用浓盐酸和MnO2制Cl2,并以干燥的Cl2为原料进行实验,装置如下图所示。
(4)用石灰乳吸收氯气可制得漂粉精,写出工业制漂粉精反应的化学方程式:___________________________________________________。
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
设计气体制备装置的基本思路
实验室制气体的制备思路
明确气体制备的原理,写出相应的化学方程式
根据药品状态、反应条件,选择合适的反应装置
分析气体是否含有杂质,根据气体和杂质性质的差异选择除杂、净化方法
根据气体性质,选择收集装置,分析是否需要尾气处理装置
第一步
第二步
第三步
第四步
气体制备装置的连接顺序
实验室制气体的制备思路
各种装置的选择
选择依据
反应原理、反应物的状态、反应条件等。
装置的基本类型
净化原则
各种装置的选择
实验室制备气体的净化装置的选择
装置Ⅰ(洗气瓶):盛液体除杂试剂,气流方向是长管进,短管出。
不减少被净化气体的量;不引入新杂质;操作简便,易于分离。
净化装置
装置Ⅱ(干燥管):盛固体除杂试剂,气流方向是粗口进,细口出。
各种装置的选择
实验室制备气体的收集装置的选择
选择依据
根据气体的密度、水溶性及是否与水或空气中的O2发生反应来确定气体的收集方法。
方法选择
排水法:适用于难溶于水且不与水反应的气体,如O2、H2等。
向上排空气法:气体不与空气反应,且密度比空气大,如O2、CO2、Cl2等。
向下排空气法:气体不与空气反应,且密度比空气小,如H2等。
各种装置的选择
实验室制备气体的尾气处理装置的选择
选择依据:
根据气体的物理性质、化学性质,将气体转化成无毒物质或吸收。
方法选择:
①点燃法:如CO、H2、CH4等易燃性气体可用此法,必须先验纯,再点燃。
②吸收法:如Cl2、SO2、HCl、H2S等可用碱液吸收。
氯气中毒的症状
吸入氯气后对上呼吸粘膜的强烈刺激,可引起呼吸道烧伤、急性肺水肿等,严重者可危及生命。
氯气中毒后的应急措施
立即将患者转移到空气新鲜处
用清水反复冲洗皮肤、眼睛
中毒严重的应迅速送医院救治
1.下列关于实验室制氯气的说法中错误的是( )A.该反应是一个氧化还原反应,其中二氧化锰是氧化剂B.HCl表现还原性和酸性C.该反应的离子方程式为MnO2+4H++4Cl- MnCl2+2H2O+Cl2↑D.该方法是瑞典化学家舍勒最先发现的
2.某化学小组用图示装置制取氯气,下列说法不正确的是( )A.该装置图中至少存在两处明显错误B.为了防止氯气污染空气,必须进行尾气处理C.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸,可以证明是否有氯气逸出D.该实验中收集氯气的方法不正确
C
D
3.某化学兴趣小组利用MnO2和浓盐酸及如图装置制备Cl2。下列分析中不正确的是( )A.①中可用分液漏斗代替长颈漏斗B.①中缺少加热装置C.②中盛放的NaOH溶液可以净化氯气D.④中盛放的NaOH溶液可以吸收尾气
C
4.实验室用MnO2和浓盐酸制取氯气时,有14.6 g氯化氢被氧化,所得Cl2全部用石灰乳吸收,可制得漂白粉的质量是( )A.14.3 g B.25.4 g C.28.6 g D.50.8 g
B
A.Ⅰ图中:如果MnO2过量,盐酸就可全部消耗B.Ⅱ图中:如果倒置的量筒充满了氯气,水槽内装满水,经足够长的时间光照,量筒内最后剩余气体为HCl和氧气C.Ⅲ图中:生成蓝色的烟D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中至溶液呈酸性,结果有Cl2生成
5.某同学用下列装置制备并检验Cl2的性质。下列说法正确的是( )
D
6.某小组使用下图装置制取并收集干燥、纯净的氯气,请回答问题:
(1)A装置中仪器a的名称是__________,KMnO4的作用是_________。
(2)C装置盛放的试剂是________,其作用是_______________________________。
(3)写出D装置中反应的离子方程式:______________________________。
分液漏斗
作氧化剂
浓硫酸
干燥氯气(或除去氯气中的水蒸气)
Cl2+2OH-===Cl-+ClO-+H2O
课程结束
相关课件
这是一份人教版 (2019)必修 第一册第二节 氯及其化合物优质ppt课件,文件包含人教版高中化学必修一222《氯及其化合物》课件pptx、人教版高中化学必修一222《氯及其化合物》同步练习解析版docx、人教版高中化学必修一222《氯及其化合物》同步练习原卷版docx等3份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
这是一份人教版 (2019)必修 第一册第二节 氯及其化合物精品课件ppt,文件包含人教版高中化学必修一221《氯及其化合物》课件pptx、人教版高中化学必修一221《氯及其化合物》同步练习解析版docx、人教版高中化学必修一221《氯及其化合物》同步练习原卷版docx等3份课件配套教学资源,其中PPT共27页, 欢迎下载使用。
这是一份高中人教版 (2019)第三节 氧化还原反应优秀课件ppt,文件包含人教版高中化学必修一133《氧化还原反应》课件pptx、人教版高中化学必修一133《氧化还原反应》同步练习解析版docx、人教版高中化学必修一133《氧化还原反应》同步练习原卷版docx等3份课件配套教学资源,其中PPT共22页, 欢迎下载使用。










