







高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡完美版ppt课件
展开人教版高中化学选择性必修一
第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡第1课时 难溶电解质的沉淀溶解平衡
目录
溶洞的形成
1.什么是饱和溶液?
在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
2.如何判断某NaCl溶液是否已经达到饱和?
讨论1:在NaCl的饱和溶液中,再加入固体溶质,固体会不会继续溶解?是否发生着溶解过程?
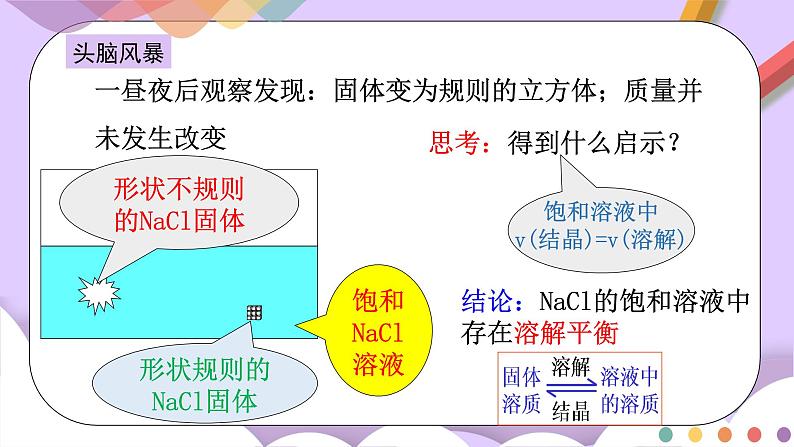
导入思考
饱和NaCl溶液
一昼夜后观察发现:固体变为规则的立方体;质量并未发生改变
思考:得到什么启示?
结论:NaCl的饱和溶液中存在溶解平衡
头脑风暴
现象:NaCl饱和溶液中析出固体
解释: 在NaCl的饱和溶液中,存在溶解平衡 NaCl(s) Na+(aq)+Cl-(aq)
加浓盐酸Cl- 的浓度增加,平衡向左移, NaCl析出
可溶的电解质溶液中存在溶解平衡,难溶的电解质在水中是否也存在溶解平衡呢?
探究2:
在饱和NaCl溶液中加入浓盐酸
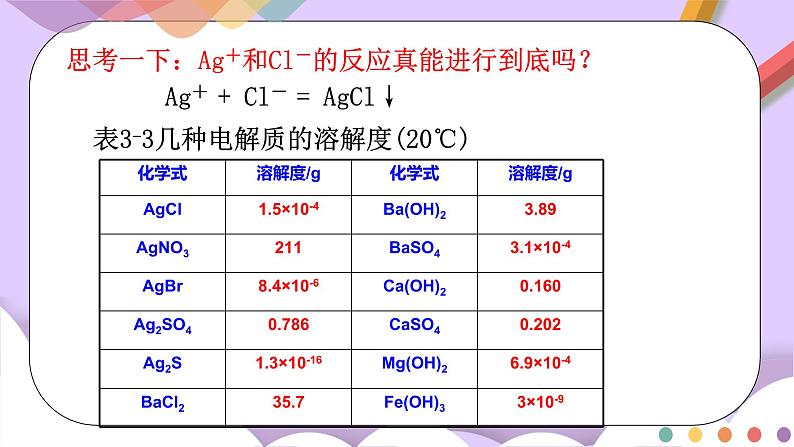
我们知道,溶液中有难溶于水的沉淀生成是离子反应发生的条件之一。例如,AgNO3溶液与NaCl溶液混合,生成白色沉淀AgCl:Ag++Cl-=AgCl↓,如果上述两种溶液是等物质的量浓度、等体积的,一般认为反应可以进行到底。
思考一下:Ag+和Cl-的反应真能进行到底吗?
Ag+ + Cl- = AgCl↓
表3-3几种电解质的溶解度(20℃)
讨论: 在溶解度的大小、易溶和难溶界限等方面你能得到哪些相关信息谈谈你对酸、碱和盐的溶解度表中“溶”与“不溶”的理解。
200C时,溶解性与溶解度的大小关系
1、溶解是绝对的,不溶是相对的。
2、没有绝对不溶的电解质,难溶电解质都会发生微量溶解
3、生成沉淀的离子反应能发生的原因:生成物的溶解度很小。
化学上通常认为残留在溶液中的离子浓度小于1×10-5 mol/L,沉淀就达完全。
下列说法中正确的是( )A.物质的溶解性为难溶,则该物质不溶于水B.不溶于水的物质溶解度为0C.绝对不溶解的物质是不存在的D.某粒子被沉淀完全是指该粒子在溶液中的浓度为零
C
随堂小练
【探究实验】向盛有2 mL 0.1mol/LAgNO3溶液的试管中加入2 mL 0.1 mol/L NaCl溶液。
讨论:
现象:有白色沉淀生成,说明溶液中依然有Ag+ Cl-存在,即Ag+和Cl-的反应不能进行到底。
(1)是否恰好反应?(2)溶液中是否还含有Ag+和Cl-?
【继续试验】取上层清液,滴加NaCl溶液,有何现象?说明了什么?
沉淀是难溶物,但不是绝对不溶,只不过溶解度很小,难溶物在水中存在溶解平衡。
V(溶解)>V(结晶)
固体质量减少
不饱和
V(溶解)=V(结晶)
固体质量不变
饱和
饱和阶段
固体质量增加
结晶阶段
V(溶解)
思考:把AgCl固体加到水中都发生着怎样的过程?
开始阶段
溶解 AgCl(s) Ag+(aq) + 2Cl-(aq) 沉淀
AgCl在水中溶解平衡
尽管AgCl固体难溶于水,但仍有部分Ag+和 Cl-离开固体表面进入溶液, 同时进入溶液的Ag+和 Cl-又会在固体表面沉淀下来,当这两个过程速率相等时,Ag+和 Cl-的沉淀与AgCl固体的溶解达到平衡状态即达到沉淀溶解平衡状态. AgCl固体在水中的沉淀溶解平衡可表示为:
二、难溶电解质的溶解平衡
1、概念:一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态,我们把这种平衡称为沉淀溶解平衡 。
v(溶解)> v(结晶) 固体溶解v(溶解)= v(结晶) 溶解平衡v(溶解)< v(结晶) 析出晶体
2、溶解平衡的建立
溶解速率
沉淀速率
时间
速率
沉淀溶解平衡
3、表达方法
4、溶解平衡的特征
标明物质状态和可逆符号
逆、等、动、定、变
5、生成难溶电解质的离子反应的限度
离子浓度小于1×10-5mol/L时,认为反应完全。
AgCl(s) ⇌Ag+(aq) + Cl-(aq)
下列说法中正确的是( )A.物质的溶解性为难溶,则该物质不溶于水B.不溶于水的物质溶解度为0C.绝对不溶解的物质是不存在的D.某粒子被沉淀完全是指该粒子在溶液中的浓度为零
下列对沉淀溶解平衡的描述正确的是( )A.开始时,溶液中各离子浓度相等B.平衡时,沉淀的速率和溶解的速率相等C.平衡时,溶液中溶质的离子浓度相等,且保持不变D.平衡时,如果再加入难溶性的该沉淀物,将促进溶解
C
B
将足量AgCl各放入:(1)5ml水;(2)10ml 0.2 moll-1的 MgCl2溶液;(3)20ml 0.5moll-1NaCl溶液;(4)40ml 0.1 moll-1盐酸中溶解至饱和,各溶液中c(Ag+)由大到小的顺序为:
各溶液中c(Cl-)越大,c(Ag+)越小(1)>(4)>(2)>(3)
6、沉淀溶解平衡的影响因素
①内因:电解质本身的性质。
只要是饱和溶液都存在溶解平衡
绝对不溶的物质是没有的
不同难溶物其溶解度差别也很大
0.01g
10g
难溶
微溶
易溶
可溶
1g
难溶的电解质更易建立溶解平衡
②外因
加与难溶电解质相同离子,平衡向沉淀方向移动
温度:
浓度:
加水,平衡向溶解方向移动;
同离子效应:
(气体,Ca(OH)2除外)
升温,多数平衡向溶解方向移动。
化学反应:
反应消耗难溶电解质的离子,平衡向溶解方向移动。
讨论:在AgCl饱和溶液中,尚有AgCl固体存在,当分别改变下列条件,将如何变化? AgCl(S)⇌Ag+(aq) + Cl-(aq)
→ ↑ ↑
→ 不变 不变
不移动 不变 不变
← ↓ ↑
→ ↓ ↑
← ↑ ↓
欲增大Mg(OH)2在水中的溶解度,可采取的方法是( )A. 加入NaOH固体 B. 加氯化铵溶液C. 加硫酸镁固体 D. 加大量水
B
当氢氧化钙固体在水中达到溶解平衡Ca(OH)2(s)⇌Ca2+(aq)+2OH-(aq)时,为使氢氧化钙固体的量减少,需加入少量的(双选)( )A、NH4NO3 B、NaOH C、CaCl2 D、NaHSO4
AD
随堂小练
1. 概念在一定温度下,沉淀达溶解平衡后的溶液为饱和溶液,其离子浓度不再发生变化,溶液中各离子浓度幂之积为常数,叫做溶度积常数(简称溶度积),用Ksp表示。AmBn(s)⇌mAn+(aq)+nBm-(aq)
固体浓度视为定值
思考:写出难溶物Ag2CrO4、 Fe(OH)3的溶度积表达式
Ksp=cm(An+)·cn(Bm-)
2. 表达式:
三.溶度积常数
3. 影响Ksp的因素:
Ksp的大小只与难溶电解质本身的性质和温度有关T↑,Ksp↑ [ Ca(OH)2 相反]
4. Ksp的意义:
相同类型的难溶电解质,溶度积小的电解质,其溶解能力小;不同类型的难溶电解质,应通过计算才能进行比较。
Ksp反映了难溶电解质在水中的溶解能力.
讨论:溶度积和溶解度都可以表示难溶电解质在水中的溶解能力,分析下表,你将如何看待溶度积和溶解度的关系?
结论:相同类型的难溶电解质的Ksp越小溶解度越小
一定条件下:
注意:只有在同种类型的电解质之间才能通过Ksp的大小来直接比较溶解度的大小。
下列叙述正确的是( )A.由于AgCl水溶液导电性很弱,所以它是弱电解质B.难溶电解质离子浓度的乘积就是该物质的溶度积常数C.溶度积常数大者,溶解度也大D.用水稀释含有AgCl固体的溶液时, AgCl的溶度积常数不变。
D
随堂小练
在含有大量PbI2的饱和溶液中存在着平衡:PbI2(s) ⇌Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是( )A. 溶液中Pb2+和I-浓度都增大B. 溶度积常数Ksp增大C. 沉淀溶解平衡向右移动D. 溶液中Pb2+浓度减小
D
随堂小练
下列有关溶度积常数Ksp的说法正确的是( )A. 常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小B. 溶度积常数Ksp只受温度影响,温度升高Ksp一定减小 C. 溶度积常数Ksp只受温度影响,温度升高Ksp一定增大D. 常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变
D
随堂小练
下列说法正确的是( ) A. 在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数; B. AgCl的Ksp=1.8×10-10 mol·L-1,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl- 浓度的乘积等于1.8×10-10 mol·L-1; C. 温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液; D.向饱和AgCl水溶液中加入盐酸,Ksp值变大。
C
已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )A.AgCl>AgI> Ag2CrO4 B.AgCl> Ag2CrO4>AgIC.Ag2CrO4>AgCl>AgI D.Ag2CrO4>AgI>AgCl
C
随堂小练
3、溶度积规则
AnBm(s)⇌ nAm+(aq) + mBn-(aq)
Qc>Ksp时,溶液过饱和,有沉淀析出,直至达到平衡.
Qc称为离子积,其表达式中离子浓度是任意的,为此瞬间溶液中的实际浓度.
②溶度积规则
①离子积
Qc= c(Am+)n · c(Bn-)m
Qc=Ksp时,沉淀与饱和溶液的平衡.
Qc
A
c(Cl-)=(0.01×0.1) ÷0.101 = 9.9×10-3mol/L
c(Ag+)=(0.01×0.001) ÷0.101 = 9.9×10-5mol/L
Qc =9.9×10-3×9.9×10-5 = 9.8×10-7 > Ksp
随堂小练
25℃时,Ksp (AgBr)= 5.0×10-10,求AgBr的饱和溶液中的c(Ag+)和c(Br-)。
4、利用溶度积计算某种离子的浓度:
25℃时,Ksp [Mg(OH)2]= 1.8×10-11,求Mg(OH)2的饱和溶液中的C(Mg2+)和c(OH-)
C(Mg2+)=1.65×10-4,c(OH-)=3.3×10-4
c(Ag+)=c(Br- )=2.2×10-5
室温下,AgCl的溶解度是1.93×10-3g/L,求AgCl的溶度积。已知AgCl的摩尔质量为143.3g/mol。解:①把AgCl溶解度单位(g/L)换算成mol·L-1 s=1.93×10-3g/L÷143.3g/mol =1.35×10-5mol·L-1
5、溶度积与溶解度的相互换算
②求Ksp AgCl(s)⇌Ag+ (aq) + Cl-(aq)
饱和、平衡 1.35×10-5 1.35×10-5
Ksp(AgCl)=c(Ag+).c(Cl-) =(1.35×10-5)2=1.82×10-10答:AgCl的Ksp为1.82×10-10
6.判断能否生成沉淀
25℃时,在1.00 L 0.03 mol/L AgNO3溶液中加入0.50 L 0.06 mol/L的CaCl2溶液,能否生成AgCl沉淀?已知:AgCl的Ksp=1.8×10-10
c(Ag+)=(0.03 mol/L×1.00 L)÷(1.00 L+0.50 L) =0.020 mol/L
由于Qc>Ksp,所以有AgCl沉淀生成。
c(Cl-)=(0.06 mol/L×2×0.50 L)÷(1.00 L+0.50 L) =0.040 mol/L
Qc=c(Ag+)·c(Cl-)=0.020 mol/L×0.040 mol/L=8.0×10-4
将5mL 1×10-5mol/L的AgNO3溶液和15mL 4×10-5mol/L的K2CrO4溶液混和时,有无砖红色Ag2CrO4沉淀生成?已知Ag2CrO4的Ksp=9×10-12
c(Ag+)=2.5×10-6mol/L
c(CrO42-)=3×10-5mol/L
Qc=c(Ag+)2·c(CrO42-) =(2.5×10-6mol/L)2×3×10-5 mol/L =1.9×10-16
由于Qc
实验测得某水样中的铁离子的浓度为6×10-6mol·L-1若要使水中的铁离子转化为沉淀,则溶液的pH值至少要控制在多少以上?[已知Fe(OH)3的Ksp为2.6×10-39]
解:设溶液中的OH-离子的浓度最少为X才能使水中的铁离子转化为沉淀。
7.计算某离子开始沉淀的pH值
Ksp=c(Fe3+) ·c3(OH-)=2.6×10-39 =6×10-6×X3
求得X=7.57×10-12mol·L-1=c(OH-)
c(H+)=1.32×10-3mol·L-1 pH=2.88答:pH至少要控制在2.88以上。
一、 沉淀溶解平衡
1、定义
2、表达式
3、特征
4、影响难溶电解质溶解平衡的因素
二、溶度积常数
1、定义
2、影响Ksp的因素
3、Ksp的意义
课程结束
人教版 (2019)选择性必修1第四节 沉淀溶解平衡背景图ppt课件: 这是一份人教版 (2019)选择性必修1第四节 沉淀溶解平衡背景图ppt课件,共15页。
高中人教版 (2019)第三章 水溶液中的离子反应与平衡第四节 沉淀溶解平衡精品ppt课件: 这是一份高中人教版 (2019)第三章 水溶液中的离子反应与平衡第四节 沉淀溶解平衡精品ppt课件,共34页。PPT课件主要包含了温故知新,什么是饱和溶液,饱和NaCl溶液,思考得到什么启示,思考与讨论,离子浓度,随堂一练,溶度积常数等内容,欢迎下载使用。
人教版 (2019)选择性必修1第四节 沉淀溶解平衡获奖ppt课件: 这是一份人教版 (2019)选择性必修1第四节 沉淀溶解平衡获奖ppt课件,文件包含341难溶电解质的沉淀溶解平衡练习解析版docx、341难溶电解质的沉淀溶解平衡练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













