






人教版 (2019)选择性必修1第一节 原电池完整版ppt课件
展开人教版高中化学选择性必修一
第四章 化学反应与电能第一节 原电池第1课时 原电池的工作原理
目录
思考1:伏打电池的发明源于一个有趣的生物实验:在死去的青蛙腿上同时插入用导线连接着两种不同材料的电极,青蛙腿就像触电似的痉挛起来。你知道其中的奥妙吗?
思考2 张奶奶自从镶了两颗假牙(一颗金牙、一颗钢牙)后,经常头痛失眠,这是为什么?
蛙腿痉挛和镶假牙,这两种现象都是由电流引起的,那么这里的电流是如何产生的?
导入思考
头脑风暴
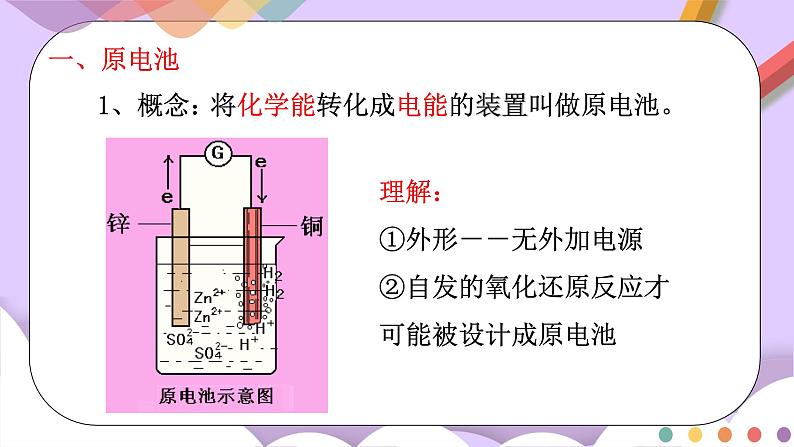
一、原电池
1、概念:
将化学能转化成电能的装置叫做原电池。
理解:①外形--无外加电源②自发的氧化还原反应才可能被设计成原电池
Cu
Zn
稀硫酸
Zn2+
H+
H+
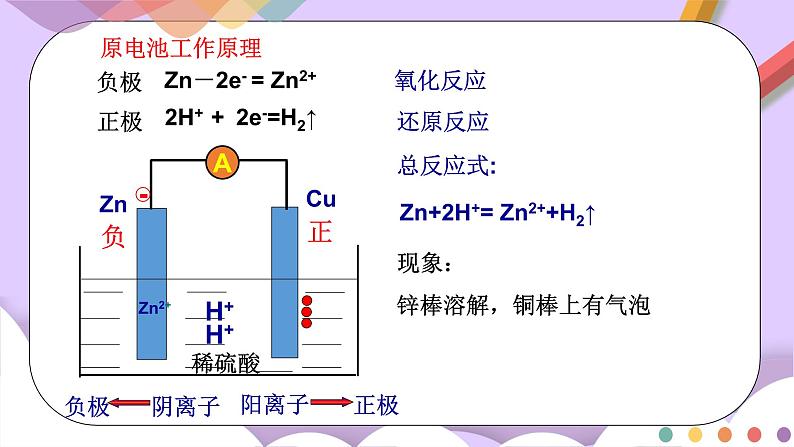
Zn-2e- = Zn2+
负极
正极
2H+ + 2e-=H2↑
总反应式:
Zn+2H+= Zn2++H2↑
负
正
氧化反应
还原反应
现象:
A
原电池工作原理
阳离子
阴离子
正极
负极
锌棒溶解,铜棒上有气泡
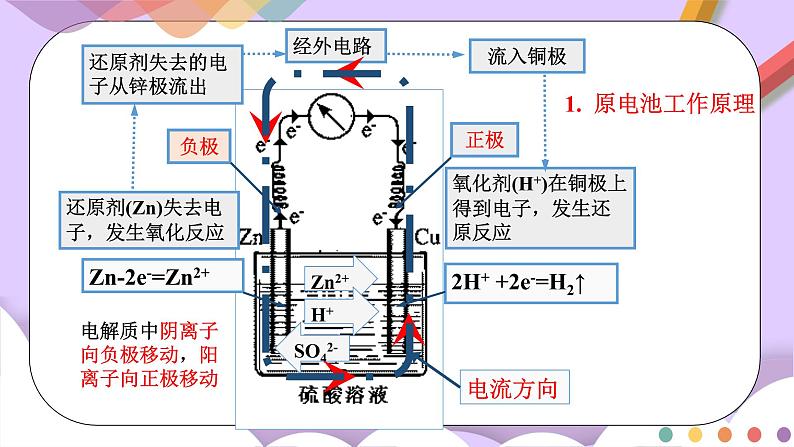
还原剂(Zn)失去电子,发生氧化反应
氧化剂(H+)在铜极上得到电子,发生还原反应
还原剂失去的电子从锌极流出
流入铜极
经外电路
Zn2+
H+
SO42-
电流方向
电解质中阴离子向负极移动,阳离子向正极移动
1. 原电池工作原理
2、构成原电池的条件
(1)必须自发进行氧化还原反应;
(3)两个电极必须插入电解质溶液中或熔融的电解质中;
(4)两个电极必须相连并形成闭合回路。
(2)必须有两种活泼性不同的导电材料作电极;
两极一液成回路,氧化还原是中心
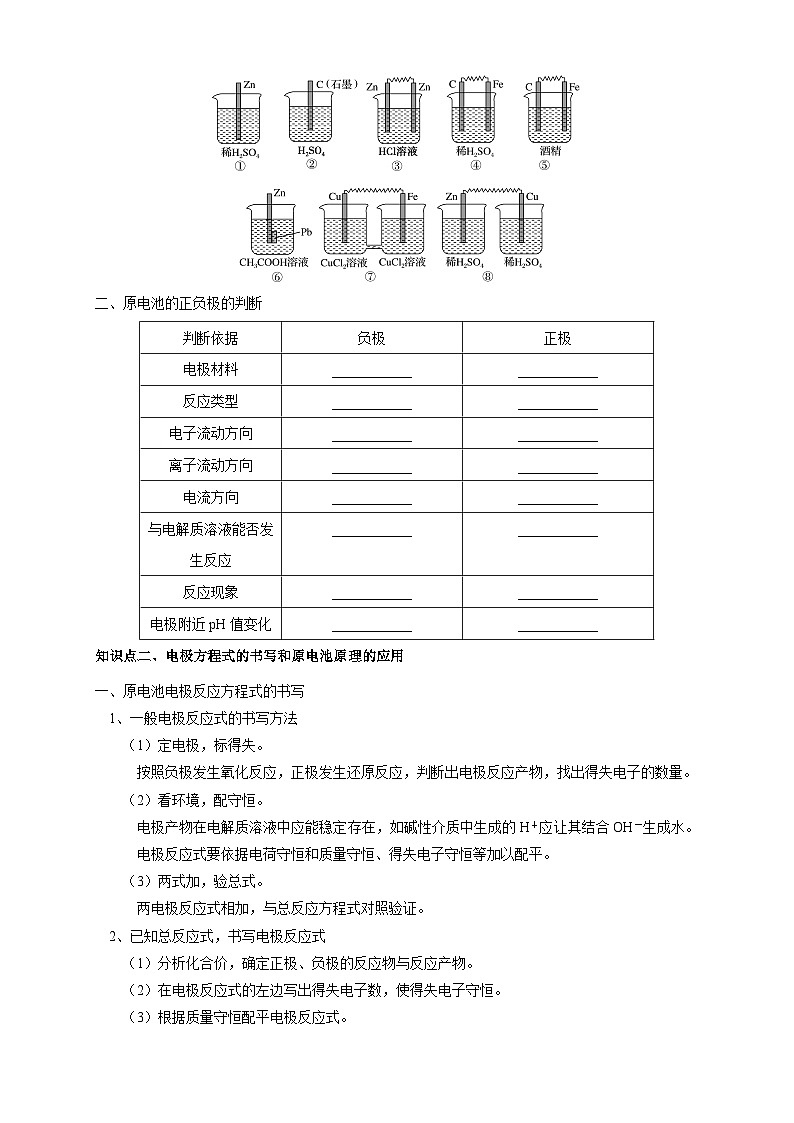
判断下列装置能否构成原电池
(可以)
(可以)
(可以)
(不可以)
结论原电池形成条件一:活泼性不同的两个电极
www.themegallery.com
某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )A.Mg B.Fe C.Al D.Cu
B
课堂小结
判断下列装置能否构成原电池
(可以)
(不可以)
结论原电池形成条件二:电极插在电解质溶液中
判断下列装置能否构成原电池
(不可以)
可以
结论原电池形成条件三:必须形成闭合回路
A
B
C
D
E
F
M
N
下列哪几个装置能形成原电池?
O
V
X
V
V
X
X
X
X
V
随堂小练
下列关于原电池的叙述中,正确的是( )A.把电能转化为化学能,发生氧化还原反应 B.外电路中电子从负极流向正极C.电子从活泼金属流向不活泼金属,不活泼金属为负极 D.正极发生氧化反应
B
随堂小练
单液原电池
按此方法设计的原电池,如果用它做电源,不但效率低,而且时间稍长电流就很快减弱,因此不适合实际应用。这是什么原因造成的呢?
主要原因:负极与阳离子直接接触【说明】由于装置中Cu2+与Zn直接接触,Zn失电子后, Cu2+可以直接在锌片上得到电子,所以这种原电池的效率不高,电流在短时间内就会衰减。
锌半电池
铜半电池
电极反应:负极:正极:总反应:
Cu2++2e- =Cu
Zn-2e- =Zn2+
Zn + Cu2+= Zn2+ + Cu
锌铜原电池(盐桥)
[双液原电池(带盐桥)]
ZnSO4溶液
H2SO4溶液
盐桥中一般装有饱和的KCl溶液和琼脂制成的胶冻;胶冻的作用是防止管中溶液流出;K+和Cl-能在胶冻内自由移动。
盐桥
SO42-
Zn2+
e-e-
SO42-
Cu2+
K+
盐桥工作示意图
Cu
Zn
K+
Cl-
K+
Cl-
K+
Cl-
K+
Cl-
K+
Cl-
Cl-
K+
K+
Cl-
K+
K+
K+
Cl-
Cl-
K+
Cl-
Cl-
Cl-
由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶液扩散和迁移,阳离子K+则向CuSO4溶液扩散和迁移,分别中和过剩的电荷,保持溶液的电中性,因而放电作用不间断地进行,一直到锌片全部溶解或CuSO4溶液中的Cu2+几乎完全沉淀下来。若电解质溶液与KCl溶液反应产生沉淀,可用NH4NO3代替KCl作盐桥。
在整个装置的电流回路中,溶液中的电流通路是靠离子迁移完成的。取出盐桥,Zn失去电子形成的Zn2+进入ZnSO4溶液,ZnSO4溶液因Zn2+增多而带正电荷。同时,CuSO4则由于Cu2+变为Cu,使得SO42-相对较多而带负电荷。溶液不保持电中性,这两种因素均会阻止电子从锌片流向铜片,造成电流中断。
从而持续稳定的产生电流。提高了能量转换率
2. 保障了电子通过外电路从锌到铜的不断转移
3. 沟通内电路传导离子,使之成为闭合回路
1. 平衡电荷,使连接的两溶液保持电中性
盐桥的作用
用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是( )①在外电路中,电流由铜电极流向银电极 ②正极反应为:Ag++e- =Ag③实验过程中取出盐桥,原电池仍继续工作④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同A. ①② B.②③ C.②④ D.③④
C
随堂小练
正、负极的判断
根据电子流动方向
电子流出的极电子流入的极
——负极——正极
阴离子移向的一极阳离子移向的一极
根据离子流向
微观判断
——负极——正极
发生氧化反应的极发生还原反应的极
④根据电极有气泡冒出
——负极——正极
质量增加的电极工作后 质量减少的电极
——正极——负极
工作后,有气泡冒出的电极为正极
较活泼的电极材料较不活泼的电极材料
—负极—正极
①根据电极材料
宏观判断
②根据原电池电极发生的反应
③根据电极质量的变化
[特别提醒] 判断电极时,不能简单地依据金属的活动性顺序来判断,要看反应的具体情况。如:(1)Al在强碱溶液中比Mg更易失电子,Al作负极、Mg作正极。(2)Fe、Al在浓HNO3中钝化后,比Cu更难失电子,Cu作负极、Fe、Al作正极。
1. 比较金属活动性强弱对于酸性电解质,一般是负极金属的活动性较强,正极金属的活动性较弱。
2. 加快氧化还原反应的速率构成原电池的反应速率比直接接触的反应速率快。
例如:实验室制取氢气时,粗锌比纯锌与稀硫酸反应速率快;或向溶液中滴入几滴硫酸铜溶液,产生氢气的速率加快。
3. 设计化学电池(1)理论上,任何自发的氧化还原反应都可以设计成原电池。(2)外电路:还原性较强的物质在负极上失去电子,氧化性较强的物质在正极上得到电子。(3)内电路:将两电极浸入电解质溶液中,阴、阳离子作定向移动。
原电池原理的应用
原电池的设计思路 ——“两极一液一连线”
下列叙述中,可以说明金属甲比乙活泼性强的是( )
C.将甲乙作电极组成原电池时甲是负极
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出
B.在氧化还原反应中,甲比乙失去的电子多
D.同价态的阳离子,甲比乙的氧化性强
C
随堂小练
www.themegallery.com
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为 ( )A.a > b > c > d B.a > c > d > b C.c > a > b > d D.b > d > c > a
B
随堂小练
X、Y、Z、M、N代表五种金属。有以下化学反应:①水溶液中,X+Y2+=X2++Y ;②Z+2H2O(冷)=Z(OH)2+H2↑ ;③M、N为电极与N盐溶液组成原电池,电极反应为M-2e-=M2+;④Y可以溶于稀硫酸,中,M不被稀硫酸氧化,则这五种金属的活动性由弱到强的顺序是( )A.M<N<Y<X<Z B.N<M<X<Y<Z C.N<M<Y<X<Z D.X<Z<N<M<Y
C
随堂小练
下列制氢气的反应速率最快的是( )A.纯锌和1mol/L 硫酸B.纯锌和18 mol/L 硫酸C.粗锌和 1mol/L 硫酸D.粗锌和1mol/L 硫酸的反应中加入几滴CuSO4溶液
D
随堂小练
【议一议】原电池的设计
设计中需要关注的问题:1、有一个自发进行的氧化还原反应2、要有电极材料3、电解质溶液4、组成闭合回路5、装置
设计盐桥原电池的思路:
还原剂和氧化产物为负极的半电池氧化剂和还原产物为正极的半电池
Zn+2Ag+=Zn2++2Ag
根据电极反应确定合适的电极材料和电解质溶液外电路用导线连通,可以接用电器内电路是将电极浸入电解质溶液中,并通过盐桥沟通内电路画出装置示意图
利用反应Zn+2FeCl3=2FeCl2+ZnCl2,设计出两种原电池,画出原电池的示意图,并写出电极反应方程式。
随堂小练
一个电池反应的离子方程式是 Zn+Cu2+=Zn2++Cu,该反应的的原电池正确组合是( )
C
随堂小练
①判断右边原电池的正、负极,并写出电极反应式。
Cu C
FeCl3溶液
负极: Cu 失电子 Cu - 2e- = Cu2+正极: Fe3+得电子 2Fe3+ + 2e- = 2Fe2+
Cu+2FeCl3 =CuCl2 +2FeCl2
先写出总反应:即负极与电解质溶液反应
拆成离子方程式:
Cu + 2Fe3+ = Cu2+ + 2Fe2+
根据化合价升降判断正负极
电极方程式的书写
1.简单原电池电极方程式的写法
②请写出下边原电池的电极方程式。
总反应方程式:
负极:Al,失e- 2Al - 6e- = 2Al3+
2Al3+ + 8OH- =2AlO2- + 4H2O
负极总反应: 2Al +8OH- -6e- =2AlO2- + 4H2O
正极:总反应-负极反应
6H2O +6e- =6OH—+ 3H2↑
拆成离子方程式:
2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
根据化合价升降判断正负极
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
小试牛刀
由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 pH( )A.不变 B.先变大后变小 C逐渐变大 D.逐渐变小
C
小试牛刀
1、定义:
原电池
把化学能转化成电能的装置。
2、原电池的工作原理
3、原电池工作原理的应用
课堂小结
课程结束
高中化学第一节 原电池评课课件ppt: 这是一份高中化学第一节 原电池评课课件ppt,共17页。
高中化学第一节 原电池优秀ppt课件: 这是一份高中化学第一节 原电池优秀ppt课件,文件包含新人教版化学选择性必修一411原电池的工作原理课件pptx、新人教版化学选择性必修一411原电池的工作原理针对练习含解析docx、新人教版化学选择性必修一411原电池的工作原理教案doc等3份课件配套教学资源,其中PPT共27页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第一节 原电池优质课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第一节 原电池优质课件ppt,文件包含411原电池的工作原理练习解析版docx、411原电池的工作原理练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













