化学选择性必修1第一节 反应热精品教案
展开
第一章 化学反应的热效应
第一节 反应热
第1课时 反应热 焓变
【教学目标】
1、认识化学能与热能的相互转化,能分析化学变化和伴随反应发生的能量转化与物质微观结构之间的关系。
2、能解释化学反应中能量变化的本质,能定量分析化学变化的热效应,知道恒温恒压条件下化学反应的反应热可以用焓变表示;
3、通过中和反应反应热测定实验,培养实验探究、勤于实践、善于合作的学科素养
【教学重难点】
重点:
反应热、焓变的含义;中和热的测定
难点:
反应热、焓变的含义;中和热的测定
【教学过程】
一、导入新课
【投影】展示图片
在化学反应过程中,物质变化的同时,一定伴随着能量的变化。
热量的释放或吸收是化学反应中能量变化的常见形式。
二、新课讲授
1、反应热
【讲解】在研究反应热时,需要明确体系和环境。
反应热定义:热量是指因温度不同而在体系与环境之间交换或传递的能量。在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
2、系统与环境
1.敞开系统:系统与环境间即有物 质交换,又有能量交换
2.封闭系统:系统与环境间没有物质交换,只有能量交换
3.孤立系统:系统与环境间无物质和能量的交换
【思考交流】1、在我们的生活中,有哪些吸热反应和放热反应呢?
【学生活动】
【小结】放热反应:(1)可燃物的燃烧;(2)酸碱中和反应;(3)大多数化合反应;(4)物质的缓慢氧化;(5)金属与酸(或水)的置换反应
吸热反应:(1)大多数的分解反应;(2)碳与水蒸气、碳与二氧化碳、一氧化碳与氧化铜、氢气与氧化铜的反应等。
【思考交流】2、化学反应过程中为什么会有能量的变化?(试从宏观和微观两个角度分析)
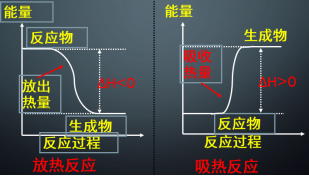
【分析】宏观上: 一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。
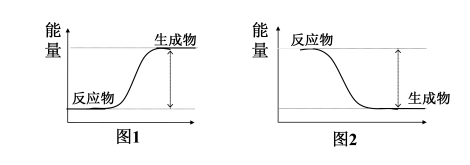
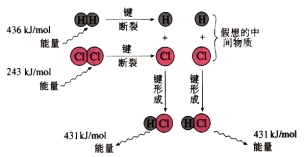
微观上:化学键的断裂和形成,旧键断裂需要________能量,新键形成会________能量。
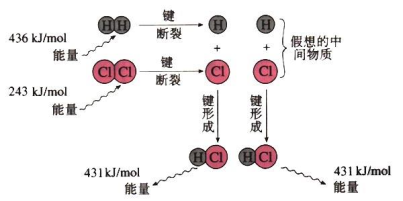
【讲解】产生能量变化的原因在微观角度是由于化学反应过程中旧化学键的断裂会吸收热量,新化学键的形成会放出热量,断键吸收的热量与成键放出的能量不同,从而表现为化学反应吸收热量、放出热量。在宏观角度看,则是反应物与生成物的总能量不同,从而表现为化学反应吸收热量、放出热量。
【思考交流】3、化学反应过程中能量的释放还是吸收是以发生变化的物质本身为基础的,那么能量的多少是以什么为基础的?用什么来量度呢?
【分析】2、反应热与焓变
化学反应为什么会产生反应热?这是因为化学反应前后体系的内能(符
号为U)发生了变化。内能是体系内物质的各种能量的总和,受温度、压强
和物质的聚集状态等影响。
为了描述等压条件下的反应热,科学上引入了一个与内能有关的物理
量——焓,用符号H表示。研究表明,在等压条件下进行的化学反应的反应热等于反应的焓变,用ΔH来表示。ΔH的常用单位是kJ/mol 。
根据规定,当反应体系放热时其焓减小,ΔH为负值,即ΔH < 0。当反
应体系吸热时其焓增大,ΔH为正值,即ΔH > 0。
【讲解】
从能量守恒(宏观)去探讨
从化学键的键能变化方面(微观)去探讨
旧键断裂 — 吸收能量 新键形成 — 放出能量
▲H=679kJ/mol - 862kJ/mol = -183kJ/mol
【小结】
从能量守恒(宏观)去探讨:∆H=生成物的总能量-反应物的总能量
从化学键的键能变化方面(微观)去探讨:∆H= 反应物的总键能-生成物的总键能
注意:
键能越大,能量越低,物质越稳定。
【活学活用】
1、判断物质的稳定性
C(石墨 s ) = C(金刚石 s ) ΔH = +1.9kJ/mol石墨、金刚石哪个更稳定?
2、相关计算
a.1mol C与 1mol H2O(g) 反应生成 lmol CO(g) 和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H = kJ/mol。
b.拆开 1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,
则1mol N2生成NH3的反应热为 ,
则1mol H2生成NH3的反应热为 。
【师】那我们怎样来测量一个反应吸热还是放热呢?
中和反应反应热的测定:
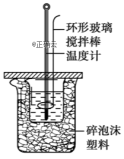
实验仪器:大烧杯、小烧杯、量筒、泡沫塑料或纸条、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。
实验步骤:
①如图组装实验装置。
②用一个量筒量取50 mL 0.50 mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。并将温度计上的酸用水冲洗干净。
③用另一个量筒量取50 mL 0.55 mol/L的NaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。
④把套有盖板的温度计和环形玻璃搅拌棒,放入小烧杯中的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯,盖好盖板,用环形玻璃搅拌棒轻轻搅动,测量混合溶液最高温度,记入下表。
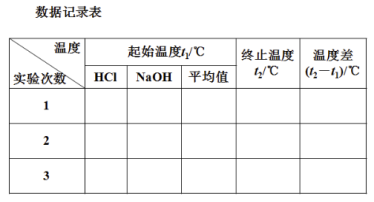
⑤数据记录和处理
⑥计算。取三次测量的平均值为计算依据。
结论:大量实验测得,在25℃和101kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 mol H2O时,放出57.3 kJ的热量。
【讲解】注:强酸与弱碱反应,强碱与弱酸、弱酸和弱碱反应生成1molH2O放出的热小于57.3KJ/mol
【活学活用】
若将1L1mol/LNaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应时的热效应分别为△H1、△H2 、△H3 ;则三者的大小
关系为 。
【课堂小结】
【板书设计】
化学反应的热效应1、反应热
反应热定义
放热反应
吸热反应
2、反应热与焓变
3、中和反应反应热的测定
高中化学人教版 (2019)选择性必修1第二节 反应热的计算优质教学设计及反思: 这是一份高中化学人教版 (2019)选择性必修1第二节 反应热的计算优质教学设计及反思,共6页。教案主要包含了教学目标,教学重难点,教学过程,学生活动,提炼概念,思考交流,回扣释疑,演练获得等内容,欢迎下载使用。
高中人教版 (2019)第一章 化学反应的热效应第一节 反应热优秀第2课时教学设计及反思: 这是一份高中人教版 (2019)第一章 化学反应的热效应第一节 反应热优秀第2课时教学设计及反思,共5页。教案主要包含了课标解读,教材分析,学情分析,素养目标,教学重点,教学方法,教学过程,板书设计等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 反应热的计算教案及反思: 这是一份高中化学人教版 (2019)选择性必修1第二节 反应热的计算教案及反思,共3页。教案主要包含了学习目标,教学过程,练习反馈,本课小结,作业,结束语等内容,欢迎下载使用。