


所属成套资源:人教版化学选择性必修1教案全册
高中化学第二章 化学反应速率与化学平衡第一节 化学反应速率精品教案设计
展开
这是一份高中化学第二章 化学反应速率与化学平衡第一节 化学反应速率精品教案设计,共6页。教案主要包含了教学目标,教学重难点,教学过程,基础初探,思考交流,课堂专练,重难点详解,归纳小结等内容,欢迎下载使用。
第二章 化学反应速率与化学平衡第一节 化学反应速率第一课时 化学反应速率【教学目标】1.知道化学反应速率的表示方法。 2.掌握化学反应速率的简单计算,学会化学反应速率的测定方法,学会比较化学反应速率的快慢。【教学重难点】重点:化学反应速率的表示方法、计算难点:化学反应速率计算【教学过程】一、导入新课都说桂林山水甲天下,其实桂林的溶洞也十分漂亮,溶洞的形成是石灰岩地区地下水长期溶蚀的结果,这是经过了亿万年岁月的沉淀,发生的化学反应是非常慢的,慢的化学反应不常见,但是快的化学反应在生活中随处可见,同学们可以举出一些例子出来吗?可以发现化学反应是有快慢之分的。二、新课讲授【师】必修二我们学过化学反应速率,你都掌握了哪些内容,说来听听……【学生】讨论回答【讲解】一、化学反应速率定义:化学反应速率可用单位时间内反应物浓度的减少或生成物浓度的增加来表示(取正值)。表达方法:在容积不变的反应器中,通常是用单位时间内反应物浓度的减少或生成物浓度的增加来表示表达式:V=Δc/Δt 单位:mol/(L·min)或mol/(L·s)【基础初探】例题:反应4NH3+5O2 4NO+6H2O 在5升的密闭容器中进行,30秒后,NO 的物质的量增加了0.3mol,此反应的平均反应速率用NO来表示为多少?【学生】计算:v(NO)=0.002mol/L·s【思考交流】问题1:若用O2的浓度变化来表示此反应速率是多少?【学生】计算:v(O2)=0.0025mol/L·s【思考交流】问题2:v(NO)=0.002mol/L·s 与v(O2)=0.0025mol/L·s是否表示此反应的同一种速率?数值上有何规律?【讲解】1、在同一反应体系中用不同的物质来表示反应速率时,其数值是可以不同的,但是这些数值都表示同一个反应速率。因此化学反应速率的表示必须说明用哪种物质来做标准。2、用同一反应体系中不同物质表示同一速率时,其数值比一定等于化学方程式中相应的化学计量数之比。【思考交流】问题3:小结化学反应速率表示时的注意点、规律【总结】有关化学反应速率的注意事项1.化学反应速率的研究对象:所有化学反应。2.化学反应速率通常指的是某物质在某一时间内化学反应的平均速率,而不是在某一时刻的瞬时速率。3.化学反应速率均为正值,没有负值。4.由于在反应中纯固体和纯液体的浓度是恒定不变的,因此对于有纯液体或纯固体参加的反应一般不用纯固体或纯液体来表示化学反应速率。5.对于同一化学反应,在相同的反应时间段内,用不同的物质来表示其反应速率,其数值可能不同,但这些不同的数值表示的都是同一个反应的速率。因此,表示化学反应的速率时,必须指明是用反应体系中的何种物质。6.对某一个化学反应来说,用不同物质的浓度表示化学反应速率时,数值往往不同,其数值之比等于化学方程式中的化学计量数之比。【课堂专练】见课件【重难点详解】二、化学反应速率的计算1.化学反应速率的计算(1)利用化学反应速率的表达式:v(B)=。(2)同一化学反应,用不同物质的浓度变化表示的化学反应速率之比等于反应方程式中相应的物质的化学计量数之比,这是有关化学反应速率的计算或换算的依据。(3)求解化学反应速率的计算题一般按以下步骤:①写出有关反应的化学方程式。②找出各物质的起始浓度,转化浓度,某时刻浓度。(或起始物质的量,转化物质的量,某时刻物质的量)③根据已知条件列方程计算。例如:反应 mA + nB ![]() pC起始浓度(mol/L) a b c转化浓度(mol/L) x 某时刻浓度(mol/L) a-x b- c+【课堂专练】见课件【重难点详解】三、化学反应速率的应用 1、用不同的物质来表示反应速率。例1、反应4NH3 + 5O2 === 4NO + 6H2O 在5L的密闭容器中进行,30s后恢复到室温时,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为:( )A、v (O2)=0.01 mol/L·s B、 v (NO)=0.008 mol/L·sC、 v (H2O)=0.003 mol/L·s D、 v (NH3)=0.002 mol/L·s 2、比较反应速率的大小例2、反应A + 3B == 2C + 2D在四种不同情况下的反应速率分别为①V(A) = 0.15mol·L-1·s-1 ②V(B) = 0.6mol·L-1·s-1 ③V(C) = 0.4mol·L-1·s-1 ④V(D) = 0.45mol·L-1·s-1 则该反应在不同条件下速率快慢顺序 【归纳小结】解法: 对于同一化学反应速率用不同物质表示的数值可能不同,但比较反应速率的大小不能只看数值的大小,而要进行一定的转化,具体比较方法如下:(1)归一法:将不同物质的化学反应速率转化成同一物质的化学反应速率。(2)比值法:比较同一物质化学反应速率的数值或分别除以相应物质的化学计量数之后的数值。数值越大,反应进行得越快。3、根据各物质的浓度变化量之比写出化学方程式。例3、某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的量浓度分别为:c(X2)=0.4mol/L , c(Y2)=0.8mol/L ,c(Z)=0.4mol/L,则该反应的反应方程式可表示为:4、根据各物质的反应速率之比写出化学方程式。例4、在密闭容器中A与B反应生成C,其反应速率分别用V(A)、V(B)、V(C)表示。已知V(A)、V(B)、V(C)之间有以下关系2V(B)==3V(A),3V(C)==2V(B)。则此反应可表示为( ) A、2A+3B==2C B、A+3B==2C C、3A+B==2C D、A+B==C【课堂专练】见课件【讲解】四、化学反应速率的测定1.化学反应速率是通过实验测定的。2.(1)直接可测量或观察的性质,如释放出气体的体积和颜色的深浅变化。(2)依靠科学仪器才能测量的性质,如体系的压强、光的吸收、光的发射、导电能力等。(3)在溶液中,当反应物或产物本身有比较明显的颜色时,常常利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应速率。(4)安装如图所示的两套装置A、B(锌粒大小相同),通过分液漏斗分别加入40 mL 1 mol·L-1和40 mL 4 mol·L-1的硫酸后都立即产生气泡,我们可以根据①产生10 mL的氢气所需要的__ ___,②1分钟收集H2的体积来判断A、B两套装置的反应速率大小。
pC起始浓度(mol/L) a b c转化浓度(mol/L) x 某时刻浓度(mol/L) a-x b- c+【课堂专练】见课件【重难点详解】三、化学反应速率的应用 1、用不同的物质来表示反应速率。例1、反应4NH3 + 5O2 === 4NO + 6H2O 在5L的密闭容器中进行,30s后恢复到室温时,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为:( )A、v (O2)=0.01 mol/L·s B、 v (NO)=0.008 mol/L·sC、 v (H2O)=0.003 mol/L·s D、 v (NH3)=0.002 mol/L·s 2、比较反应速率的大小例2、反应A + 3B == 2C + 2D在四种不同情况下的反应速率分别为①V(A) = 0.15mol·L-1·s-1 ②V(B) = 0.6mol·L-1·s-1 ③V(C) = 0.4mol·L-1·s-1 ④V(D) = 0.45mol·L-1·s-1 则该反应在不同条件下速率快慢顺序 【归纳小结】解法: 对于同一化学反应速率用不同物质表示的数值可能不同,但比较反应速率的大小不能只看数值的大小,而要进行一定的转化,具体比较方法如下:(1)归一法:将不同物质的化学反应速率转化成同一物质的化学反应速率。(2)比值法:比较同一物质化学反应速率的数值或分别除以相应物质的化学计量数之后的数值。数值越大,反应进行得越快。3、根据各物质的浓度变化量之比写出化学方程式。例3、某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的量浓度分别为:c(X2)=0.4mol/L , c(Y2)=0.8mol/L ,c(Z)=0.4mol/L,则该反应的反应方程式可表示为:4、根据各物质的反应速率之比写出化学方程式。例4、在密闭容器中A与B反应生成C,其反应速率分别用V(A)、V(B)、V(C)表示。已知V(A)、V(B)、V(C)之间有以下关系2V(B)==3V(A),3V(C)==2V(B)。则此反应可表示为( ) A、2A+3B==2C B、A+3B==2C C、3A+B==2C D、A+B==C【课堂专练】见课件【讲解】四、化学反应速率的测定1.化学反应速率是通过实验测定的。2.(1)直接可测量或观察的性质,如释放出气体的体积和颜色的深浅变化。(2)依靠科学仪器才能测量的性质,如体系的压强、光的吸收、光的发射、导电能力等。(3)在溶液中,当反应物或产物本身有比较明显的颜色时,常常利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应速率。(4)安装如图所示的两套装置A、B(锌粒大小相同),通过分液漏斗分别加入40 mL 1 mol·L-1和40 mL 4 mol·L-1的硫酸后都立即产生气泡,我们可以根据①产生10 mL的氢气所需要的__ ___,②1分钟收集H2的体积来判断A、B两套装置的反应速率大小。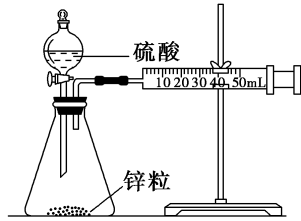 【课堂专练】见课件【课堂小结】【板书设计】化学反应速率1、化学反应速率2、化学反应速率的测定
【课堂专练】见课件【课堂小结】【板书设计】化学反应速率1、化学反应速率2、化学反应速率的测定
相关教案
这是一份人教版 (2019)选择性必修1第一节 化学反应速率公开课教案设计,共10页。教案主要包含了教学目标,教学重难点,教学过程,情景导入,实验探究1,学生活动,名师点拨,实验探究2等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第一节 原电池教案,共22页。
这是一份人教版 (2019)第二章 化学反应速率与化学平衡第一节 化学反应速率教案,共2页。教案主要包含了教学目标,教学重难点,教学过程等内容,欢迎下载使用。










