


所属成套资源:人教版化学选择性必修1教案全册
高中化学人教版 (2019)选择性必修1第二节 化学平衡优秀教案及反思
展开
这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡优秀教案及反思,共6页。教案主要包含了教学目标,教学重难点,教学过程,回顾旧知,基础初探,思考交流,课堂练习,课堂小结等内容,欢迎下载使用。
第二章 化学反应速率与化学平衡 第二节 化学平衡 第1课时 教学设计【教学目标】1.通过化学平衡状态的建立过程,知道化学平衡是一种动态平衡。2.知道化学平衡状态的特征,判断反应是否达到化学平衡状态。【教学重难点】化学平衡状态的判断【教学过程】1.新课导入【回顾旧知】 

 对于一些反应,我们在进行化学计算时,从未关心过反应能否进行彻底的问题,即限度问题,各种反应物之间是一种“同归于尽”或者“你死我活”的关系。它们不存在限度,即反应能进行彻底【基础初探】
对于一些反应,我们在进行化学计算时,从未关心过反应能否进行彻底的问题,即限度问题,各种反应物之间是一种“同归于尽”或者“你死我活”的关系。它们不存在限度,即反应能进行彻底【基础初探】 而对于有些反应或者过程,它们就有限度,即反应不能进行彻底。其实对于限度,我们并不陌生,比如某种固体在水中的溶解就存在限度
而对于有些反应或者过程,它们就有限度,即反应不能进行彻底。其实对于限度,我们并不陌生,比如某种固体在水中的溶解就存在限度
![]() 但是经过仔细的长时间观察发现:饱和溶液并不是一个静止的系统,未溶解的那一部分固体,其质量虽然不变,但是他的外形却在变化,小晶体会长大,有的棱角会消失。
但是经过仔细的长时间观察发现:饱和溶液并不是一个静止的系统,未溶解的那一部分固体,其质量虽然不变,但是他的外形却在变化,小晶体会长大,有的棱角会消失。 【思考交流】既然“固体溶解”和“溶液结晶”这两个过程一直存在,为什么在起初,我们只看到了其中之一的“固体溶解”;而在溶液饱和后,一个也看不到了。
【思考交流】既然“固体溶解”和“溶液结晶”这两个过程一直存在,为什么在起初,我们只看到了其中之一的“固体溶解”;而在溶液饱和后,一个也看不到了。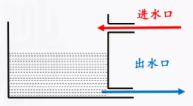
 可逆过程虽然永远有两个相反的方向,但是因为二者速率不等,我们永远只能观察到那个速率相对较大的过程,而当二者速率相等时,我们在宏观上将看不到任何变化。就像上图水池的水位变化一样。2.新课讲授【板书】一、可逆反应【设疑】很多化学反应是可逆的。什么是可逆反应?可逆反应有什么特点?【师】1、在相同条件下,既能向正反应方向进行又能向逆反应方向进行的化学反应。可逆反应用
可逆过程虽然永远有两个相反的方向,但是因为二者速率不等,我们永远只能观察到那个速率相对较大的过程,而当二者速率相等时,我们在宏观上将看不到任何变化。就像上图水池的水位变化一样。2.新课讲授【板书】一、可逆反应【设疑】很多化学反应是可逆的。什么是可逆反应?可逆反应有什么特点?【师】1、在相同条件下,既能向正反应方向进行又能向逆反应方向进行的化学反应。可逆反应用![]() 连接,把从左向右进行的反应称作正反应,从右向左的进行的反应称作逆反应。2、特点:可逆反应具有双向性、双同性、共存性。3、常见的可逆反应
连接,把从左向右进行的反应称作正反应,从右向左的进行的反应称作逆反应。2、特点:可逆反应具有双向性、双同性、共存性。3、常见的可逆反应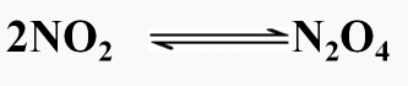
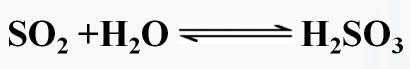
![]()
![]()
![]()
![]()
![]()
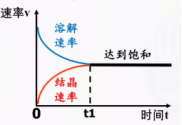
![]() 【思考交流】只有可逆反应才有限度,才有化学平衡,那么什么是化学平衡?【师】以CO+H2O
【思考交流】只有可逆反应才有限度,才有化学平衡,那么什么是化学平衡?【师】以CO+H2OCO2+H2为例,有关物质的浓度随时间变化如图所示。【生】开始时,反应物浓度最大,正反应速率最大,生成物浓度为0,逆反应速率为0;反应过程中,反应物浓度逐渐减小,正反应速率也逐渐减小,生成物浓度逐渐增大,逆反应速率也逐渐增大;一段时间后,达到平衡,此时各组分浓度保持不变,正反应速率等于逆反应速率。【师】我们可以借助图像来理解化学平衡的建立。
 【板书】二、化学平衡的建立【师】当正、逆反应的速率相等时,反应物和生成物的浓度均保持不变,即体系的组成不随时间而改变,这表明该反应中物质的转化达到了“限度”,这时的状态我们称之为化学平衡状态,简称化学平衡。化学平衡是一种动态平衡。【板书】三、化学平衡状态强调:对象:可逆反应实质:正反应速率=逆反应速率标志:反应混合物中各组分的浓度保持不变的状态【师】根据化学平衡的概念,想一想化学平衡的使用范围、内在本质、外在标志、条件及特征。【生】思考并回答。【板书】四、化学平衡的特征【讲解】①逆 研究的对象是可逆反应②等 即正反应速率和逆反应速率相等③动 正、逆反应速率相等但不为0,化学平衡为一动态平衡④定 条件一定时,平衡体系中各组分的含量保持不变⑤变 改变条件,平衡一般要发生移动,直至建立新的平衡【思考交流】怎样证明一个可逆反应达到平衡状态了?就是找证据:正逆相等;变量不变。【师】化学平衡状态是指在一定条件下的可逆反应,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。这也是判断化学平衡的直接依据。【设疑】判断化学平衡还有哪些依据?【板书】五、化学平衡状态的判断方法【总结】化学平衡状态的判断方法1.直接判断:(1)v正=v逆≠0(即同一物质的消耗速率与生成速率相等)(2)各物质的浓度保持不变。2.间接判断:(1)各物质的百分含量保持不变(2)各物质的物质的量不随时间的改变而改变。(3)各气体的体积不随时间的改变而改变。(4)反应物的转化率保持不变。(5)平衡体系的颜色保持不变。(6)绝热的恒容反应体系中的温度保持不变。3.特殊判断:①混合气体的总压强、总体积、总物质的量不随时间改变而—改变—,(适用于——————m+n≠p 的反应——)
【板书】二、化学平衡的建立【师】当正、逆反应的速率相等时,反应物和生成物的浓度均保持不变,即体系的组成不随时间而改变,这表明该反应中物质的转化达到了“限度”,这时的状态我们称之为化学平衡状态,简称化学平衡。化学平衡是一种动态平衡。【板书】三、化学平衡状态强调:对象:可逆反应实质:正反应速率=逆反应速率标志:反应混合物中各组分的浓度保持不变的状态【师】根据化学平衡的概念,想一想化学平衡的使用范围、内在本质、外在标志、条件及特征。【生】思考并回答。【板书】四、化学平衡的特征【讲解】①逆 研究的对象是可逆反应②等 即正反应速率和逆反应速率相等③动 正、逆反应速率相等但不为0,化学平衡为一动态平衡④定 条件一定时,平衡体系中各组分的含量保持不变⑤变 改变条件,平衡一般要发生移动,直至建立新的平衡【思考交流】怎样证明一个可逆反应达到平衡状态了?就是找证据:正逆相等;变量不变。【师】化学平衡状态是指在一定条件下的可逆反应,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。这也是判断化学平衡的直接依据。【设疑】判断化学平衡还有哪些依据?【板书】五、化学平衡状态的判断方法【总结】化学平衡状态的判断方法1.直接判断:(1)v正=v逆≠0(即同一物质的消耗速率与生成速率相等)(2)各物质的浓度保持不变。2.间接判断:(1)各物质的百分含量保持不变(2)各物质的物质的量不随时间的改变而改变。(3)各气体的体积不随时间的改变而改变。(4)反应物的转化率保持不变。(5)平衡体系的颜色保持不变。(6)绝热的恒容反应体系中的温度保持不变。3.特殊判断:①混合气体的总压强、总体积、总物质的量不随时间改变而—改变—,(适用于——————m+n≠p 的反应——) ②混合气体的平均相对分子质量
②混合气体的平均相对分子质量 ③混合气体的密度
③混合气体的密度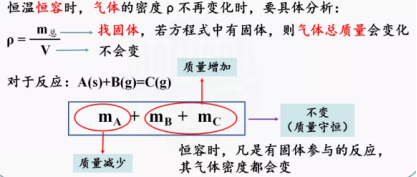 ⑷在等系数的气体反应中不能作为平衡判据的是气体的总压、气体的总的物质的量、混合气体的平均相对分子质量、混合气体的密度、反应混合物平衡时物质的量之比。 【课堂练习】例3、在一定温度下,向aL密闭容器中加入1molX气体和2molY气体发生如下反应:X(g)+2Y(g) 2Z(g),此反应达到平衡的标志是:( ) A、容器内压强不随时间变化 B、容器内各物质的浓度不随时间变化 C、容器内X、Y、Z的浓度之比为1:2:2 D、单位时间消耗0.1molX的同时生成0.2molZ 【课堂小结】 【板书设计】 2.2.1化学平衡状态一、化学平衡的建立
⑷在等系数的气体反应中不能作为平衡判据的是气体的总压、气体的总的物质的量、混合气体的平均相对分子质量、混合气体的密度、反应混合物平衡时物质的量之比。 【课堂练习】例3、在一定温度下,向aL密闭容器中加入1molX气体和2molY气体发生如下反应:X(g)+2Y(g) 2Z(g),此反应达到平衡的标志是:( ) A、容器内压强不随时间变化 B、容器内各物质的浓度不随时间变化 C、容器内X、Y、Z的浓度之比为1:2:2 D、单位时间消耗0.1molX的同时生成0.2molZ 【课堂小结】 【板书设计】 2.2.1化学平衡状态一、化学平衡的建立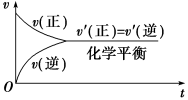 二、化学平衡的状态特征:逆、等、动、定、变判断化学平衡状态的依据v正=v逆≠0(即同一物质的消耗速率与生成速率相等)各物质的浓度保持不变。
二、化学平衡的状态特征:逆、等、动、定、变判断化学平衡状态的依据v正=v逆≠0(即同一物质的消耗速率与生成速率相等)各物质的浓度保持不变。
相关教案
这是一份高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡公开课教案及反思,共9页。教案主要包含了教学目标,教学重难点,教学过程,思考交流,课堂小结,板书设计等内容,欢迎下载使用。
这是一份高中人教版 (2019)第二节 化学平衡精品教学设计及反思,共6页。教案主要包含了教学目标,教学重难点,教学过程,探究活动,学生活动,课堂专练,课堂小结等内容,欢迎下载使用。
这是一份高三化学一轮复习 化学平衡状态判断的习题 教案,共3页。










