


所属成套资源:人教版化学选择性必修1教案全册
高中人教版 (2019)第二节 化学平衡精品教学设计及反思
展开
这是一份高中人教版 (2019)第二节 化学平衡精品教学设计及反思,共6页。教案主要包含了教学目标,教学重难点,教学过程,探究活动,学生活动,课堂专练,课堂小结等内容,欢迎下载使用。
第二章 化学反应速率与化学平衡 第二节 化学平衡 第2课时 化学平衡常数【教学目标】1.知道化学平衡常数的含义,会根据化学反应书写化学平衡常数表达式。2.应用化学平衡常数判断可逆反应进行的程度、方向以及反应的热效应。3.能够利用化学平衡常数进行简单的计算。【教学重难点】1.重点(1)知道化学平衡常数的含义,并能利用化学平衡常数对化学反应进行程度的判断(2)运用化学平衡常数进行简单计算2.难点运用化学平衡常数进行简单计算【教学过程】1.新课导入【探究活动】在一定温度下,化学平衡体系中反应物浓度与生成物浓度之间有什么关系呢?我们以反应H2(g)+I2(g)![]() 2HI(g)为例进行分析。分析并验算表中所给的数据,最后可以得到什么结论?【投影】在457.6℃时,该反应体系中各物质的浓度如下表所示:
2HI(g)为例进行分析。分析并验算表中所给的数据,最后可以得到什么结论?【投影】在457.6℃时,该反应体系中各物质的浓度如下表所示: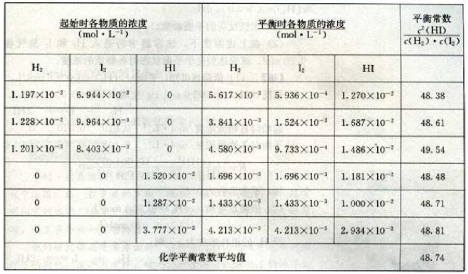 【师】分析上表的数据,可以得出以下结论:【投影】结论通过分析实验数据得出:1、温度不变时,
【师】分析上表的数据,可以得出以下结论:【投影】结论通过分析实验数据得出:1、温度不变时, ![]() 为常数 用K表示;2、常数K与反应的起始浓度大小无关;3、常数K与正向建立还是逆向建立平衡无关即与平衡建立的过程无关。2.新课讲授【板书】 一、化学平衡常数【讲解】在一定温度下,可逆反应无论是从正反应开始,还是从逆反应开始,又无论反应物起始浓度为多少,最后都能达到化学平衡。这时生成物的浓度幂之积与反应物浓度幂之积的比是一个常数,这个常数叫做该反应的化学平衡常数,简称平衡常数,用符号K表示。[投影]1. 定义:在一定温度下,可逆反应达到平衡时,生成物的浓度幂之积与反应物浓度幂之积的比是一个常数,这个常数叫做该反应的化学平衡常数,简称平衡常数,用符号K表示。【师】刚才得出的平衡常数K是由一个特殊的反应引出的,其
为常数 用K表示;2、常数K与反应的起始浓度大小无关;3、常数K与正向建立还是逆向建立平衡无关即与平衡建立的过程无关。2.新课讲授【板书】 一、化学平衡常数【讲解】在一定温度下,可逆反应无论是从正反应开始,还是从逆反应开始,又无论反应物起始浓度为多少,最后都能达到化学平衡。这时生成物的浓度幂之积与反应物浓度幂之积的比是一个常数,这个常数叫做该反应的化学平衡常数,简称平衡常数,用符号K表示。[投影]1. 定义:在一定温度下,可逆反应达到平衡时,生成物的浓度幂之积与反应物浓度幂之积的比是一个常数,这个常数叫做该反应的化学平衡常数,简称平衡常数,用符号K表示。【师】刚才得出的平衡常数K是由一个特殊的反应引出的,其![]() ,但如果对于任意一个可逆化学反应:mA+nB
,但如果对于任意一个可逆化学反应:mA+nB ![]() pC+qD其平衡常数K又该如何表示呢?【讲解】平衡常数实际上是平衡混合物中各生成物浓度的化学计量数次方的乘积除以反应物浓度的化学计量数次方的乘积。即 K
pC+qD其平衡常数K又该如何表示呢?【讲解】平衡常数实际上是平衡混合物中各生成物浓度的化学计量数次方的乘积除以反应物浓度的化学计量数次方的乘积。即 K![]() 【板书】2. 表达式对于任意反应mA+nB
【板书】2. 表达式对于任意反应mA+nB ![]() pC+qD K=
pC+qD K=![]() 【师】那么有哪些注意事项呢?【学生活动】 (1)化学平衡常数只与温度有关,与反应物或生成物的浓度变化无关。 (2)反应物或生成物中有固体或纯液体存在时,由于其浓度可看作“1”而不代入公式。 (3)化学平衡常数是指某一具体反应的平衡常数。 ①若反应方向改变,则平衡常数改变。 ②若化学方程式中各物质的化学计量数成比例扩大或缩小,尽管是同一反应,平衡常数也会改变。【提问】化学平衡常数实际上是化学平衡的又一特征,那么化学平衡常数K的大小有什么意义呢?【讲解】可以从平衡常数K的大小推断反应进行的程度,K只受温度影响,K越大,表示化学反应达到平衡时生成物浓度对反应物浓度的比越大,也就是反应进行的程度越大,反应的转化率也越大;反之K越小,表示反应进行的程度越小,反应物的转化率也越小。【投影】4. 化学平衡常数的意义:平衡常数的大小反映了化学反应进行的程度。一般来说,当K>105时,通常认为反应基本进行完全;当K<10-5时,认为该反应很难进行。【讲解】 5、书写平衡常数关系式的规则⑴ 如果反应中有固体和纯液体参加,它们的浓度不应写在平衡关系式中,因为它们的浓度是固定不变的,化学平衡关系式中只包括气态物质和溶液中各溶质的浓度。⑵ 稀溶液中进行的反应,如有水参加,水的浓度也不必写在平衡关系式中,⑶ 非水溶液中的反应,如有水生成或有水参加反应,此时水的浓度不可视为常数,必须表示在平衡关系式中⑷ 同一化学反应,可以用不同的化学反应式来表示,每个化学方程式都有自己的平衡常数关系式及相应的平衡常数⑸ 多重平衡规则:若干方程式相加(减),则总反应的平衡常数等于分步平衡常数之乘积(商)⑹ 同一化学反应,正、逆反应的平衡常数互为倒数【板书】6、化学平衡常数的应用(1)平衡常数的大小反映了化学反应进行的程度(也叫反应的限度)。K值越大,表示反应进行得越完全,反应物转化率越大;K值越小,表示反应进行得越不完全 ,反应物转化率越小 。【讲解】一般地说,K>105时,该反应进行得就基本完全。【板书】(2)利用K可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应(填“吸热”或“放热”)。若升高温度,K值减小,则正反应为放热反应(填“吸热”或“放热”)。【课堂专练】1、不同温度时,反应:H2(g)+I2(g)--2HI(g),的平衡常数与温度的关系如下:温度623K698K763K浓度平衡常数66 .954.445.9通过改变温度,平衡常数大小的变化趋势可以判断上面可逆反应的正方向是 .【板书】(3)判断正在进行的可逆是否平衡及反应向何方向进行:对于可逆反应:mA(g)+ nB(g)
【师】那么有哪些注意事项呢?【学生活动】 (1)化学平衡常数只与温度有关,与反应物或生成物的浓度变化无关。 (2)反应物或生成物中有固体或纯液体存在时,由于其浓度可看作“1”而不代入公式。 (3)化学平衡常数是指某一具体反应的平衡常数。 ①若反应方向改变,则平衡常数改变。 ②若化学方程式中各物质的化学计量数成比例扩大或缩小,尽管是同一反应,平衡常数也会改变。【提问】化学平衡常数实际上是化学平衡的又一特征,那么化学平衡常数K的大小有什么意义呢?【讲解】可以从平衡常数K的大小推断反应进行的程度,K只受温度影响,K越大,表示化学反应达到平衡时生成物浓度对反应物浓度的比越大,也就是反应进行的程度越大,反应的转化率也越大;反之K越小,表示反应进行的程度越小,反应物的转化率也越小。【投影】4. 化学平衡常数的意义:平衡常数的大小反映了化学反应进行的程度。一般来说,当K>105时,通常认为反应基本进行完全;当K<10-5时,认为该反应很难进行。【讲解】 5、书写平衡常数关系式的规则⑴ 如果反应中有固体和纯液体参加,它们的浓度不应写在平衡关系式中,因为它们的浓度是固定不变的,化学平衡关系式中只包括气态物质和溶液中各溶质的浓度。⑵ 稀溶液中进行的反应,如有水参加,水的浓度也不必写在平衡关系式中,⑶ 非水溶液中的反应,如有水生成或有水参加反应,此时水的浓度不可视为常数,必须表示在平衡关系式中⑷ 同一化学反应,可以用不同的化学反应式来表示,每个化学方程式都有自己的平衡常数关系式及相应的平衡常数⑸ 多重平衡规则:若干方程式相加(减),则总反应的平衡常数等于分步平衡常数之乘积(商)⑹ 同一化学反应,正、逆反应的平衡常数互为倒数【板书】6、化学平衡常数的应用(1)平衡常数的大小反映了化学反应进行的程度(也叫反应的限度)。K值越大,表示反应进行得越完全,反应物转化率越大;K值越小,表示反应进行得越不完全 ,反应物转化率越小 。【讲解】一般地说,K>105时,该反应进行得就基本完全。【板书】(2)利用K可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应(填“吸热”或“放热”)。若升高温度,K值减小,则正反应为放热反应(填“吸热”或“放热”)。【课堂专练】1、不同温度时,反应:H2(g)+I2(g)--2HI(g),的平衡常数与温度的关系如下:温度623K698K763K浓度平衡常数66 .954.445.9通过改变温度,平衡常数大小的变化趋势可以判断上面可逆反应的正方向是 .【板书】(3)判断正在进行的可逆是否平衡及反应向何方向进行:对于可逆反应:mA(g)+ nB(g)![]() pC(g)+ qD(g),在一定的温度下的任意时刻,反应物的浓度和生成物的浓度有如下关系:Qc=Cp(C)·Cq(D)/Cm(A)·Cn(B),叫该反应的浓度商。
pC(g)+ qD(g),在一定的温度下的任意时刻,反应物的浓度和生成物的浓度有如下关系:Qc=Cp(C)·Cq(D)/Cm(A)·Cn(B),叫该反应的浓度商。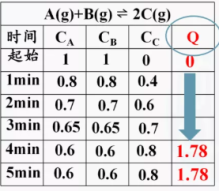 思考:在平衡之前,Q一直在变大,为什么?
思考:在平衡之前,Q一直在变大,为什么?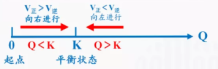 小结:任何可逆反应的最终目标都是Q=K,多退少补,直到平衡Qc<K ,V正>V逆,反应向正反应方向进行Qc=K ,V正==V逆,反应处于平衡状态Qc>K ,V正<V逆,反应向逆反应方向进行【强调】①化学平衡常数表达式中各物质的浓度必须是平衡状态下的浓度,不能用任一时刻的浓度值。②化学平衡常数不表示反应的快慢,即化学反应速率大,K值不一定大。③使用催化剂能改变化学反应速率,但不会改变平衡常数。【课堂专练】 2、高炉炼铁中发生的基本反应如下: FeO(s)+CO(g) Fe(s)+CO2(g) ;△H>0其平衡常数可表达为: K=c(CO2)/c(CO),已知1100℃,K=0.263;1100℃时,测得高炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下该反应是否处于平衡状态_______(填“是”或“否”),此时化学反应向 方向进行,其原因是 。【板书】(4)利用K可计算转化率【提问】什么叫反应物的转化率?【副板书】某指定反应物的转化率=
小结:任何可逆反应的最终目标都是Q=K,多退少补,直到平衡Qc<K ,V正>V逆,反应向正反应方向进行Qc=K ,V正==V逆,反应处于平衡状态Qc>K ,V正<V逆,反应向逆反应方向进行【强调】①化学平衡常数表达式中各物质的浓度必须是平衡状态下的浓度,不能用任一时刻的浓度值。②化学平衡常数不表示反应的快慢,即化学反应速率大,K值不一定大。③使用催化剂能改变化学反应速率,但不会改变平衡常数。【课堂专练】 2、高炉炼铁中发生的基本反应如下: FeO(s)+CO(g) Fe(s)+CO2(g) ;△H>0其平衡常数可表达为: K=c(CO2)/c(CO),已知1100℃,K=0.263;1100℃时,测得高炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下该反应是否处于平衡状态_______(填“是”或“否”),此时化学反应向 方向进行,其原因是 。【板书】(4)利用K可计算转化率【提问】什么叫反应物的转化率?【副板书】某指定反应物的转化率=![]() ×100%【讲解】依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。【讲解】增大平衡体系中反应物的浓度或减小生成物的浓度,浓度积小于平衡常数,平衡向正反应方向移动。【课堂专练】3、在某温度下,将H2(g)和I2(g)各0.1mol混合物充入10L的密闭容器中,充分反应达到平衡时,测得c(H2)=0.0080mol/L求: (1)反应的平衡常数 (2)其它条件不变,充入的H2(g)和I2(g)各0.2mol,求达平衡时各物质的平衡浓度。【课堂小结】1.化学平衡常数的表达式与化学方程式的书写形式相对应,同一个化学反应,其化学方程式不同,平衡常数表达式也不同。2.在温度一定时,对某一具体化学反应来说,化学平衡常数是一个常数,它与浓度无关;但计算平衡常数时又必须用到化学平衡状态下的各物质的浓度。3.利用化学平衡常数进行计算、判断时,要理清是什么状态下的浓度。【板书】2.2.2化学平衡常数一、化学平衡常数1.定义2.表达式K
×100%【讲解】依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。【讲解】增大平衡体系中反应物的浓度或减小生成物的浓度,浓度积小于平衡常数,平衡向正反应方向移动。【课堂专练】3、在某温度下,将H2(g)和I2(g)各0.1mol混合物充入10L的密闭容器中,充分反应达到平衡时,测得c(H2)=0.0080mol/L求: (1)反应的平衡常数 (2)其它条件不变,充入的H2(g)和I2(g)各0.2mol,求达平衡时各物质的平衡浓度。【课堂小结】1.化学平衡常数的表达式与化学方程式的书写形式相对应,同一个化学反应,其化学方程式不同,平衡常数表达式也不同。2.在温度一定时,对某一具体化学反应来说,化学平衡常数是一个常数,它与浓度无关;但计算平衡常数时又必须用到化学平衡状态下的各物质的浓度。3.利用化学平衡常数进行计算、判断时,要理清是什么状态下的浓度。【板书】2.2.2化学平衡常数一、化学平衡常数1.定义2.表达式K![]() 二、化学平衡常数的应用1.判断反应进行的程度2.利用K可判断反应的热效应3.计算转化率4.判断平衡移动方向
二、化学平衡常数的应用1.判断反应进行的程度2.利用K可判断反应的热效应3.计算转化率4.判断平衡移动方向
相关教案
这是一份高中化学人教版 (2019)选择性必修1第一节 原电池优质课教案设计,共8页。教案主要包含了教学目标,教学重难点,教学过程,设计意图,引入课题,思考交流,课堂专练,规律小结等内容,欢迎下载使用。
这是一份高中人教版 (2019)第四节 化学反应的调控优质教案,共6页。教案主要包含了导入新课,新课讲授等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡优秀教案及反思,共6页。教案主要包含了教学目标,教学重难点,教学过程,回顾旧知,基础初探,思考交流,课堂练习,课堂小结等内容,欢迎下载使用。










