所属成套资源:人教版化学选择性必修1教案全册
新人教版化学选择性必修一 3.2.1 水的电离 教案
展开
这是一份新人教版化学选择性必修一 3.2.1 水的电离 教案,共5页。
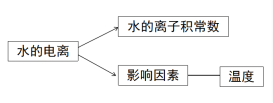
第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH第1课时 水的电离【教学目标】1认识水的电离。2 了解水的离子积常数。3 了解水的电离平衡及影响因素。【教学重难点】影响水的电离平衡的因素【教学过程】1.新课导入【设疑】 通过前面的学习,我们已经知道水是弱电解质,通过实验表明,纯水大部分以水分子的形式存在,那么我们如何定量的得出水电离程度的大小呢?今天我们就来学习水的电离!2.新课讲授【展示】水分子的电离过程【板书】
通过前面的学习,我们已经知道水是弱电解质,通过实验表明,纯水大部分以水分子的形式存在,那么我们如何定量的得出水电离程度的大小呢?今天我们就来学习水的电离!2.新课讲授【展示】水分子的电离过程【板书】 ![]()
![]() 【设疑】作为弱电解质,水的电离平衡受哪些外界因素影响?【学生回答】温度、离子浓度(H+、OH-)等影响【思考交流】对常温下的纯水进行下列操作,完成下表:加入试剂酸碱性水的电离平衡移动方向c(H+)c(OH-)c(H+) 与c(OH-)大小关系加 热 HCl气体 NaOH 活泼金属 NH4Cl 【归纳小结】1、不同的溶液中,c(H+)与c(OH-)不一定相等,但由水电离产生的c(H+)与c(OH-)一定相等; 2、加入酸或碱,抑制水的电离; 3、加入弱碱阳离子或弱酸阴离子,促进水的电离;4、无论是酸溶液还是碱溶液中都同时存在H+和OH-!【课堂练习】见课件【名师点拨】水的电离平衡类题的解答步骤解题步骤解题注意事项第一步:写电离方程式写出水的电离方程式与水的离子积表达式,并熟悉离子积表达式中各量之间的关系第二步:分析加入的物质分析加入物质后,该物质电离出的离子的性质或该物质与水反应后的离子的性质,分析这些离子对水的电离的影响第三步:确定合理选项根据以上分析,对比四个选项,确定正确的答案【课堂练习】见课件 【讲解】常温下,水中c(H+)=c(OH-)=1.0×10-7mol/L,也就是1L水中只有10-7mol发生了电离,而1L水的物质的量为55.6mol,c(H2O)几乎没变。当水的电离达到平衡时,电离产物H+和OH-浓度之积是一个常数,记作Kw。Kw叫做水的离子积常数,简称水的离子积。【板书】
【设疑】作为弱电解质,水的电离平衡受哪些外界因素影响?【学生回答】温度、离子浓度(H+、OH-)等影响【思考交流】对常温下的纯水进行下列操作,完成下表:加入试剂酸碱性水的电离平衡移动方向c(H+)c(OH-)c(H+) 与c(OH-)大小关系加 热 HCl气体 NaOH 活泼金属 NH4Cl 【归纳小结】1、不同的溶液中,c(H+)与c(OH-)不一定相等,但由水电离产生的c(H+)与c(OH-)一定相等; 2、加入酸或碱,抑制水的电离; 3、加入弱碱阳离子或弱酸阴离子,促进水的电离;4、无论是酸溶液还是碱溶液中都同时存在H+和OH-!【课堂练习】见课件【名师点拨】水的电离平衡类题的解答步骤解题步骤解题注意事项第一步:写电离方程式写出水的电离方程式与水的离子积表达式,并熟悉离子积表达式中各量之间的关系第二步:分析加入的物质分析加入物质后,该物质电离出的离子的性质或该物质与水反应后的离子的性质,分析这些离子对水的电离的影响第三步:确定合理选项根据以上分析,对比四个选项,确定正确的答案【课堂练习】见课件 【讲解】常温下,水中c(H+)=c(OH-)=1.0×10-7mol/L,也就是1L水中只有10-7mol发生了电离,而1L水的物质的量为55.6mol,c(H2O)几乎没变。当水的电离达到平衡时,电离产物H+和OH-浓度之积是一个常数,记作Kw。Kw叫做水的离子积常数,简称水的离子积。【板书】![]() 【补充】Kw可由实验测得,也可通过理论计算求得。【展示】不同温度下的水的离子积常数。【讲解】通过数据,我们可以知道室温下,水的离子积常数
【补充】Kw可由实验测得,也可通过理论计算求得。【展示】不同温度下的水的离子积常数。【讲解】通过数据,我们可以知道室温下,水的离子积常数![]() 。【板书】25℃,
。【板书】25℃,![]() 。【强调】不仅适用于纯水还适用于酸、碱、盐的稀溶液。根据数据,我们可知,水的离子积只受温度的影响,温度升高,K增大。【设疑】Kw=c(H+)·c(OH-),c(H+)、c(OH-)就是水电离出的c(H+)和c(OH-),是否正确?为什么?【回答】不正确。c(H+)和c(OH-)是整个溶液中的c(H+)和c(OH-),不一定都是由水电离出来的。【追问】温度既然对水的离子积常数有影响,对水的电离平衡有什么影响?【生】水的电离是吸热反应,所以升高温度,会使水的电离平衡右移,导致c(H+)增大,c(OH-)增大,Kw增大。【名师点拨】 (1)无论水的电离程度是增大还是减小,纯水都呈中性。(2)Kw只受温度影响,稀酸和稀碱溶液中Kw=10-14。(3)改变c(OH-)或c(H+),只能改变水的电离程度,不能改变Kw。(4)改变温度,Kw和水的电离程度都改变。三、利用Kw的定量计算2、室温下,0.01mol/L盐酸溶液中 c(H+)、 c(OH-)分别为多少?由水电离出的c(H+)H2O、c(OH-)H2O分别是多少?为什么?【名师点拨】①不同的溶液中,c(H+)与c(OH-)不一定相等,但由水电离产生的c(H+)与c(OH-)一定相等,判断溶液中水的电离程度时,酸溶液看c(OH-),碱溶液看c(H+)。②25 ℃,任何稀的电解质水溶液中c(H+)·c(OH-)=KW这一关系不变,当改变其他条件使c(H+)增大时,c(OH-)必然降低,反之亦然。【课堂练习】见课件【课堂小结】 【板书设计】3.2.1水的电离
。【强调】不仅适用于纯水还适用于酸、碱、盐的稀溶液。根据数据,我们可知,水的离子积只受温度的影响,温度升高,K增大。【设疑】Kw=c(H+)·c(OH-),c(H+)、c(OH-)就是水电离出的c(H+)和c(OH-),是否正确?为什么?【回答】不正确。c(H+)和c(OH-)是整个溶液中的c(H+)和c(OH-),不一定都是由水电离出来的。【追问】温度既然对水的离子积常数有影响,对水的电离平衡有什么影响?【生】水的电离是吸热反应,所以升高温度,会使水的电离平衡右移,导致c(H+)增大,c(OH-)增大,Kw增大。【名师点拨】 (1)无论水的电离程度是增大还是减小,纯水都呈中性。(2)Kw只受温度影响,稀酸和稀碱溶液中Kw=10-14。(3)改变c(OH-)或c(H+),只能改变水的电离程度,不能改变Kw。(4)改变温度,Kw和水的电离程度都改变。三、利用Kw的定量计算2、室温下,0.01mol/L盐酸溶液中 c(H+)、 c(OH-)分别为多少?由水电离出的c(H+)H2O、c(OH-)H2O分别是多少?为什么?【名师点拨】①不同的溶液中,c(H+)与c(OH-)不一定相等,但由水电离产生的c(H+)与c(OH-)一定相等,判断溶液中水的电离程度时,酸溶液看c(OH-),碱溶液看c(H+)。②25 ℃,任何稀的电解质水溶液中c(H+)·c(OH-)=KW这一关系不变,当改变其他条件使c(H+)增大时,c(OH-)必然降低,反之亦然。【课堂练习】见课件【课堂小结】 【板书设计】3.2.1水的电离