
高中化学人教版 (2019)选择性必修1第三节 盐类的水解优秀教学设计
展开
第三章 水溶液中的离子反应与平衡
第三节 盐类的水解
第1课时 盐类的水解
【教学目标】
1.从组成盐的离子成分角度分析盐类水解的本质。
2.以动态平衡的观点分析盐类水解对水电离平衡的影响,掌握盐类水解的规律。
3.以离子方程式的形式,表达盐类水解。
【教学重难点】
盐类水解的规律、盐类水解的离子方程式
【教学过程】
1.新课导入
【创设情境】展示图片
Na2CO3是日常生活中常用的盐,俗称纯碱,常在面点加工时用于中和酸并使食品松软或酥脆,为什么 Na2CO3可被当作“碱”使用呢?
【学生】因为Na2CO3和NaHCO3的水溶液呈碱性。
【进一步思考】 水呈中性、酸呈酸性、碱呈碱性,为什么?溶液的酸碱性与c(H+)、c(OH-)有什么关系?
【学生】酸性:c(H+) > c(OH-);中性:c(H+)=c(OH-);碱性:c(H+) < c(OH-)。
【过渡】 盐溶液的酸碱性如何呢?是否一定是呈中性呢?如何证明?这是我们这节课要探讨的问题。
2.新课讲授
【板书】一、盐溶液的酸碱性
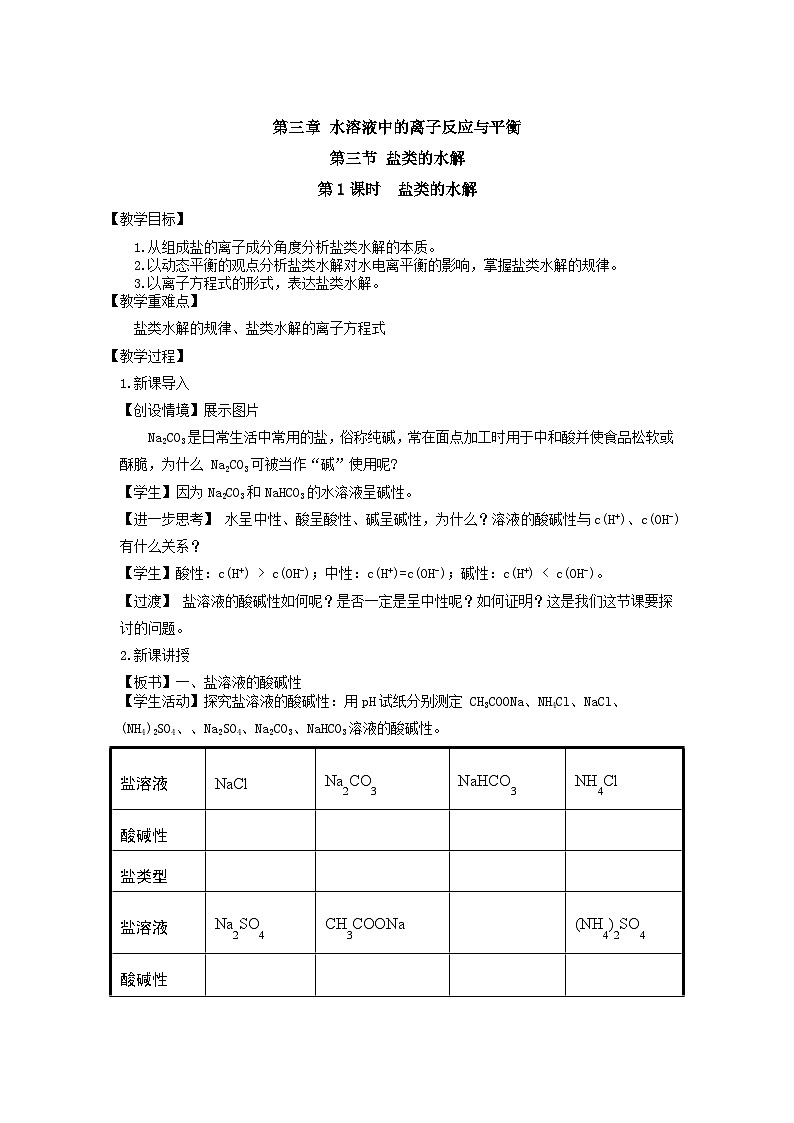
【学生活动】探究盐溶液的酸碱性:用pH试纸分别测定 CH3COONa、NH4Cl、NaCl、
(NH4)2SO4、、Na2SO4、Na2CO3、NaHCO3溶液的酸碱性。
盐溶液
NaCl
Na2CO3
NaHCO3
NH4Cl
酸碱性
盐类型
盐溶液
Na2SO4
CH3COONa
(NH4)2SO4
酸碱性
盐类型
【设疑】盐溶液的酸碱性有规律可循吗?与生成该盐的酸和碱的强弱之间有什么关系?分析上述实验结果,归纳其与盐的类型间的关系,并从电离平衡的角度寻找原因。
盐的类型
强酸强碱盐
强酸弱碱盐
强碱弱酸盐
盐溶液酸碱性
【回答】强碱弱酸盐显碱性,强酸弱碱盐显酸性,强酸强碱盐显中性。
【设疑】溶液呈酸性、碱性还是中性,取决于溶液中c(H+)和c(OH-)的相对大小。那么,是什么原因造成不同类型的盐溶液中c(H+)和c(OH-)相对大小的差异呢?
【学生活动】根据前面的探究结果,对三类不同的盐溶液(NaCl溶液、NH4Cl溶液和CH3COONa溶液)中存在的各种离子,以及离子间的相互作用进行分析,尝试找出不同类型的盐溶液呈现不同酸碱性的原因。
【思考交流】思考以下几个问题:
(1)相关的电离方程式?
(2)盐溶液中存在哪些粒子?
(3)哪些粒子间可能结合(生成弱电解质)?
(4)对水的电离平衡有何影响?
(5)相关的化学方程式?
【展示】
【探究1】 往水中加NaCl形成溶液。
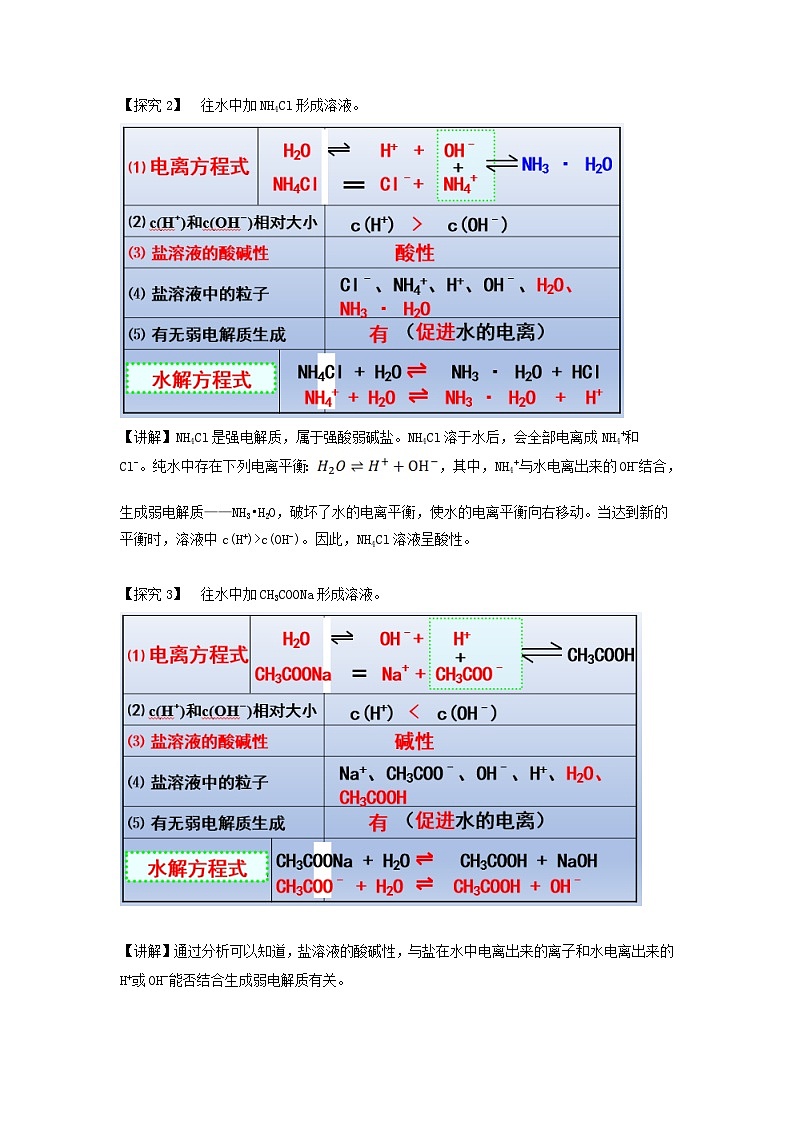
【探究2】 往水中加NH4Cl形成溶液。
【讲解】NH4Cl是强电解质,属于强酸弱碱盐。NH4Cl溶于水后,会全部电离成NH4+和Cl-。纯水中存在下列电离平衡:,其中,NH4+与水电离出来的OH-结合,生成弱电解质——NH3•H2O,破坏了水的电离平衡,使水的电离平衡向右移动。当达到新的平衡时,溶液中c(H+)>c(OH-)。因此,NH4Cl溶液呈酸性。
【探究3】 往水中加CH3COONa形成溶液。
【讲解】通过分析可以知道,盐溶液的酸碱性,与盐在水中电离出来的离子和水电离出来的H+或OH-能否结合生成弱电解质有关。
【讲解】1.定义:像NH4Cl和CH3COONa这样,在水溶液中,盐电离出来的离子与水电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
2、水解的条件:盐易溶,有弱离子。
【展示】3.盐类水解的实质。
【讲解】盐电离出弱酸阴离子,结合水电离出的H+,或盐电离出弱碱阳离子,结合水电离出的OH-,生成弱电解质,破坏了水的电离平衡,促进水的电离,使c(H+)≠c(OH-),因此盐溶液呈现不同的酸碱性。
【设疑】盐类水解的特点是什么?
【总结】(1)盐类的水解促进了水的电离,使溶液呈酸性、碱性或中性;
(2)盐类的水解反应是酸碱中和反应的逆反应:
(3)盐类水解一般是微弱的;一般不用“↑”或“↓”一般不写“=”,而写“ ”
(4)盐类水解是吸热(填“吸热”或“放热”)反应。
(5)水解平衡(动态)
(6)多元弱酸根离子分步水解,以第一步水解为主。
【点拨】Na2CO3的水解分两步进行:第一步:Na2CO3在水溶液中电离出来的CO32-与水电离出来的H+结合生成HCO3-;第二步:生成HCO3-继续与水电离出来的H+结合成弱电解质H2CO3
Na2CO3第二步水解的程度比第一步小得多,平衡时溶液中H2CO3的浓度很小,不会放出CO2气体。
【总结】5、盐类水解的规律:在可溶性盐溶液中:有弱才水解,无弱不水解,越弱越水解,都弱都水解,谁强显谁性,同强显中性。
盐类
实例
能否水解
引起水解的离子
对水的电离
平衡的影响
溶液的
酸碱性
强碱
弱酸盐
强酸
弱碱盐
强酸
强碱盐
【课堂专练】见课件
【学生活动】试写出盐类水解的离子方程式。
【讲解】 2、水解离子方程式的书写步骤
a.先找“弱”离子。
b.一般水解程度小,水解产物少。所以常用“ ” ;不写“ == ”、“↑”、“↓”;
也不把生成物(如NH3·H2O、H2CO3)写成分解产物的形式。
c.多元弱酸盐分步水解,但以第一步水解为主。
d.多元弱碱盐的水解,常写成一步完成。
【学生活动】举例分别写出一元弱酸强碱盐、多元弱酸强碱盐、弱碱强酸盐、多元弱酸酸式酸根的水解离子方程式
【教师活动】讲解离子方程式的书写,补充多元弱酸酸式酸根的水解与电离的区别
【课堂专练】见课件
【课堂小结】
一、探究溶液的酸碱性
二、盐溶液呈现不同酸碱性的原因
三、盐类水解
定义 实质 特征 规律 盐类水解方程式的书写
【板书】
3.3.1盐类的水解
高中化学人教版 (2019)选择性必修1第一节 原电池优质课教案设计: 这是一份高中化学人教版 (2019)选择性必修1第一节 原电池优质课教案设计,共8页。教案主要包含了教学目标,教学重难点,教学过程,设计意图,引入课题,思考交流,课堂专练,规律小结等内容,欢迎下载使用。
人教版 (2019)选择性必修1第一节 原电池教案: 这是一份人教版 (2019)选择性必修1第一节 原电池教案,共22页。
人教版 (2019)选择性必修2第三节 金属晶体与离子晶体教学设计: 这是一份人教版 (2019)选择性必修2第三节 金属晶体与离子晶体教学设计,共3页。教案主要包含了教学目标,教学重难点,教学过程等内容,欢迎下载使用。













