

高中人教版 (2019)第二节 电解池优秀教案设计
展开![]()
第二节 电解池
第1课时 电解原理
【教学目标】
1、从宏观和微观的角度理解电解池中电子的移动、阴阳离子的移动、阴阳两极上的反应及其变化、电流形成的过程和原理。
2、建立对电解过程的系统分析认识的思维模型,理解点解的规律,会判断电解产物,会书写电解的电机反应式和总反应式
【教学重难点】
重点:电解池的工作原理、电极反应式的书写
难点:电解池的工作原理
【教学过程】
1.新课导入:观看视频
1799年,当意大利人发明了最原始的电池---伏打电池之后,许多科学家对电产生了浓厚的兴趣,电给世界带来了太多的不可思议,好奇心驱使着人们去进行各种尝试,想看看它还能否出现什么奇特的现象。1807年,当英国化学家载维将铂电极插入熔融的氢氧化钾并接通直流电源时,奇迹终于产生了,在阴极附近产生一种银白色的金属,随即形成紫色的火焰。这就是发现钾元素的主要过程,当时在社会上引起了轰动。他随后用电解法又相继发现了钠、钙、锶、钡、镁、硼、硅等元素,戴维成为发现化学元素最多的。这其中的奥妙是什么呢?电解时,物质的变化是如何发生的呢?
2.新课讲授
【演示实验】教材4-2实验。
(1)将两要碳棒分别插进U型管内的CuCl2溶液中,观察现象
【学生】碳棒表面无明显现象
(2)将两根碳棒用导线相连后,浸入U型管内的CuCl2溶液中,观察现象
【学生】碳棒表面无明显现象
(3)将两根碳棒分别跟直流电源的正、负极相连接,浸入U型管内的CuCl2溶液中,接通电源,观察现象
【学生】阴极:碳棒上逐渐覆盖了一层红色物质。
阳极:生成有刺激性气味、能使湿润的碘化钾淀粉试纸变蓝的气体。
【师】请大家根据实验现象和氯化铜溶液的组成成分以及原有知识分析推断两极生成物的名称。
【学生】两极产物 阴极——铜 阳极——氯气
【得到结论】在直流电源的作用下,CuCl2溶液导电的同时,发生了化学变化,生成了Cu和Cl2。
【设计意图】培养学生分析、归纳能力,激发学生的学习兴趣
【知识巩固】
基本概念
(1) 使电流通过电解质溶液而在阴、阳两极上引起氧化还原反应的过程叫电解。
(2)把电能转变为化学能的装置叫做电解池或电解槽。
(3)当离子到达电极时,失去或获得电子,发生氧化还原反应的过程
【学生活动】分析电解池的构成:
①外接电源;②两个电极:(电极材料可以相同也可以不同);③电解质溶液;④形成一个闭合回路。
【课堂专练】见课件
【学生活动】从微观角度分析CuCl2溶液发生的变化,分析探究现象产生的原因,学会从现象看到本质,提升认知水平。
【思考讨论】
1.CuCl2溶液中存在哪些离子?
2.通电时离子如何移动?
3.从得失电子角度分析阴阳极分别发生了什么反应?
【汇报总结】从得失电子角度分析通电时离子发生的变化。
阴极:Cu2++2e-===Cu(还原反应)
阳极:2Cl--2e-===Cl2↑(氧化反应)
总反应:Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
【强调】电解池有两极:阴极和阳极。阴极发生还原反应,阳极发生氧化反应。
【分析】电子流动方向:外电路电子从电源的负极沿导线流入电解池的阴极,再从电解池的阴极流岀,并沿导线流回电源正极,内电路阳离向阴极运动,阴离子向阳极运动,从而形成闭合回路。
【设计意图】初步掌握电解原理,培养学生分析问题和归纳的能力。
【分析】电解池的阴极、阳极的判断方法
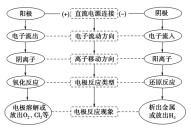
【课堂专练】见课件
【设疑】在氯化铜溶液中还有哪些离子,在通电时如何移动,是否也参与了电极反应?
【生】氯化铜在水里能电离成自由移动的Cu2+和Cl-,水能微电离出H+和OH-,通电后,这些自由移动的离子,在电场的作用下,改作定向移动,带负电的离子向阳极移动,带正电的离子向阴极移动,
【设疑】 从上已知CuCl2溶液中存在的离子有:Cu2+、Cl-、OH-、H+为什么电解时,只有Cu2+和Cl-放电?
【生】氧化性强的阳离子优先在阴极放电,还原性强的阴离子优先在阳极放电。
【强调】离子的放电顺序
由于各种离子得失电子的能力不同,因此,电解时离子放电难易也不同。
阳离子:Ag+>Hg2+>Cu2+>Fe2+>Zn2+>H+>Al3+>Na+>K+
阴离子:S2->I->Br->Cl->OH->含氧酸根
【师】电解电解质溶液时,在阴阳两极上首先发生放电反应的离子分别是溶液里最容易放电的阳离子和最容易放电的阴离子。
【师】我们还要注意的是要先看电极材料,是惰性电极还是活性电极,若阳极材料为活性电极(Fe、Cu)等金属,则阳极反应为电极材料失去电子,变成离子进入溶液;若为惰性电极材料,则根据阳离子的放电顺序,依据阳氧阴还的规律来书写电极反应式。
【师】电极产物的判断
(1)阳极放电顺序:活泼阳极(金属)>无氧酸根离子>OH―>含氧酸根离子>F―
(2)阴极放电:溶液中的阳离子放电
【思维建模】电极反应式的书写:列物质,标得失;选离子,配电荷;配个数,巧用水;两式加,验总式。
首先要分清电极,并分析电极材料和电解质溶液中的阴阳离子,确定放电顺序,牢记三个守恒。电极反应必须写离子放电,总反应中弱电解质写化学式,且总反应中一定要注明条件。
注意:
1.若H+、OH-由水电离,则总反应中需将其变成H2O
2.所有总反应的条件均为电解
【设计意图】通过教师引导及典型例题,进一步掌握电解原理。
【思考交流】利用准备的实验仪器和试剂,亲自实践,记录实验现象,并写出自己小组所电解溶液的电极反应式和总反应式,同时思考电解后溶液中的PH会如何变化?若要复原,可以加入什么物质?
【归纳小结】惰性电极电解电解质溶液的规律
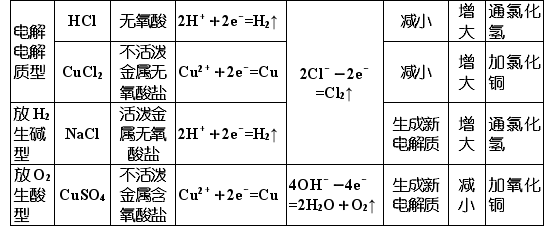
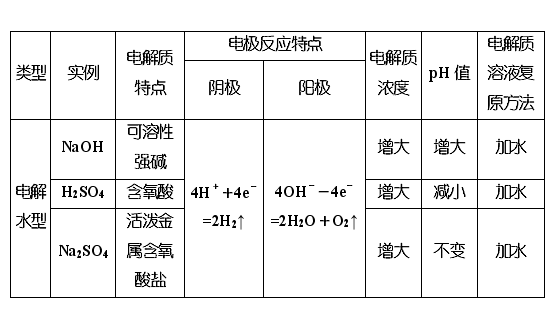 注意:
注意:
惰性电极电解电解质溶液后要恢复原电解质溶液的浓度,需加适量的某物质时,遵循“少什么加什么,少多少加多少”的原则,所加物质可以是阴极与阳极产物的化合物。
【课堂专练】见课件
【课堂小结】
【师】通过本节课的学习,你有哪些收获?
【板书设计】
人教版 (2019)选择性必修1第二节 电解池优秀教学设计及反思: 这是一份人教版 (2019)选择性必修1第二节 电解池优秀教学设计及反思,共7页。教案主要包含了教学目标,教学重难点,教学过程,思考交流,课堂专练,拓展提升,学生活动,归纳对比等内容,欢迎下载使用。
选择性必修1第四章 化学反应与电能第一节 原电池一等奖教案及反思: 这是一份选择性必修1第四章 化学反应与电能第一节 原电池一等奖教案及反思,共7页。教案主要包含了教学目标,教学重难点,教学过程,知识回顾1,学生活动,知识回顾2,教师活动,问题讨论等内容,欢迎下载使用。
2021学年第二节 电解池教学设计: 这是一份2021学年第二节 电解池教学设计,共3页。教案主要包含了导入新课,新课讲授等内容,欢迎下载使用。













