
所属成套资源:新人教版化学选择性必修一针对练习+单元测试(含解析)
人教版 (2019)选择性必修1第二节 电解池精品练习题
展开
这是一份人教版 (2019)选择性必修1第二节 电解池精品练习题,共15页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
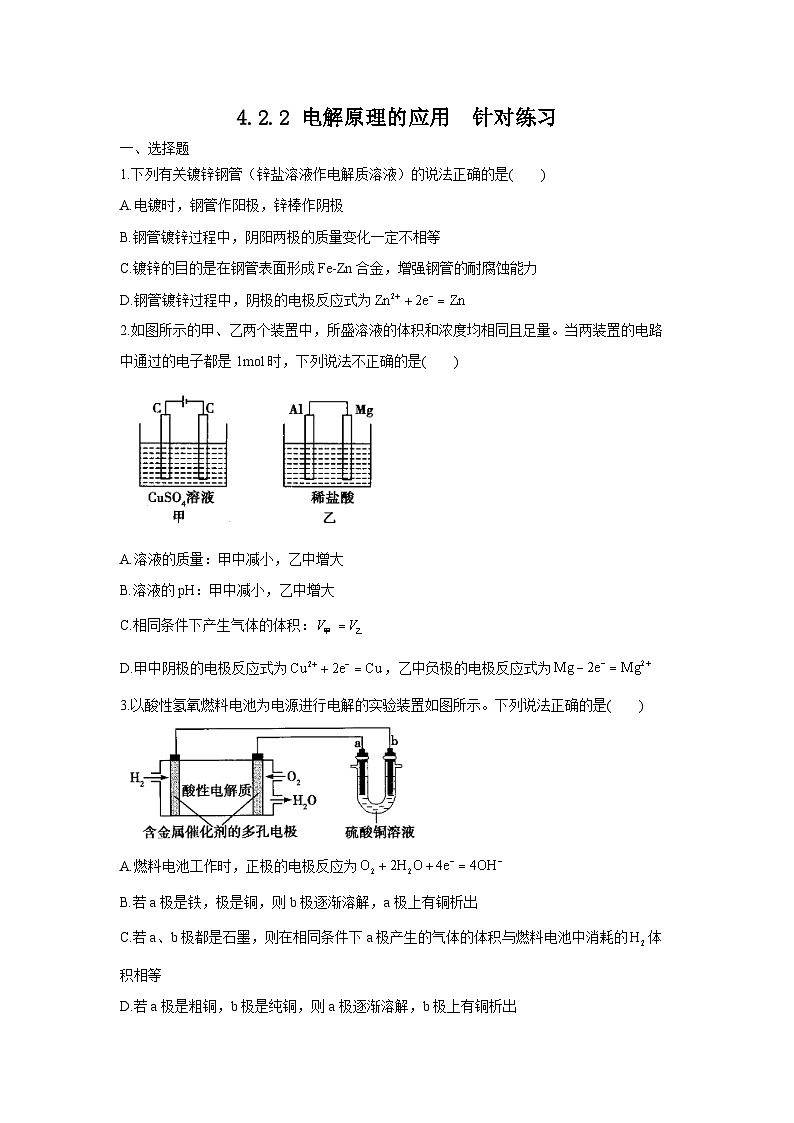
1.下列有关镀锌钢管(锌盐溶液作电解质溶液)的说法正确的是( )
A.电镀时,钢管作阳极,锌棒作阴极
B.钢管镀锌过程中,阴阳两极的质量变化一定不相等
C.镀锌的目的是在钢管表面形成Fe-Zn合金,增强钢管的耐腐蚀能力
D.钢管镀锌过程中,阴极的电极反应式为
2.如图所示的甲、乙两个装置中,所盛溶液的体积和浓度均相同且足量。当两装置的电路中通过的电子都是1ml时,下列说法不正确的是( )
A.溶液的质量:甲中减小,乙中增大
B.溶液的pH:甲中减小,乙中增大
C.相同条件下产生气体的体积:
D.甲中阴极的电极反应式为,乙中负极的电极反应式为
3.以酸性氢氧燃料电池为电源进行电解的实验装置如图所示。下列说法正确的是( )
A.燃料电池工作时,正极的电极反应为
B.若a极是铁,极是铜,则b极逐渐溶解,a极上有铜析出
C.若a、b极都是石墨,则在相同条件下a极产生的气体的体积与燃料电池中消耗的体积相等
D.若a极是粗铜,b极是纯铜,则a极逐渐溶解,b极上有铜析出
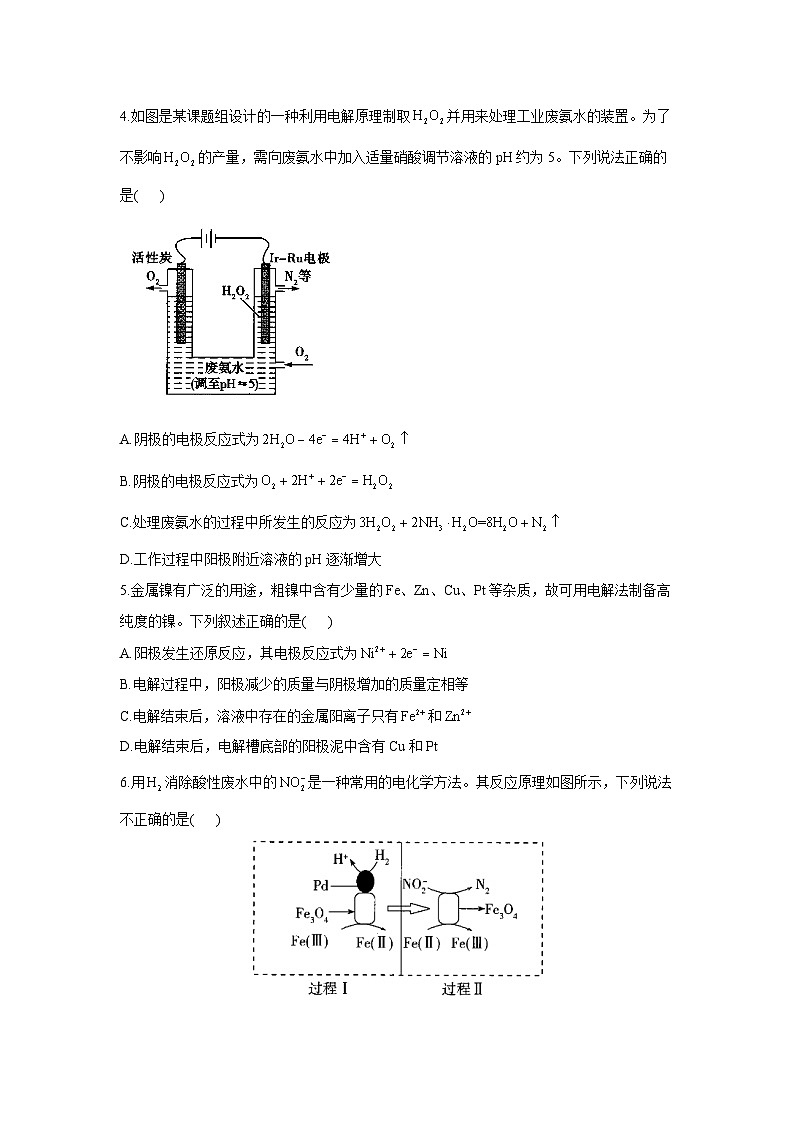
4.如图是某课题组设计的一种利用电解原理制取并用来处理工业废氨水的装置。为了不影响的产量,需向废氨水中加入适量硝酸调节溶液的pH约为5。下列说法正确的是( )
A.阴极的电极反应式为
B.阴极的电极反应式为
C.处理废氨水的过程中所发生的反应为
D.工作过程中阳极附近溶液的pH逐渐增大
5.金属镍有广泛的用途,粗镍中含有少量的Fe、Zn、Cu、Pt等杂质,故可用电解法制备高纯度的镍。下列叙述正确的是( )
A.阳极发生还原反应,其电极反应式为
B.电解过程中,阳极减少的质量与阴极增加的质量定相等
C.电解结束后,溶液中存在的金属阳离子只有和
D.电解结束后,电解槽底部的阳极泥中含有Cu和Pt
6.用消除酸性废水中的是一种常用的电化学方法。其反应原理如图所示,下列说法不正确的是( )
A.在该反应中作催化剂
B.Pd上发生的电极反应为
C.总反应为
D.Fe(Ⅱ)与Fe(Ⅲ)之间的相互转化起到了传递电子的作用
7.(双选)用铁和石墨作电极电解酸性废水,可将废水中的以(不溶于水)的形式除去,其装置如图所示。
下列说法中正确的是( )
A.若X、Y电极材料连接反了,则仍可将废水中的除去
B.X电极为石墨,该电极上发生氧化反应
C.电解过程中Y电极周围溶液的pH变大
D.电解时废水中会发生反应:
8.次氯酸的相对分子质量较小,容易扩散到细菌、病毒表面并进入菌体、病毒内部,使菌体、病毒的蛋白质、遗传物质等被氧化而导致细菌、病毒死亡。为了抑制新型冠状病毒肺炎的蔓延,确保安全复工复产,需要在电梯间、办公场所等地方使用含氯消毒剂进行消毒。氯碱工业是制备含氯消毒剂的基础。如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )
A.装置中出口①处的物质是氯气,出口②处的物质是氢气
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为
D.该装置是将电能转化为化学能的装置
9.高铁酸钠()是一种新型绿色水处理剂。工业上可用电解浓NaOH溶液制备,其工作原理如图所示,两端隔室中离子不能进入中间隔室。下列说法错误的是( )
A.阳极反应为
B.甲溶液可循环利用
C.离子交换膜a是阴离子交换膜
D.当电路中通过2 ml电子的电量时,会有1 ml生成
10.是大气污染物,利用电化学法处理的装置如图所示(已知电极M、N均为石墨烯电极,阳膜只允许通过)。下列说法错误的是( )
A.N极的电极反应为 B.电极M的电势比电极N的低
C.一段时间后右室稀硫酸的浓度变大 D.反应过程中,氢离子从左向右移动
11. 利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是( )
A.通电后,向阳极移动
B.银片与电源负极相连
C.该电解池阴极的电极反应式为
D.当电镀一段时间后,将电源反接,铜牌可恢复如初
12.氯碱工业的一种节能新工艺是将电解池与燃料电池相组合,相关物料的传输与转化关系如图所示(电极未标出)。下列说法正确的是( )
A.电解池阴极的电极反应式为
B.通入空气的电极为负极
C.电解池中产生时,理论上燃料电池中消耗
D.的大小关系为
13. 下列化工生产原理错误的是( )
①可以用电解熔融氯化钠的方法来制取金属钠
②将钠加入氯化镁饱和溶液中制取镁
③用电解法冶炼铝时,原料可选用氯化铝
④湿法炼铜是用锌和硫酸铜溶液反应置换出铜
A.仅②③B.仅①③C.仅①②③D.仅②③④
14.下图中能验证饱和食盐水(含酚酞)电解产物的装置是(下列各图中的电极均为惰性电极)( )
A.B.
C.D.
15. 电解熔融氯化钠和氯化钙的混合物可制备金属钠,阳极A为石墨,阴极为铁环K,两极用离子交换膜D隔开;氯气从阳极上方的抽气罩H抽出,液态金属钠经环形槽R、铁管F流入收集器G,装置示意图如下所示。下列叙述错误的是( )
A.氯化钙的作用可能是助熔剂,降低氯化钠的熔点,节省能源,减少钠蒸气的挥发
B.由装置示意图可知,金属钠的密度小于熔融混合盐的密度,电解得到的钠在上层
C.D为阳离子交换膜,防止生成的氯气和钠重新反应生成氯化钠
D.电解时阴极的电极反应为,阴极上可能有少量的钙单质生成
二、非选择题
16. 现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(常温下约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
(1)试从上图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是A接______________,B接_____________。
(2)铁棒接直流电源的_____________极;碳棒上发生的电极反应为__________________。
(3)能说明氯气具有氧化性的实验现象是__________________。
(4)假定装入的饱和食盐水为50 mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6 mL(已折算成标准状况)时,常温下溶液的pH为________________。
(5)工业上采用离子交换膜法电解饱和食盐水,如下图所示,图中的离子交换膜是__________(填“阳离子”或“阴离子”)交换膜,溶液B是__________________。
17. 电化学在化学工业中有着广泛的应用。
(1)根据图示电化学装置,回答下列问题:
①甲池中通入乙烷一极的电极反应式为____________________。
②乙池中,若X、Y都是石墨电极,A溶液是溶液,实验开始时,同时在两极附近溶液中各滴入几滴紫色石蕊溶液,X极的电极反应式为____________________;一段时间后,在Y极附近观察到的现象是____________________。
③乙池中,若X、Y都是石墨电极,A溶液是足量溶液,体积为0.2L,则Y极的电极反应式为____________________;电解一段时间后,甲池消耗112mL(标准状况下),则乙池溶液的pH为____________________(忽略溶液体积的变化)。
(2)若要用(1)中装置在铁质钥匙表面镀一层金属铜,用溶液作电解液,则乙池中:
①X极的材料是____________________,电极反应式为____________________。
②Y极的材料是____________________,电极反应式为____________________。
18. 已知铅酸蓄电池的工作原理为。现用如图装置进行电解实验,测得当铅酸蓄电池中转移0.4ml电子时,铁电极的质量减少11.2g。请回答下列问题:
(1)A是铅酸蓄电池的__________________极,铅酸蓄电池正极的电极反应式为__________________,放电过程中电解液的密度(忽略电解液的体积变化)__________________(填“减小”“增大”或“不变”)。
(2)Ag电极的电极反应式是__________________,该电极的电极产物有__________________g。
(3)Cu电极的电极反应式是__________________,溶液的浓度__________________(填“减小”“增大”或“不变”)。
(4)如图表示电解进行过程中某个物理量随时间的变化曲线,其中曲线Ⅰ表示左侧U形管中的变化,曲线Ⅱ表示右侧U形管中的变化,则表示__________________(填序号)。
a.U形管中产生的气体的体积 b.U形管中阳极质量的减少量 c.U形管中阴极质量的增加量
答案以及解析
1.答案:D
解析:电镀时镀层金属作阳极,待镀金属作阴极,故钢管镀锌时,锌棒作阳极,钢管作阴极,A项错误;钢管镀锌过程中,阳极的电极反应式为,阴极的电极反应式为,电镀过程中阴阳极转移的电子数相等,故阴阳两极的质量变化一定相等,B项错误、D项正确;钢管镀锌的目的是美观、保护钢管等,而不是为了在钢管表面形成Fe- Zn合金,C项错误。
2.答案:C
解析:甲是电解池,其总反应为,乙是原电池,其总反应为,故甲中溶液质量减小,乙中溶液质量增大,A项正确。甲中生成,溶液的pH减小,乙中消耗HCl,溶液的pH增大,B项正确。当两装置的电路中通过的电子都是1ml 时,甲中产生0.25ml,乙中产生0.5ml,故在相同条件下,甲、乙两装置中产生气体的体积比为1:2,C项错误。甲中阴极为放电,电极反应式,乙中负极为Mg放电,电极反应式为,D项正确。
3.答案:D
解析:酸性环境中,氢氧燃料电池正极的电极反应为,A项错误。a极为阳极,b极为阴极,若a极是铁,b极是铜,则a极的电极反应:,B项错误。若a、b极都是石墨,则根据得失电子守恒知,相同条件下,a极上产生的氧气的体积和燃料电池中消耗的氧气的体积相等,是消耗的氢气体积的一半,C项错误。a极为阳极,b极为阴极,若a极是粗铜,b极是纯铜,则a极逐渐溶解,b极上有铜析出,D项正确。
4.答案:C
解析:根据题给装置图可知,阳极的电极反应式为,阴极的电极反应式为,故A、B项错误。根据题图可知可将氧化为,C项正确。根据电极反应式可知,工作过程中阳极上生成氢离子,所以阳极附近溶液的pH逐渐减小,D项错误。
5.答案:D
解析:电解时阳极应发生氧化反应,A项错误;根据金属的还原性和金属阳离子的氧化性的强弱顺序可知,阳极的电极反应为,,,Cu、Pt在该条件下不失电子,会变为阳极泥,阴极的电极反应为,、在该条件下不得电子,电解结束溶液中还含有,C项错误,D项正确;比较两电极反应,因Zn、Fe、Ni的相对原子质量不等,当两极通过相同的电量时,阳极减少的质量与阴极增加的质量不一定相等,B项错误。
6.答案:C
解析:在过程I中为反应物,在过程Ⅱ中为生成物,所以是整个反应的催化剂,A正确;Pd电极上氢气失电子生成,电极反应为,B正确;电解质溶液呈酸性,则不能生成,负极上生成氢离子,正极上和氢离子反应生成氮气和水,总反应为,C错误;+3价Fe转化为+2价Fe得到电子、+2价Fe转化为+3价Fe失去电子,所以Fe(Ⅱ)与Fe(Ⅲ)之间的相互转化起到了传递电子的作用,D正确。
7.答案:CD
解析:根据题意分析,X电极材料为铁,Y电极材料为石墨,若X、Y电极材料连接反了,铁就不能失电子变为离子,也就不能生成,A项错误;Y电极材料为石墨,该电极发生还原反应,B项错误;电解过程中Y电极上发生的反应为,氢离子浓度减小,溶液的pH变大,C项正确;铁在阳极失电子变为,通入的氧气把氧化为,与反应生成,D项正确。
8.答案:C
解析:由题图可知①处的物质为电解池阳极产生的氯气,②处的物质为电解池阴极产生的氢气,A正确;题图中的离子交换膜只能让阳离子通过,不能让阴离子通过,能防止氯气与氢氧化钠反应,且在阴极区得到浓度较高的氢氧化钠溶液,B正确;电解饱和食盐水的离子方程电解式为,C错误;该装置是将电能转化为化学能的装置,D正确。
9.答案:C
解析:A项,阳极发生氧化反应,电极反应为,正确;B项,阴极发生还原反应,水电离出的氢离子放电生成氢气,甲溶液为浓的氢氧化钠溶液,可循环利用,正确;C项,电解池中阳离子向阴极移动,通过离子交换膜a的是,故离子交换膜a为阳离子交换膜,错误;D项,阴极发生还原反应,电极反应为,当电路中通过2 ml电子的电量时,会有1 ml 生成,正确。
10.答案:C
解析:N为正极,发生还原反应,电极反应为,A正确;M为负极,N为正极,则电极M的电势比电极N的低,B正确;N为正极,电极反应为,消耗,生成,则右室稀硫酸的浓度减小,C错误;原电池工作时,阳离子向正极移动,即氢离子从左向右移动,D正确。
11. 答案:C
解析:铜牌上镀银,银片为阳极,向阴极移动,阴极的电极反应为。由于实验中镀层不可能非常均匀致密,所以将电源反接,阳极上Cu、Ag均会溶解,铜牌不可能恢复如初。
12.答案:A
解析:题给电解池阴极的电极反应式为,阳极的电极反应式为,A项正确。题给燃料电池为氢氧燃料电池,通入空气的电极为正极,B项错误。由整个电路中得失电子守恒可知,电解池中产生,理论上转移,则燃料电池中消耗,C项错误。题给燃料电池负极的电极反应式为,正极的电极反应式为,所以的大小关系为,D项错误。
13. 答案:D
解析:①钠是活泼金属,可以用电解熔融氯化钠的方法来制取金属钠,正确;②将钠加入氯化镁溶液中,钠先和水反应生成NaOH,氯化镁会和NaOH发生复分解反应,所以得不到镁单质,应采用电解熔融氯化镁的方法冶炼镁,错误;③氯化铝是分子晶体,熔融状态下氯化铝不导电,故不能用电解氯化铝的方法得到铝,错误;④湿法炼铜是用铁和硫酸铜溶液反应置换出铜,错误。综上所述,D项符合题意。
14.答案:D
解析:电解饱和食盐水时,阳极产物是,阴极产物是、NaOH,根据图中的电子流向先确定装置中电源的正、负极,从而确定电解池的阴、阳极,然后判断电极产物以及检验方法,D选项符合题意。
15. 答案:C
解析:本题以电解氯化钠工业为载体,考查电解原理中的一些问题。工业上加入的氯化钙是助熔剂,降低物质熔点,此知识来源于电解铝工业中的助熔剂六氟合铝酸钠,A正确;由装置示意图可知,金属钠在上部收集,所以钠的密度小于混合盐的密度,B正确;由图可知,通过离子交换膜D迁移至阳极A放电产生,D为阴离子交换膜,C错误;阴极的电极反应式书写正确,副反应也合理,D正确。故选C。
16. 答案:(1)G→F→I;D→E→C
(2)负;
(3)淀粉–KI溶液变蓝
(4)12
(5)阳离子;NaOH溶液
解析:(1)产生的氢气的体积用排水量气法测量,常温下的体积约6 mL,所以选I不选H,导管是短进长出,所以A接G;用装有淀粉–KI溶液的洗气瓶检验氯气时,导管要长进短出,所以B接D,氯气要进行尾气处理,则E接C。
(2)题中电解饱和食盐水实验中铁棒应为阴极,连接电源负极,碳棒为阳极,连接直流电源的正极,碳棒上发生的电极反应为。
(3)氯气具有氧化性,能氧化碘离子生成碘单质,碘单质遇到淀粉变蓝色,使淀粉–KI溶液变蓝说明氯气具有氧化性。
(4)因电解饱和食盐水的方程式为,当产生的的体积为5.6 mL(折算成标准状况)时,其物质的量为,生成氢氧化钠的物质的量为,所以溶液中NaOH的物质的量浓度为0.01 ml/L,则常温下氢离子的浓度为,溶液的pH=12。
(5)氢气在阴极上生成,则b为阴极,a为阳极,阳离子向阴极移动,则离子交换膜允许阳离子通过,所以题图中的离子交换膜为阳离子交换膜;溶液B是NaOH溶液。
17. 答案:(1)①
② 电极表面产生气泡,电极附近溶液变蓝
③ 1
(2)①铜
②铁质钥匙
解析: (1)①甲池中乙烷通入左侧电极发生氧化反应,则左侧Pt电极为负极,电解质溶液为KOH溶液,故负极的电极反应式为。
②乙池中,若X、Y都是石墨电极,A溶液是溶液,则X是阳极,发生氧化反应,电极反应式为,Y是阴极,电极反应式为,有和生成,则Y极附近观察到的现象是电极表面产生气泡,附近溶液变蓝。
③乙池中,若X、Y都是石墨电极,A溶液是足量溶液,Y极是阴极,电极反应式为,X极是阳极,电极反应式为。甲池中右侧Pt电极发生的电极反应为,消耗标准状况下112mL(即0.005ml)时电路中转移电子的物质的量为0.005ml×4=0.02ml。根据得失电子守恒可知,电路中转移0.02ml电子时,X极附近生成0.02 ml,则乙池溶液中,溶液pH=1。
(2)在铁质钥匙表面镀一种金属铜,则X极是阳极,要用镀层金属铜作阳极,电极反应式,Y极是阴极,要用镀件——铁质钥匙作阴极,电极反应式为。
18. 答案:(1)负 减小
(2) 0.4
(3) 不变
(4)b
解析:(1)当铅酸蓄电池中转移0.4ml电子时,铁电极的质量减少11.2g,说明铁电极作阳极,银电极作阴极,阴极连接原电池的负极,所以A是铅酸蓄电池的负极,B是铅酸蓄电池的正极,正极上二氧化铅得电子发生还原反应,电极反应式为。由于放电过程中消耗,故电解液的密度减小。
(2)银电极作阴极,电解稀硫酸时,阴极上氢离子放电生成氢气,电极反应式为,根据得失电子守恒可知,生成氢气的质量为。
(3)铜电极作阳极,阳极上铜失电子发生氧化反应,电极反应式为,阴极上铜离子得电子发生还原反应析出铜,电解质溶液的浓度不变。
(4)右侧U形管中不产生气体,左侧U形管中产生气体,故a错误;当转移电子相等时,溶解的阳极金属的物质的量相等,但由于铜的摩尔质量大于铁的摩尔质量,所以右侧U形管中阳极减少的质量大于左侧U形管中阳极减少的质量,故b正确;电解初始阶段左侧U形管中阴极上没有析出固体,其质量不变,右侧U形管中阴极上有铜析出,其质量增大,故c错误。
相关试卷
这是一份选择性必修1第二节 电解池练习题,共6页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
这是一份化学第二节 电解池课后作业题,共15页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第二节 电解池优秀达标测试,共16页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。










