







高中化学人教版 (2019)选择性必修1第一节 反应热完美版ppt课件
展开1、认识化学能与热能的相互转化,能分析化学变化和伴随反应发生的能量转化与物质微观结构之间的关系。 2、能解释化学反应中能量变化的本质,能定量分析化学变化的热效应,知道恒温恒压条件下化学反应的反应热可以用焓变表示; 3、通过中和反应反应热测定实验,培养实验探究、勤于实践、善于合作的学科素养
在化学反应过程中,物质变化的同时,一定伴随着能量的变化。
化学反应过程中所释放或吸收的能量,都可以用热量(或转换成相应的热量)来表述,叫做反应热。
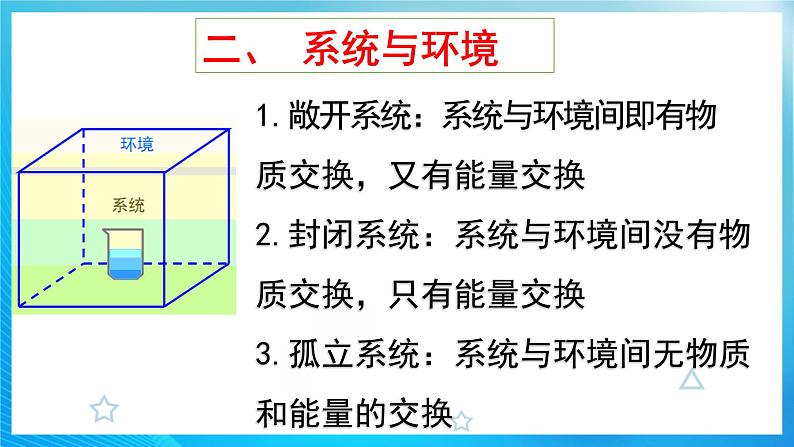
1.敞开系统:系统与环境间即有物 质交换,又有能量交换2.封闭系统:系统与环境间没有物质交换,只有能量交换3.孤立系统:系统与环境间无物质和能量的交换
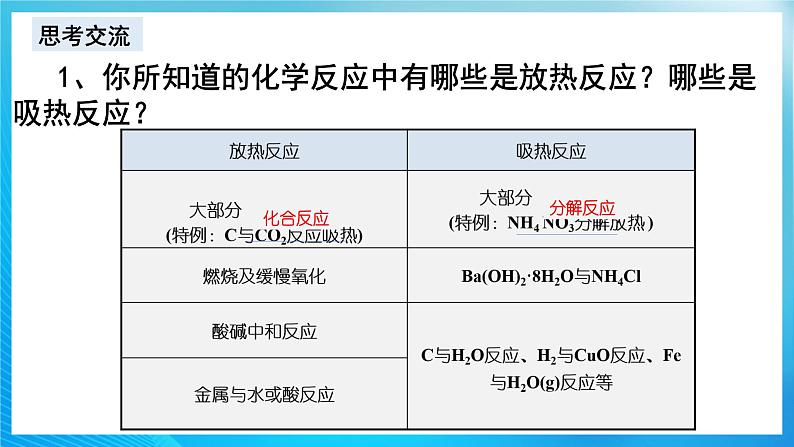
1、你所知道的化学反应中有哪些是放热反应?哪些是吸热反应?
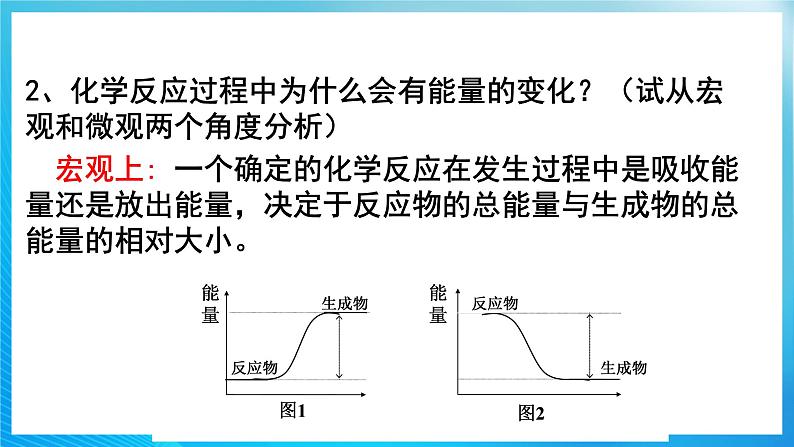
2、化学反应过程中为什么会有能量的变化?(试从宏观和微观两个角度分析)
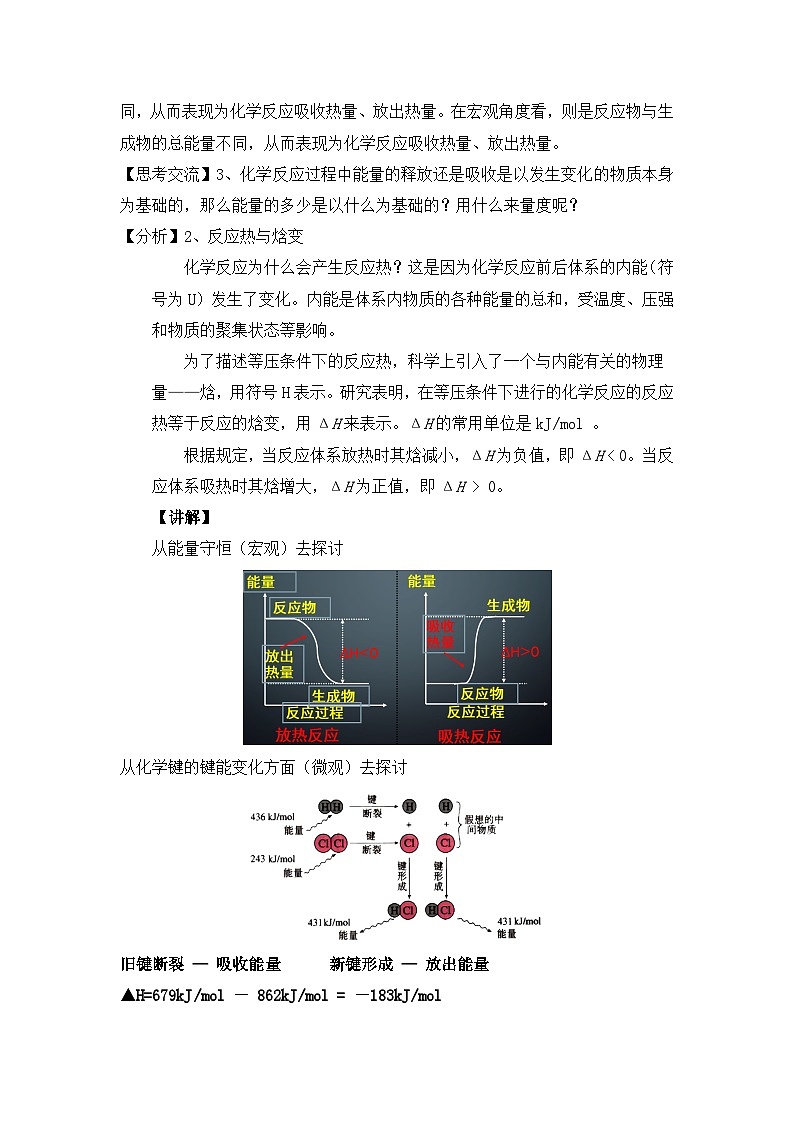
宏观上: 一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。
旧键断裂需要________能量,新键形成会________能量。
键能:破坏或形成1ml化学键所吸收或释放的能量。
3、化学反应过程中能量的释放还是吸收是以发生变化的物质本身为基础的,那么能量的多少是以什么为基础的?用什么来量度呢?
2、焓变:生成物与反应物的焓值差(Δ H )。 恒压时,“焓变 = 反应热” 。
kJ/ml 或 kJ • ml–1
1、 焓 :是与内能有关的物理量,用符号H表示。
任何一种物质都具有一定的能量,这种能量称为内能。
5、反应热与焓变的关系
焓增加—吸热反应(体系能量升高) —表示为“ + ”或 ΔH>0
焓减少—放热反应(体系能量降低) —表示为“- ”或 ΔH<0
恒压下的焓变 = 反应热
☆从能量守恒(宏观)去探讨:
∆H=生成物的总能量-反应物的总能量
☆从化学键的键能变化方面(微观)去探讨:
旧键断裂 — 吸收能量
新键形成 — 放出能量
▲H=679kJ/ml - 862kJ/ml = -183kJ/ml
∆H= 反应物的总键能-生成物的总键能
注意: 键能越大,能量越低,物质越稳定。
1、判断物质的稳定性
C(石墨 s ) = C(金刚石 s ) ΔH = +1.9kJ/ml
石墨、金刚石哪个更稳定?
2、1ml C与 1ml H2O(g) 反应生成 lml CO(g) 和1ml H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H = kJ/ml。
3、拆开 1ml H-H键、1ml N-H键、1ml N≡N键分别需要的能量是436kJ、391kJ、946kJ, 则1ml N2生成NH3的反应热为 , 则1ml H2生成NH3的反应热为 。
在稀溶液中,酸和碱发生中和反应而生成1ml水时放出的热量。 研究条件:稀溶液 反应物:强酸与强碱 生成物及其物质的量:1ml 放出的热量:57.3kJ/ml
注:强酸与弱碱反应,强碱与弱酸、弱酸和弱碱反应生成1mlH2O放出的热小于57.3KJ/ml
1.反应原理:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/ml在稀溶液中,强酸跟强碱发生中和反应生成1 ml H2O,这时的反应热叫做中和热。2.测定方法本实验通过测定酸碱中和反应前后溶液温度的变化,计算反应过程中所放出的热量,并由此求得中和热。
3.实验原理实验时,先测出盐酸和氢氧化钠溶液的起始温度,求其平均温度t1,两溶液混合充分反应后,读取混合液温度t2。为了使计算简便,可以近似地认为:(1)0.5 ml/L盐酸和0.55 ml/L氢氧化钠的密度都是1 g/cm3,则:50mL盐酸质量m1=50 g,50mL氢氧化钠质量m2=50 g。近似认为混合溶液的比热容c=4.18 J/(g· °C),所以中和反应放出的热量是:Q=(m1+m2)×c×(t2-t1)=0.418(t2-t1)kJ。(2)又因50 mL 0.5 ml/L盐酸中含有0.025 ml的H+,所以跟0.025 ml的OH-发生中和反应,生成0.025 ml的水,放出热量为Q(ΔH=-Q),所以:
50mL 0.5ml/L 的HCl与50mL 0.5ml/L 的NaOH,相混合,混合前两溶液的温度均为15 ℃,反应后溶液温度变为18.4 ℃。试通过计算写出该反应的热化学反应方程式。(溶液密度均为1g/mL,水的比热容为4.18J/g ·℃,溶液用符号”aq”表示)
HCl(aq) + NaOH(aq) = NaCl(aq) + H2O(l) △H = KJ/ml
0.50 ml/L的盐酸和0.55 ml/L和的氢氧化钠溶液
5、实验仪器:简易量热计
(1).组装量热器在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,如上图所示。
用一个量筒最取50 mL 0.50 ml/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。
用另一个量筒量取50 mL 0.55 ml/LNaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。
把量筒中的NaOH溶液迅速倒入量热计(注意不要洒到外面)。立即盖上盖板,用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。
(5) 重复以上实验两次
你所测得的数据是否为57.3kJ/ml, 若不是,分析产生误差的原因
1.量取溶液的体积有误差
2.药品的选用不当引起的误差
3.实验过程中有液体洒在外面。
4.混合酸、碱溶液时,动作缓慢, 导致实验误差
5.隔热操作不到位,致使实验过程 中热量损失而导致误差
6.测了酸后的温度计未用水清洗而便 立即去测碱的温度,致使热量损失 而引起误差。
1、大、小烧杯放置时,为何要使两杯口相平?填碎纸条的作用是什么?
2、酸、碱混合时,为何要把量筒中的NaOH溶液一次倒入小烧杯而不能缓缓倒入?
3、实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?为什么?
不能。因为铜丝易导热,使热量损失较大
4、有人建议用50mL0.55ml/LNaOH进行上述实验,测得的中和热数值会更加准确。为什么?
可以保证盐酸完全反应。使测得的热量更加准确。
5、判断下列实验操作对中和热测定的数值有如何影响?填变大变小或者不变。
①大烧杯上没有盖硬纸板②用相同浓度和体积的氨水代替NaOH溶液进行实验 ③用相同浓度和体积的醋酸代替稀盐酸溶液 进行实验 ④实验中改用60 mL 0.50 ml/L盐酸跟50 mL 0.55 ml/L NaOH溶液进行实验
5、若将1L1ml/LNaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应时的热效应分别为△H1、△H2 、△H3 ;则三者的大小关系为 。
△H1> △H3 > △H2
高中化学人教版 (2019)选择性必修1第一节 反应热课前预习课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热课前预习课件ppt,共35页。PPT课件主要包含了学习目标,课前导入,知识点一,反应热及其测定,体系与环境之间,1定义,2分类,敞开体系系统,封闭体系系统,孤立体系系统等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 反应热优秀ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热优秀ppt课件,文件包含111反应热焓变练习解析版docx、111反应热焓变练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
化学选择性必修1第一节 反应热优质ppt课件: 这是一份化学选择性必修1第一节 反应热优质ppt课件,文件包含人教版高中化学选择性必修一111《反应热焓变》课件pptx、人教版高中化学选择性必修一111《反应热焓变》学案docx等2份课件配套教学资源,其中PPT共25页, 欢迎下载使用。













