










所属成套资源:人教版化学选择性必修1PPT课件+教案+同步练习整套
化学人教版 (2019)第四节 沉淀溶解平衡一等奖ppt课件
展开
这是一份化学人教版 (2019)第四节 沉淀溶解平衡一等奖ppt课件,文件包含新人教版化学选择性必修一341难溶电解质的溶解平衡课件pptx、新人教版化学选择性必修一341难溶电解质的溶解平衡针对练习含解析docx、新人教版化学选择性必修一341难溶电解质的沉淀溶解平衡教案doc等3份课件配套教学资源,其中PPT共27页, 欢迎下载使用。
第三章 水溶液中的离子反应与平衡
人教版 高中化学 必修一
第四节 沉淀溶解平衡第1课时 难溶电解质的沉淀溶解平衡
目录
一 、课标要求
二 、思考交流
三 、活学活用
四 、问题探究
1.能描述沉淀溶解平衡,知道溶解平衡的特征。 2.根据化学平衡理论,分析影响沉淀溶解平衡的因素。 3.了解离子积与Ksp的相对大小跟沉淀溶解平衡的关系。
课标要求
云水洞洞口有赵朴初先生亲笔所题写的"云水洞"三个大字。走进洞来,便见洞内石钟乳,石笋目不暇接。
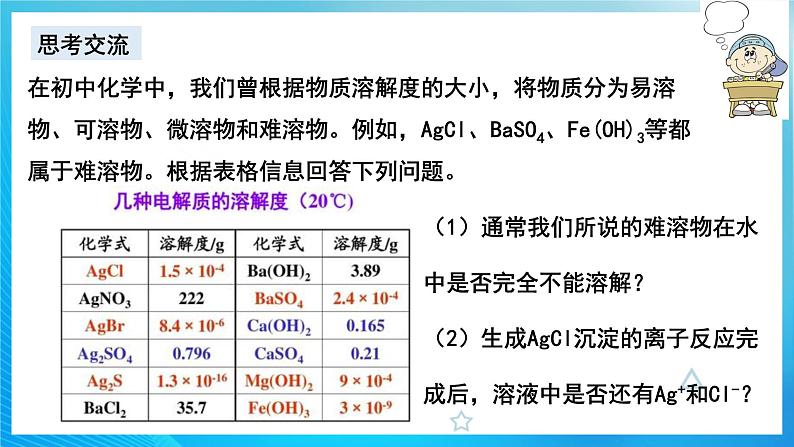
在初中化学中,我们曾根据物质溶解度的大小,将物质分为易溶物、可溶物、微溶物和难溶物。例如,AgCl、BaSO4、Fe(OH)3等都属于难溶物。根据表格信息回答下列问题。
(1)通常我们所说的难溶物在水中是否完全不能溶解?(2)生成AgCl沉淀的离子反应完成后,溶液中是否还有Ag+和Cl-?
思考交流
溶解度与溶解性的关系:20℃
0.01
1
10
S /g
人们习惯上将溶解度小于0.01g的电解质称为难溶电解质。尽管难溶电解质的溶解质的溶解度很小,但在水中并不是绝对不溶。
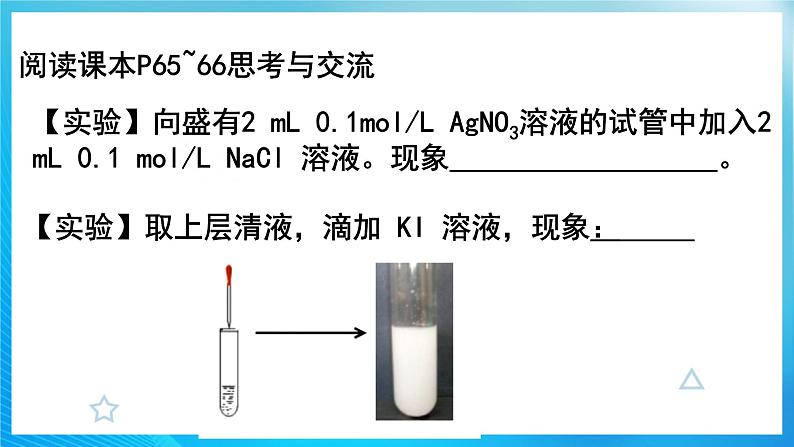
阅读课本P65~66思考与交流
【实验】向盛有2 mL 0.1mol/L AgNO3溶液的试管中加入2 mL 0.1 mol/L NaCl 溶液。现象 。
【实验】取上层清液,滴加 KI 溶液,现象:
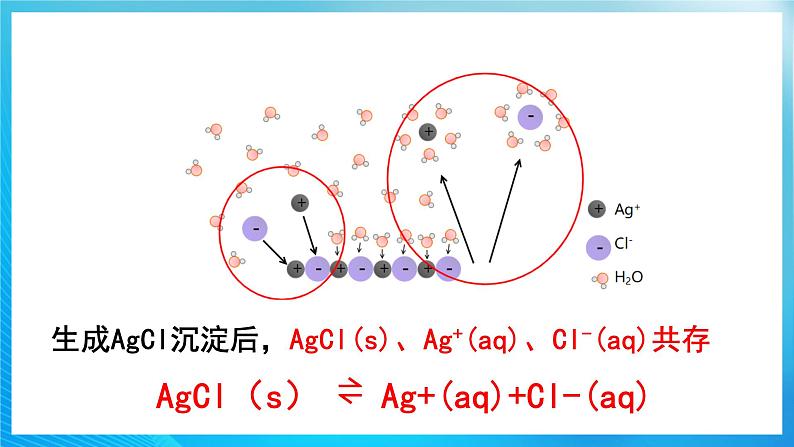
生成AgCl沉淀后,AgCl(s)、Ag+(aq)、Cl-(aq)共存
AgCl(s) ⇌ Ag+(aq)+Cl-(aq)
1、定义: 在一定温度下,难溶电解质溶于水,沉淀的溶解和生成速率相等,溶液达到饱和状态时,即建立了溶解平衡(也叫沉淀溶解平衡) 。
一、难溶电解质的溶解平衡
2、沉淀溶解平衡的建立
v溶解 v沉淀 ,固体溶解;v溶解 v沉淀 ,溶解平衡;v溶解 v沉淀 ,析出晶体。
>
=
<
3、特征
可逆
动态
=
离子浓度
4、表达式
难溶电解质用“s”标明状态,溶液中的离子用“ ”标明状态,并用“ ⇌ ”连接。
aq
当堂练习 请写出BaSO4、CaCO3、Ag2S的沉淀溶解平衡表达式。
5、生成难溶电解质的离子反应的限度
反应完全的标志对于常量的化学反应来说,化学上通常认为残留在溶液中的离子浓度小于 时,沉淀就达完全。
1×10-5
根据本节课所学内容,请思考如何使沉淀反应完成后,溶液中的Ag+浓度能够尽量小? 你能想出几种办法?
思考交流
二、沉淀溶解平衡的影响因素
沉淀溶解平衡属于化学平衡,外界因素对其的影响,同样遵守勒夏特列原理。①内因 难溶电解质本身的性质,这是决定因素。②外因温度——绝大多数难溶盐的溶解是吸热过程,升高温度, 平衡向溶解方向移动;少量平衡向生成沉淀的方向移动,
特例:a.随温度变化不明显:NaCl b.随温度升高反而降低:Ca(OH)2 c.与水任意比混溶:乙醇等
二、沉淀溶解平衡的影响因素
浓度——加水稀释,平衡向 的方向移动同离子效应——向平衡体系中加入难溶物相应的离子,平衡向 的方向移动其他——向平衡体系中加入可与体系中某些离子反应生成更难溶或更难电离或气体的离子时,平衡向 的方向移动
溶解
生成沉淀
溶解
对于平衡 Cu(OH)2(S) Cu2+(aq) + 2OH-(aq) 改变哪些条件,平衡能发生移动?
思考交流
D
活学活用
上述1 mL 0.012 mol/L的 NaCl溶液与1 mL 0.010 mol/L AgNO3溶液充分反应后,溶液中剩余Ag+的浓度是多少? 涉及化学平衡的计算常需要哪些数据?
思考交流
1、定义: 在一定温度下,沉淀达溶解平衡后的溶液为 溶液,其离子浓度 ,溶液中各离子浓度幂之积为常数,叫做溶度积常数(简称溶度积),用 表示。
三、溶度积
饱和
不再发生变化
Ksp
2、表达式
Ksp只与难溶电解质的 和 有关。溶液中离子浓度的改变只能使平衡移动,不能改变溶度积。
性质
温度
Ksp = c2(Ag+)·c(S2- )
3、影响因素
常见难溶电解质的溶度积常数(25 ℃)
①Ksp反映了难溶电解质在水中的溶解能力。 Ksp越小,越难溶。
对同类型的难溶电解质,如AgCl、AgBr、AgI,在相同温度下,Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI),则溶解度 。
S(AgCl)<S(AgBr)<S(AgI)
②Ksp与温度有关。 其它条件一定时,一般温度越高,Ksp越大。
4、意义
通过比较溶度积与溶液中有关离子浓度幂的乘积——离子积Qc的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解:①Qc>Ksp,溶液过饱和,有 析出,直至溶液饱和,达到新的平衡。②Qc=Ksp,溶液饱和,沉淀与溶解处于 。③Qc
相关课件
这是一份人教版 (2019)选择性必修1第四节 沉淀溶解平衡获奖ppt课件,文件包含341难溶电解质的沉淀溶解平衡练习解析版docx、341难溶电解质的沉淀溶解平衡练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡完美版ppt课件,文件包含人教版高中化学选择性必修一341《难溶电解质的沉淀溶解平衡》课件pptx、人教版高中化学选择性必修一341《难溶电解质的沉淀溶解平衡》学案docx等2份课件配套教学资源,其中PPT共40页, 欢迎下载使用。
这是一份高中化学第三章 水溶液中的离子反应与平衡第四节 沉淀溶解平衡优秀ppt课件,共21页。PPT课件主要包含了学习目标,你知道吗,难溶≠不溶,动动脑动动手等内容,欢迎下载使用。









