
所属成套资源:2023年鲁教版初中九年级化学全一册教案
2.4 酸碱中和反应 教案2022-2023学年鲁教版九年级全一册
展开
这是一份2.4 酸碱中和反应 教案2022-2023学年鲁教版九年级全一册,共2页。
《酸碱中和反应》教学设计复备人: 复备时间:学科化学设计者九年级化学组单位泰安市岱岳区开元中学年级九年级来源鲁教版九年级全一册课时1课时【课程标准】2022版认识酸、碱的主要性质和用途。【学习目标】1.通过观察与推理,归纳酸碱反应的规律,认识中和反应的概念和微观实质。2.通过实验探究,测定并绘制pH变化曲线,理解酸碱中和反应中pH变化及微观过程。3.通过实例,认识中和反应在医药卫生、土壤改良、污水处理、科学实验等方面的应用。【德育融合点】1.通过验证酸碱之间的反应,认识科学探究的基本过程,进行初步的探究活动。2.通过化学实验,增强对化学学习的好奇心和探究欲,培养学习化学的兴趣,发展理性思维和探究精神。【评价任务设计】1.能利用酸碱指示剂、PH 试纸设计实验验证酸和碱发生了反应。2.能利用微观反应动画解释微观反应的实质。3.写出酸和碱反应的化学方程式,总结出中和反应的特点和实质。4.根据中和反应过程中溶液pH的变化,分析不同pH下溶液中溶质的组成。5.了解中和反应在生产生活中的应用。【主问题设计】1.酸和碱反应无明显现象实验的探究2.酸碱中和反应的实质3.分析中和反应过程中不同pH下溶液中溶质的组成4.中和反应的应用【教学活动】[知识再现]检验溶液酸碱性的方法有哪些?1.用酸碱指示剂可以区别溶液的酸碱性。酸能使紫色石蕊试液红色,使无色酚酞试液不变色;碱能使紫色石蕊试液变蓝色,无色酚酞试液变红色。2.溶液酸碱性强弱常用pH来表示,用pH试纸测定。pH <7 时,溶液显酸性;pH = 7 时,溶液显中性; pH >7 时,溶液显碱性。为什么酸类(碱类)物质具有共同的性质?酸溶液中含有相同的H+;碱溶液中含有相同的OH- 学习活动一:中和反应[提出问题]盐酸和氢氧化钠会发生反应吗?猜想一:发生反应,但无明显现象猜想二:不发生反应[设计实验方案]利用提供的药品和仪器,设计实验方案 药品:氢氧化钠溶液、稀盐酸、紫色石蕊试液、无色酚酞试液、PH 试纸设计方案并进行实验1、取一支试管,向其中加入少量氢氧化钠溶液,然后滴入几滴酚酞,观察颜色变化2、向上述试管中逐滴滴加盐酸溶液,观察颜色变化【实验结论】盐酸和氢氧化钠之间发生反应化学方程式:HCl + NaOH =NaCl+ H2O中和反应微观动画中和反应:酸与碱作用生成盐和水的反应实质: H+和OH-结合生成H2O注意:中和反应不属于基本反应类型学习活动二:盐酸和氢氧化钠反应中溶液pH的变化向盛有稀盐酸的烧杯中逐滴滴加氢氧化钠溶液,用pH计测定溶液的pH
学习活动一:中和反应[提出问题]盐酸和氢氧化钠会发生反应吗?猜想一:发生反应,但无明显现象猜想二:不发生反应[设计实验方案]利用提供的药品和仪器,设计实验方案 药品:氢氧化钠溶液、稀盐酸、紫色石蕊试液、无色酚酞试液、PH 试纸设计方案并进行实验1、取一支试管,向其中加入少量氢氧化钠溶液,然后滴入几滴酚酞,观察颜色变化2、向上述试管中逐滴滴加盐酸溶液,观察颜色变化【实验结论】盐酸和氢氧化钠之间发生反应化学方程式:HCl + NaOH =NaCl+ H2O中和反应微观动画中和反应:酸与碱作用生成盐和水的反应实质: H+和OH-结合生成H2O注意:中和反应不属于基本反应类型学习活动二:盐酸和氢氧化钠反应中溶液pH的变化向盛有稀盐酸的烧杯中逐滴滴加氢氧化钠溶液,用pH计测定溶液的pH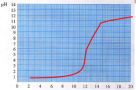 当滴入氢氧化钠溶液不足时pH<7,HCl有剩余,溶液显酸性。当滴入氢氧化钠溶液与HCl恰好完全反应时pH=7,溶液显中性。当滴入氢氧化钠溶液过量时pH>7,氢氧化钠有剩余,溶液显碱性。 学习活动三:中和反应的应用 1、应用于医疗卫生 胃酸(HCl)过多口服碱性药物(例:胃舒平和斯达舒;Mg(OH)2、 Al(OH)3 Al(OH)3 + 3HCl = AlCl3 + 3H2O Mg(OH)2 + 2HCl = MgCl2 + 2H2O 问题:能否可以用氢氧化钠中和胃酸?答:不可以,因为氢氧化钠具有强烈腐蚀性。2、改变土壤的酸碱性 (1)土壤显酸性:熟石灰[Ca(OH)2]和草木灰[主要成分K2CO3]。(2)土壤显碱性:稀硫酸(H2SO4)和 碳酸(H2CO3)。3、处理工业废水 向酸性废水(HCl或H2SO4)中加熟石灰(Ca(OH)2)Ca(OH)2 + 2HCl = CaCl2 + 2H2O Ca(OH)2 + H2SO4 = CaSO4 + 2H2O 4、调节溶液的酸碱性实际应用:做完化学实验后剩余的酸性废液或碱性废液能否直接倒入下水道?应如何处理?【主问题处理过程】通过回顾上节课内容,为本节课做铺垫 熟练掌握鉴别溶液酸碱性的方法 思考,提出猜想 思考回答需要的药品仪器学生思考设计出实验方案,教师讲解完善 通过实验视频观察现象,思考,得出实验结论 观看中和反应微观动画,分析中和反应的实质 观察向盛有稀盐酸的烧杯中加入氢氧化钠的曲线图,并总结规律 了解中和反应在生活中的应用,知道典型应用的原理【成果与评价】 【布置作业】完成课时训练【板书设计】酸碱中和反应1.盐酸与氢氧化钠反应2.中和反应 中和反应不属于基本反应类型3.中和反应的应用【我感、我思、我成长】
当滴入氢氧化钠溶液不足时pH<7,HCl有剩余,溶液显酸性。当滴入氢氧化钠溶液与HCl恰好完全反应时pH=7,溶液显中性。当滴入氢氧化钠溶液过量时pH>7,氢氧化钠有剩余,溶液显碱性。 学习活动三:中和反应的应用 1、应用于医疗卫生 胃酸(HCl)过多口服碱性药物(例:胃舒平和斯达舒;Mg(OH)2、 Al(OH)3 Al(OH)3 + 3HCl = AlCl3 + 3H2O Mg(OH)2 + 2HCl = MgCl2 + 2H2O 问题:能否可以用氢氧化钠中和胃酸?答:不可以,因为氢氧化钠具有强烈腐蚀性。2、改变土壤的酸碱性 (1)土壤显酸性:熟石灰[Ca(OH)2]和草木灰[主要成分K2CO3]。(2)土壤显碱性:稀硫酸(H2SO4)和 碳酸(H2CO3)。3、处理工业废水 向酸性废水(HCl或H2SO4)中加熟石灰(Ca(OH)2)Ca(OH)2 + 2HCl = CaCl2 + 2H2O Ca(OH)2 + H2SO4 = CaSO4 + 2H2O 4、调节溶液的酸碱性实际应用:做完化学实验后剩余的酸性废液或碱性废液能否直接倒入下水道?应如何处理?【主问题处理过程】通过回顾上节课内容,为本节课做铺垫 熟练掌握鉴别溶液酸碱性的方法 思考,提出猜想 思考回答需要的药品仪器学生思考设计出实验方案,教师讲解完善 通过实验视频观察现象,思考,得出实验结论 观看中和反应微观动画,分析中和反应的实质 观察向盛有稀盐酸的烧杯中加入氢氧化钠的曲线图,并总结规律 了解中和反应在生活中的应用,知道典型应用的原理【成果与评价】 【布置作业】完成课时训练【板书设计】酸碱中和反应1.盐酸与氢氧化钠反应2.中和反应 中和反应不属于基本反应类型3.中和反应的应用【我感、我思、我成长】






