


2022年高一上学期综合检测(物质的量)化学试题 (无答案)
展开
这是一份2022年高一上学期综合检测(物质的量)化学试题 (无答案),共8页。
物质的量一.选择题(每小题只有1或2个答案)1.如果a g 某气体中含有分子数为b,则c g该气体在标准状况下的体积是( )。A.![]() B.
B.![]() C.
C.![]() D.
D.![]() 2.将0.1 mol/L的K2SO4溶液、0.2 mol/L的Al2(SO4)3溶液和蒸馏水混合,要使混合溶液中K+、Al3+、SO42- 的浓度分别为0.1 mol/L、0.1 mol/L、0.2 mol/L,则所取K2SO4溶液、Al2(SO4)3溶液和蒸馏水三者的体积比大约是( )。A.1:1:1 B.1:1:2 C.2:1:2. D.2:1:13.某学生用量筒量取液体、量筒放平稳且面向刻度线、初次仰视液面读数为19mL倾出部分液体后,俯视液面,读数是11mL则实际倾出液体的体积是( )。A.8ml B.大于8mL C.小于8mL D.无法判断4.甲、乙两烧杯中分别加入等体积等浓度的H2SO4溶液,向甲杯中加入m g Mg,向乙杯中加入m g Zn,完全反应后,一烧杯中仍有金属未溶解,则甲、乙两烧杯中原来的物质的量X的值为( )。A.m/24<x<m/65 B.x = m/64 C.m/24>x≥m/65. D.m/65>x≥m/245.相对分子质量为M的某物质,在室温下溶解度为S g/100 g水,此时测得该物质饱和溶液的密度为ρg/cm3,则该饱和溶液的物质的量的浓度是( )。A.
2.将0.1 mol/L的K2SO4溶液、0.2 mol/L的Al2(SO4)3溶液和蒸馏水混合,要使混合溶液中K+、Al3+、SO42- 的浓度分别为0.1 mol/L、0.1 mol/L、0.2 mol/L,则所取K2SO4溶液、Al2(SO4)3溶液和蒸馏水三者的体积比大约是( )。A.1:1:1 B.1:1:2 C.2:1:2. D.2:1:13.某学生用量筒量取液体、量筒放平稳且面向刻度线、初次仰视液面读数为19mL倾出部分液体后,俯视液面,读数是11mL则实际倾出液体的体积是( )。A.8ml B.大于8mL C.小于8mL D.无法判断4.甲、乙两烧杯中分别加入等体积等浓度的H2SO4溶液,向甲杯中加入m g Mg,向乙杯中加入m g Zn,完全反应后,一烧杯中仍有金属未溶解,则甲、乙两烧杯中原来的物质的量X的值为( )。A.m/24<x<m/65 B.x = m/64 C.m/24>x≥m/65. D.m/65>x≥m/245.相对分子质量为M的某物质,在室温下溶解度为S g/100 g水,此时测得该物质饱和溶液的密度为ρg/cm3,则该饱和溶液的物质的量的浓度是( )。A.![]() mol/L B.
mol/L B.![]() mol/L C.
mol/L C.![]() mol/L D.
mol/L D.![]() mol/L 6.某气体的摩尔质量为M g·mol-1,NA表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X.则Mx/VNA表示的是( )。A.以g为单位VL该气体的质量 B.以g为单位1L该气体的质量C.1L该气体中所含的分子数 D.以L为单位1mol该气体的体积7.设NA为阿伏加德罗常数,下列说法不正确的是( )。A.某98%的浓H2SO4中含有1moL H2SO4,用水稀释10倍,H+离子数不变且为2NAB.在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2NA个电子C.常温常压下,氧气和臭氧的混合物16g中约含有6.02×1023个氧分子D.一定温度下,1 L 0.50 mol·L-1 NH4Cl与2 L 0.25 mol·L-1 NH4Cl两种溶液含n(NH+4)不同8.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是( )。A.标准状况下,22.4 L丁烷中共价键数目为12×6.02×1023B.4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023C.含12.0 g NaHSO4的溶液中阳离子所携带的正电荷数约为0.2×6.02×1023D.常温常压下,22.4 L CC12 F2中含有原子数小于5×6.02×1023个9.右图是某物质的溶解度曲线,根据该图判断下列说法错误的是( )。
mol/L 6.某气体的摩尔质量为M g·mol-1,NA表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X.则Mx/VNA表示的是( )。A.以g为单位VL该气体的质量 B.以g为单位1L该气体的质量C.1L该气体中所含的分子数 D.以L为单位1mol该气体的体积7.设NA为阿伏加德罗常数,下列说法不正确的是( )。A.某98%的浓H2SO4中含有1moL H2SO4,用水稀释10倍,H+离子数不变且为2NAB.在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2NA个电子C.常温常压下,氧气和臭氧的混合物16g中约含有6.02×1023个氧分子D.一定温度下,1 L 0.50 mol·L-1 NH4Cl与2 L 0.25 mol·L-1 NH4Cl两种溶液含n(NH+4)不同8.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是( )。A.标准状况下,22.4 L丁烷中共价键数目为12×6.02×1023B.4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023C.含12.0 g NaHSO4的溶液中阳离子所携带的正电荷数约为0.2×6.02×1023D.常温常压下,22.4 L CC12 F2中含有原子数小于5×6.02×1023个9.右图是某物质的溶解度曲线,根据该图判断下列说法错误的是( )。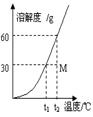 A.M点对应的溶液是t2℃的不饱和溶液B.若保持温度不变,100 g M点溶液需含溶质60 g才能达饱和C.130 g M点溶液最少要蒸发50 g水后才能成为t2℃的饱和溶液D.在保持溶质和和溶剂质量不变的情况下,使M点溶液达到饱和需降温 (t2-t1)℃10.两种金属的混合粉末25g ,与足量盐酸充分反应后,得标准状况下的H2 11.2L,则下列各组金属可能的是( )。A. Mg 和Zn B. Zn 和Fe C. Al 和Na D. Zn 和Cu 11.100 mL的N2、O2、CO2混合气体通过足量的Na2O2后,体积变为75 mL(同温同压),原混合气体中N2、O2、CO2物质的量之比可能为( )。A.1:2:1 B.3:5:4 C.6:7:13 D.2:1:212.由CO、H2和O2组成的混和气体60 mL,在一定条件下恰好完全反应,测得生成物在101kPa 120℃下对氢气的相对密度为18.75,则原混和气体中H2所占的体积分数为( )。A. 1/6 B. 2/3 C. 1/4 D. 1/313.生态农业涉及农家废料的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、氮气的混合气体。2.016 L(标准状况)该气体通过盛有红热CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuOCO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通过过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。原混合气体中氮气的体积分数为( )。A.5.56% B.83.3% C.11.1% D.22.2%14.下列实验操作或解释不合理的是( )。A.用酸式滴定管盛装氨水,加入20.00 mL于锥形瓶中,再用标准硫酸溶液标定氨水浓度B.容量瓶的刻度环在小口径的细颈处,是为了提高配制溶液体积的精确程度的C.在托盘天平两端各放置一张规格大小相同的纸张,准确称量4.0 gNaOH,配制成100 mL的溶液,其物质的量浓度为1mol/LD.容量瓶的瓶塞系在容量瓶的颈部是为了防止瓶塞和容量瓶混淆而不匹配的15.120℃101325Pa时10 mL某气态链烃可在35 mL O2中实现完全燃烧,燃烧后在相同状况下测得反应后混和物气体总体积是45 mL,则对该烃的说法不正确的是A.可能是烷烃 B.可能是烯烃 C.可能是炔烃 D.可能是苯的同系物16.将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )。
A.M点对应的溶液是t2℃的不饱和溶液B.若保持温度不变,100 g M点溶液需含溶质60 g才能达饱和C.130 g M点溶液最少要蒸发50 g水后才能成为t2℃的饱和溶液D.在保持溶质和和溶剂质量不变的情况下,使M点溶液达到饱和需降温 (t2-t1)℃10.两种金属的混合粉末25g ,与足量盐酸充分反应后,得标准状况下的H2 11.2L,则下列各组金属可能的是( )。A. Mg 和Zn B. Zn 和Fe C. Al 和Na D. Zn 和Cu 11.100 mL的N2、O2、CO2混合气体通过足量的Na2O2后,体积变为75 mL(同温同压),原混合气体中N2、O2、CO2物质的量之比可能为( )。A.1:2:1 B.3:5:4 C.6:7:13 D.2:1:212.由CO、H2和O2组成的混和气体60 mL,在一定条件下恰好完全反应,测得生成物在101kPa 120℃下对氢气的相对密度为18.75,则原混和气体中H2所占的体积分数为( )。A. 1/6 B. 2/3 C. 1/4 D. 1/313.生态农业涉及农家废料的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、氮气的混合气体。2.016 L(标准状况)该气体通过盛有红热CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuOCO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通过过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。原混合气体中氮气的体积分数为( )。A.5.56% B.83.3% C.11.1% D.22.2%14.下列实验操作或解释不合理的是( )。A.用酸式滴定管盛装氨水,加入20.00 mL于锥形瓶中,再用标准硫酸溶液标定氨水浓度B.容量瓶的刻度环在小口径的细颈处,是为了提高配制溶液体积的精确程度的C.在托盘天平两端各放置一张规格大小相同的纸张,准确称量4.0 gNaOH,配制成100 mL的溶液,其物质的量浓度为1mol/LD.容量瓶的瓶塞系在容量瓶的颈部是为了防止瓶塞和容量瓶混淆而不匹配的15.120℃101325Pa时10 mL某气态链烃可在35 mL O2中实现完全燃烧,燃烧后在相同状况下测得反应后混和物气体总体积是45 mL,则对该烃的说法不正确的是A.可能是烷烃 B.可能是烯烃 C.可能是炔烃 D.可能是苯的同系物16.将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )。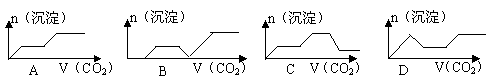
 17.38.4 g铜与适量的浓HNO3混合,充分反应后固体物质完全消失,共收集到22.4 L(标准状况)气体,反应生成NO2和NO的物质的量之比是( )。A.1 :3 B.1:1 C.9:1 D.3:118.t℃将一定量的某物质的溶液均分为三份,分别加热蒸发溶剂,然后把温度降至t℃。已知从三份溶液中蒸发的溶剂分别为10 g、20 g、30 g,析出的晶体不含结晶水,其质量分别为a g、b g、c g,则a、b、c三者的关系正确的为( )。A.c = a + b B.c = 2a + b C.c = 2b-a D.c = a + 2b 19.在t℃时,将一定量的CuSO4溶液蒸发掉a g水后冷却到t℃,有m g CuSO4·5H2O析出,若再加热蒸发掉b g水并冷却到t℃,又析出n g CuSO4·5H2O,用S表示t℃时CuSO4的溶解度,下列算式一定正确的是( )。A.S =1600 m/(25a+9b) B.S = 100 n/b C.S = 100(m+n)/(a+b) D.S =1600 n/(25b+9n)20.在一定量的Ba(NO3)2溶液中滴入0.05 mol/L的稀硫酸,恰好使溶液中的Ba2+沉淀完全。此时溶液的体积为100 mL(忽略反应时溶液体积变化),测得溶液的pH值为2,则原溶液中溶质的物质的量浓度为( )。A.0.011 mol/L B.0.11 mol/L C.0.0055 mol/L D.0.55 mol/L 二、填空题21.为了测定某水泥样品成分,称取10.0 g样品,将其中的Ca元素转化为CaC2O4沉淀,将沉淀用稀酸处理得H2C2O4溶液,取该溶液体积的1/100,用KMnO4溶液滴定(氧化产物为CO2,还原产物为Mn2+),结果用去0.0200 mol·L-1的KMnO4溶液24.00 mL。该样品中Ca的氧化物的质量分数是_____________________。
17.38.4 g铜与适量的浓HNO3混合,充分反应后固体物质完全消失,共收集到22.4 L(标准状况)气体,反应生成NO2和NO的物质的量之比是( )。A.1 :3 B.1:1 C.9:1 D.3:118.t℃将一定量的某物质的溶液均分为三份,分别加热蒸发溶剂,然后把温度降至t℃。已知从三份溶液中蒸发的溶剂分别为10 g、20 g、30 g,析出的晶体不含结晶水,其质量分别为a g、b g、c g,则a、b、c三者的关系正确的为( )。A.c = a + b B.c = 2a + b C.c = 2b-a D.c = a + 2b 19.在t℃时,将一定量的CuSO4溶液蒸发掉a g水后冷却到t℃,有m g CuSO4·5H2O析出,若再加热蒸发掉b g水并冷却到t℃,又析出n g CuSO4·5H2O,用S表示t℃时CuSO4的溶解度,下列算式一定正确的是( )。A.S =1600 m/(25a+9b) B.S = 100 n/b C.S = 100(m+n)/(a+b) D.S =1600 n/(25b+9n)20.在一定量的Ba(NO3)2溶液中滴入0.05 mol/L的稀硫酸,恰好使溶液中的Ba2+沉淀完全。此时溶液的体积为100 mL(忽略反应时溶液体积变化),测得溶液的pH值为2,则原溶液中溶质的物质的量浓度为( )。A.0.011 mol/L B.0.11 mol/L C.0.0055 mol/L D.0.55 mol/L 二、填空题21.为了测定某水泥样品成分,称取10.0 g样品,将其中的Ca元素转化为CaC2O4沉淀,将沉淀用稀酸处理得H2C2O4溶液,取该溶液体积的1/100,用KMnO4溶液滴定(氧化产物为CO2,还原产物为Mn2+),结果用去0.0200 mol·L-1的KMnO4溶液24.00 mL。该样品中Ca的氧化物的质量分数是_____________________。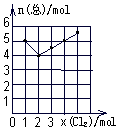 22.Cl2与NO2在一定条件下发生化合反应,生成一种气体,实验数据如图。图中横坐标是加入C12的物质的量,纵坐标是反应后气体物质的量总和。已知所取C12 、NO2的物质的量总和为6 mol。则生成物的化学式是______________。23.已知H2的燃烧热285.8 kJ/mol。现有CH4和H2的混合气体共0.2 mol,与O2完全燃烧生成H2O(1)和CO2(g),转移电子的物质的量为1.0 mol,放出的热量为117.6 kJ。则Z完全燃烧的热化学反应方程式为:_______________________________________________。24.某学生用已知质量y g的表面皿,准确称取w g NaOH固体。他在托盘天平的右盘上放(w+y)g砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边(如右图所示):(1)下面他的操作应该是______________________,使______________________。(2)若称取的w g NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制500mLNaOH溶液过程示意图中有错误的是(填操作序号)___________________。
22.Cl2与NO2在一定条件下发生化合反应,生成一种气体,实验数据如图。图中横坐标是加入C12的物质的量,纵坐标是反应后气体物质的量总和。已知所取C12 、NO2的物质的量总和为6 mol。则生成物的化学式是______________。23.已知H2的燃烧热285.8 kJ/mol。现有CH4和H2的混合气体共0.2 mol,与O2完全燃烧生成H2O(1)和CO2(g),转移电子的物质的量为1.0 mol,放出的热量为117.6 kJ。则Z完全燃烧的热化学反应方程式为:_______________________________________________。24.某学生用已知质量y g的表面皿,准确称取w g NaOH固体。他在托盘天平的右盘上放(w+y)g砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边(如右图所示):(1)下面他的操作应该是______________________,使______________________。(2)若称取的w g NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制500mLNaOH溶液过程示意图中有错误的是(填操作序号)___________________。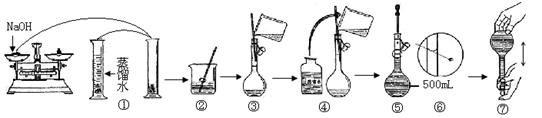 25.氢气还原某氧化铜的样品时,因反应不完全,得到Cu、Cu2O、CuO和杂质的固体混合物。某化学兴趣小组为探究上述固体中Cu元素的含量,进行了如下操作和实验(设杂质不参与化学反应):(Ⅰ)取56 g均匀固体混合物,将其分成两等份。
25.氢气还原某氧化铜的样品时,因反应不完全,得到Cu、Cu2O、CuO和杂质的固体混合物。某化学兴趣小组为探究上述固体中Cu元素的含量,进行了如下操作和实验(设杂质不参与化学反应):(Ⅰ)取56 g均匀固体混合物,将其分成两等份。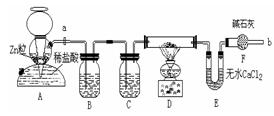 (Ⅱ)取其中一份按下图装置继续用氢气还原,D装置的硬质双通玻璃管中的固体是Cu、Cu2O、CuO和杂质的混合物。反应完全后,继续通入氢气一段时间,使产物充分被E吸收,U型管的质量增加3.6 g。(Ⅲ)另一份加入足量稀硝酸充分溶解,使Cu元素全部转化为Cu2+,共收集到标准状况下NO气体2.24 L。⑴ 如何检查上图装置中A的气密性:___________________⑵ 确认可以点燃D处的酒精灯的实验操作及现象是______________________⑶ 装置B中溶液的作用是_____________,装置C中装的液体是_______________⑷ 分析56g均匀固体混合物中:n(Cu)+n(Cu2O)=________________________⑸ 混合物中Cu元素的质量分数为__________________________________________⑹ 若已知Cu2O + H2SO4 = Cu + CuSO4 + H2O,则将该56g均匀混合物溶于足量稀硫酸,理论上可制得胆矾_______________g。26.某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:
(Ⅱ)取其中一份按下图装置继续用氢气还原,D装置的硬质双通玻璃管中的固体是Cu、Cu2O、CuO和杂质的混合物。反应完全后,继续通入氢气一段时间,使产物充分被E吸收,U型管的质量增加3.6 g。(Ⅲ)另一份加入足量稀硝酸充分溶解,使Cu元素全部转化为Cu2+,共收集到标准状况下NO气体2.24 L。⑴ 如何检查上图装置中A的气密性:___________________⑵ 确认可以点燃D处的酒精灯的实验操作及现象是______________________⑶ 装置B中溶液的作用是_____________,装置C中装的液体是_______________⑷ 分析56g均匀固体混合物中:n(Cu)+n(Cu2O)=________________________⑸ 混合物中Cu元素的质量分数为__________________________________________⑹ 若已知Cu2O + H2SO4 = Cu + CuSO4 + H2O,则将该56g均匀混合物溶于足量稀硫酸,理论上可制得胆矾_______________g。26.某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下: ①装好实验装置。②检查装置气密性。③把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为ag。 ④加热,开始反应,直到产生一定量的气体。⑤停止加热(如图,导管出口高于液面)。⑥测量收集到气体的体积。⑦准确称量试管和残留物的质量为b g。⑧测量实验室的温度。⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。⑩处理实验数据,求出氧气的摩尔质量。回答下列问题:⑴以下是测量收集到气体体积必须包括的几个步骤;①调整量简内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是:______________(请填写步骤代号)。⑵测量收集到气体体积时,如何使量筒内外液面的高度相同?____________________。⑶如果实验中得到的氧气体积是c L(已换算成标准状况下),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简):M(O2)=______________。三、计算题27.一般情况下,较强的氧化剂如:MnO2、KMnO4、KClO3、Ca(ClO)2等氧化浓盐酸时,有如下反应规律:氧化剂+浓盐酸→金属氯化物+水+氯气。实验室通常用该原理制取少量Cl2。⑴ 从原子经济学角度出发,要使浓盐酸中Cl-充分转化为Cl2,制取等量的Cl2最好选用上述氧化剂中的_________________氧化浓盐酸。⑵ 将214.5 g Ca(ClO)2放入500 mL、12.0 mol/L的浓盐酸中,生成的Cl2在标准状况下的体积为39.2 L。若反应前后溶液的体积保持不变,计算反应后溶液中HCl的物质的量浓度。28.某校课外活动小组为测定生石膏的组成(CaSO4·xH2O),即测定x值,做如下实验:将生石膏放在坩埚中加热,加热前、后都进行称量。随实验次数增加,加热时间不断延长,最后整理加热前后固体质量数据如下表(下右图为根据数据绘制的图象):实验顺序加热前/g加热后/g实验顺序加热前/g
①装好实验装置。②检查装置气密性。③把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为ag。 ④加热,开始反应,直到产生一定量的气体。⑤停止加热(如图,导管出口高于液面)。⑥测量收集到气体的体积。⑦准确称量试管和残留物的质量为b g。⑧测量实验室的温度。⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。⑩处理实验数据,求出氧气的摩尔质量。回答下列问题:⑴以下是测量收集到气体体积必须包括的几个步骤;①调整量简内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是:______________(请填写步骤代号)。⑵测量收集到气体体积时,如何使量筒内外液面的高度相同?____________________。⑶如果实验中得到的氧气体积是c L(已换算成标准状况下),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简):M(O2)=______________。三、计算题27.一般情况下,较强的氧化剂如:MnO2、KMnO4、KClO3、Ca(ClO)2等氧化浓盐酸时,有如下反应规律:氧化剂+浓盐酸→金属氯化物+水+氯气。实验室通常用该原理制取少量Cl2。⑴ 从原子经济学角度出发,要使浓盐酸中Cl-充分转化为Cl2,制取等量的Cl2最好选用上述氧化剂中的_________________氧化浓盐酸。⑵ 将214.5 g Ca(ClO)2放入500 mL、12.0 mol/L的浓盐酸中,生成的Cl2在标准状况下的体积为39.2 L。若反应前后溶液的体积保持不变,计算反应后溶液中HCl的物质的量浓度。28.某校课外活动小组为测定生石膏的组成(CaSO4·xH2O),即测定x值,做如下实验:将生石膏放在坩埚中加热,加热前、后都进行称量。随实验次数增加,加热时间不断延长,最后整理加热前后固体质量数据如下表(下右图为根据数据绘制的图象):实验顺序加热前/g加热后/g实验顺序加热前/g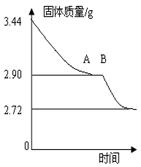 加热后/g13.443.2653.442.8023.443.1263.442.7833.442.9073.442.7243.442.9083.442.72(1)利用实验数据,通过计算推断生石膏的化学式。(2)若将所得的固体残渣继续升温灼烧,发现质量还会减轻,简述你认为可能的原因。
加热后/g13.443.2653.442.8023.443.1263.442.7833.442.9073.442.7243.442.9083.442.72(1)利用实验数据,通过计算推断生石膏的化学式。(2)若将所得的固体残渣继续升温灼烧,发现质量还会减轻,简述你认为可能的原因。
相关试卷
这是一份山东省名校联盟2023-2024学年高一上学期11月期中检测化学试题(无答案),共8页。
这是一份2022年高一上学期综合检测(金属及其化合物)化学试题 (无答案),共6页。试卷主要包含了用于飞机制造的材料应具备强度高,下列离子在溶液中能大量共存的是,下列离子方程式正确的是等内容,欢迎下载使用。
这是一份2022年高一上学期综合检测(硫的氧化物)化学试题 (无答案),共6页。试卷主要包含了选择题,填空题,计算题等内容,欢迎下载使用。









