


2024届高考化学一轮总复习课时跟踪练18晶体结构与性质
展开课时跟踪练18
一、选择题
1.(2022·石家庄第一中学月考)单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。下列说法错误的是( )
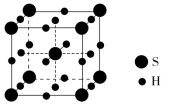
A.S位于元素周期表p区
B.该物质的化学式为H3S
C.S位于H构成的八面体空隙中
D.该晶体属于分子晶体
解析:S原子的价层电子排布式为3s23p4,故S位于元素周期表p区,A项正确;由该物质形成晶体的晶胞可知,S原子个数为8×+1=2,H原子个数为12×+6×=6,故H、S原子个数比为3∶1,故该物质的化学式为H3S,B项正确;S位于H构成的八面体空隙中,如图所示 ,C项正确;由于该晶体是一种新型超导材料,说明其是由阴、阳离子构成的,故该晶体属于离子晶体,D项错误。
,C项正确;由于该晶体是一种新型超导材料,说明其是由阴、阳离子构成的,故该晶体属于离子晶体,D项错误。
答案:D
2.(2022·东北育才学校月考)下列有关晶体的说法正确的有( )
①石英和金刚石都是共价晶体,最小环上都有6个原子
②在晶体中只要有阴离子就一定有阳离子
③金刚石、金刚砂、冰、干冰晶体的熔点依次降低
④石墨晶体中碳原子数和C—C个数之比为1∶2
⑤Al2O3晶体中离子键成分百分数较小,所以可以当作共价晶体
⑥石墨晶体中只有σ键
A.1项 B.2项
C.3项 D.4项
解析:石英是SiO2,其空间结构示意图为 ,其最小环中有12个原子,①错误;晶体只要有阴离子就一定有阳离子,②正确;金刚砂为SiC,金刚石和金刚砂均为共价晶体,原子半径越小,键长越小,化学键越强,熔点越高,键长C—C<Si—C,化学键的强弱C—C>Si—C,金刚石的熔点高于金刚砂,共价晶体的熔点比分子晶体熔点高,冰中水分子间存在氢键,使得熔点升高,使得冰的熔点大于CO2,因此金刚石、金刚砂、冰、干冰晶体的熔点依次降低,③正确;石墨晶体中,C原子形成3个C—C,而1个C—C由2个C构成,则碳原子数和C—C个数比为2∶3,④错误;Al2O3晶体中离子键成分百分数较小,可以当作共价晶体处理,⑤正确;石墨晶体中除含有的C—C为σ键外,还含有π键,⑥错误;只有3项是正确的,答案选C。
,其最小环中有12个原子,①错误;晶体只要有阴离子就一定有阳离子,②正确;金刚砂为SiC,金刚石和金刚砂均为共价晶体,原子半径越小,键长越小,化学键越强,熔点越高,键长C—C<Si—C,化学键的强弱C—C>Si—C,金刚石的熔点高于金刚砂,共价晶体的熔点比分子晶体熔点高,冰中水分子间存在氢键,使得熔点升高,使得冰的熔点大于CO2,因此金刚石、金刚砂、冰、干冰晶体的熔点依次降低,③正确;石墨晶体中,C原子形成3个C—C,而1个C—C由2个C构成,则碳原子数和C—C个数比为2∶3,④错误;Al2O3晶体中离子键成分百分数较小,可以当作共价晶体处理,⑤正确;石墨晶体中除含有的C—C为σ键外,还含有π键,⑥错误;只有3项是正确的,答案选C。
答案:C
3.(2022·云南大姚县第一中学月考)某立方晶系的锑钾(Sb-K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构图,图b表示晶胞的一部分。下列说法正确的是( )
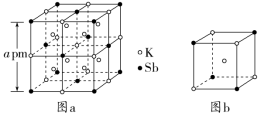
A.该晶胞的体积为a3×10-36 cm3
B.K和Sb原子数之比为3∶1
C.与Sb最邻近的K原子数为4
D.K和Sb之间的最短距离为a pm
解析:该晶胞的边长为a×10-10 cm,故晶胞的体积为(a×10-10 cm)3=a3×10-30 cm3,A项错误;该晶胞中K的个数为12×+1+8=12,Sb的个数为8×+6×=4,故K和Sb原子数之比为3∶1,B项正确;以面心处Sb为研究对象,与Sb最邻近的K原子数为8,C项错误;K和Sb的最短距离为晶胞体对角线长度的,即a pm,D项错误。
答案:B
4.(2022·洪湖一中月考)金属晶体和离子晶体是重要晶体类型。下列关于它们的说法正确的是( )
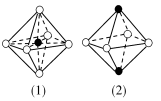
A.金属晶体中只有金属单质
B.在镁晶体中,1个Mg2+只与2个价电子存在强烈的相互作用
C.图中的(1)和(4)可以是从NaCl晶体结构中分割出来的部分结构图
D.金属晶体和离子晶体分别存在金属键和离子键等相互作用,很难断裂,因而都具有延展性
解析:金属晶体中含有金属阳离子和自由电子,A项错误;金属晶体中的电子属于整个晶体,B项错误;由于在NaCl晶体中,每个Na+周围同时吸引着最近的等距离的6个Cl-,同样每个Cl-周围同时吸引着最近的等距离的6个Na+,题图(1)符合条件,题图(4)中选取其中一个离子,然后沿X、Y、Z三轴切割得到6个等距离的且最近的带相反电荷的离子,所以其配位数也是6,题图(4)符合条件,C项正确;离子晶体没有延展性,易断裂,D项错误。
答案:C
5.(2022·阜新第二高级中学月考)硅酸盐与二氧化硅一样,都以硅氧四面体作为基本结构单元。硅氧四面体可以表示成![]() ,其中
,其中![]() 表示氧原子,
表示氧原子,![]() 表示硅原子。硅氧四面体通过不同方式的连接可以组成不同的多聚硅酸根离子。如图所示为某无限长单链的多聚硅酸根离子的结构,试确定该阴离子中硅原子与氧原子的个数之比为( )
表示硅原子。硅氧四面体通过不同方式的连接可以组成不同的多聚硅酸根离子。如图所示为某无限长单链的多聚硅酸根离子的结构,试确定该阴离子中硅原子与氧原子的个数之比为( )
A.1∶2 B.1∶3
C.1∶4 D.2∶5
解析:由无限长单链的多聚硅酸根离子的结构图可知,重复结构单元为![]() ,空心球表示氧原子,中心黑点表示硅原子,则结构单元中硅原子个数为1,氧原子个数为2+2×=3,所以该阴离子中硅原子与氧原子的个数之比为1∶3。
,空心球表示氧原子,中心黑点表示硅原子,则结构单元中硅原子个数为1,氧原子个数为2+2×=3,所以该阴离子中硅原子与氧原子的个数之比为1∶3。
答案:B
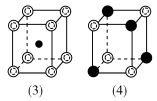
6.(2022·荆沙中学月考)铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(白球代表Fe,黑球代表Mg)。储氢时,H2分子在晶胞的体心和棱的中心位置,且最近的两个氢分子之间的距离为a nm,NA表示阿伏加德罗常数的值。已知A点的原子坐标参数为(0,0,0),B点为(,,0)。则下列说法正确的是( )
A.晶胞中Fe与Mg的配位数均为4
B.位置C点的原子坐标参数为(,,)
C.Mg与Fe之间的最近距离为a nm
D.储氢后的晶体密度为 g·cm-3
解析:根据题中晶胞结构示意图可知,距离Mg原子最近且相等的Fe原子有4个,即Mg原子的配位数为4,距离Fe原子最近且相等的Mg原子有8个,故Fe的配位数为8,A项错误;根据题中所给信息,可以推测得知,位置C点的原子坐标参数为(,,),B项错误;氢气分子在晶胞的体心和棱的中心位置,且最近的两个氢分子之间的距离为a nm,该晶胞参数为a nm,Mg和Fe之间的最近距离为体对角线的,则Mg与Fe之间的最近距离为a nm,C项正确;氢气分子在晶胞的体心和棱的中心位置,个数为1+12×=4,Fe原子的个数为4,Mg位于体内,Mg的个数为8,储氢后的晶体化学式为FeMg2H2,根据ρ=,储氢后的晶体密度为 g·cm-3,D项错误。
答案:C
7.(2022·枣庄八中月考)GaAs晶体被业内称为“半导体贵族”,它的熔点很高,硬度很大,其原子间以共价键(配位键)相连,密度为ρ g·cm-3,Ga和As的摩尔质量分别为M(Ga) g·
mol-1和M(As) g·mol-1,原子半径分别为r(Ga) pm和r(As) pm,阿伏加德罗常数值为NA,其晶胞结构如图所示。下列说法错误的是( )
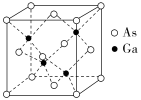
A.该晶体为共价晶体
B.在该晶体中Ga和As的配位数均为4
C.所有原子均满足8电子稳定结构
D.原子的体积占晶胞体积的百分率为4π××100%
解析:GaAs晶体的熔点很高,硬度很大,该晶体为共价晶体,故A项正确;晶胞中Ga原子数目=4,As原子数目=8×+6×=4,在该晶体中Ga和As的配位数均为4,故B项正确;每个Ga、As都形成4个共价键,均没有孤电子对,所有原子均满足8电子稳定结构,故C项正确;晶胞中原子总体积=4×π[r3(Ga)+r3(As)]×10-30 cm3,晶胞质量=4×g,晶胞体积=[4×g]÷ρ g·cm-3,原子的体积占晶胞体积的百分率为{4×π·[r3(Ga)+r3(As)]×10-30 cm3}÷[(4× g)÷ρ g·cm-3]×100%=×10-30×100%,故D项错误。
答案:D
8.(2022·岳阳中学月考)下列说法不正确的是( )
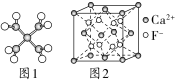
A.四水合铜离子的模型如图1所示,1个四水合铜离子中有4个配位键
B.CaF2晶体的晶胞如图2所示,设Ca2+、F-半径分别为r1和r2,晶胞边长为a,则有a=4(r1+r2)
C.H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动
D.金属Cu的原子堆积模型如图4所示,为最密堆积,Cu原子的配位数为12
解析:由题图可以看出,1个铜离子与4个水分子结合成[Cu(H2O)4]2+,Cu2+与H2O分子之间通过配位键相结合,则1个水合铜离子中有4个配位键,A项正确;CaF2晶体为六方最密堆积,设Ca2+、F-半径分别为r1和r2,晶胞边长为a,晶胞体对角线上有2个F-和3个Ca2+,其中2个Ca2+在顶点有一部分属于另一个晶胞,那么属于体对角线的就有4个F-半径和4个Ca2+半径,则有a=4(r1+r2),B项正确;H原子核外只有1个电子,所以电子云图中,黑点不表示电子,只表示电子出现的机会多少,H原子核外电子大多在原子核附近运动,C项不正确;金属Cu原子形成的金属晶体为最密堆积,每个Cu原子周围同一层有6个Cu原子,上、下层各有3个Cu原子,所以其配位数均为12,D项正确。
答案:C
9.(2022·湘潭模拟)氧化锌常作为金属缓蚀剂,其结构有很多种,其中一种立方晶胞结构如图,晶胞边长为a pm,下列说法错误的是( )
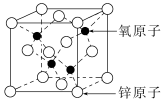
A.该晶体属于离子晶体
B.O原子与O原子的最短距离为a pm
C.Zn原子周围等距离且最近的Zn原子数为6
D.该晶胞中含有4个O原子,4个Zn原子
解析:氧化锌晶体属于离子晶体,A项正确;O原子与O原子的最短距离为面对角线的一半,即a pm,B项正确;由题中晶胞示意图,取顶点Zn原子来看,其周围等距且最近的Zn原子为面心上的Zn原子,故Zn原子周围等距离且最近的Zn原子数为12,C项错误;由题图可知,该晶胞含4个O原子(晶胞内),Zn原子位于晶胞的顶点和面心上,故Zn原子数为8×+6×=4,D项正确。
答案:C
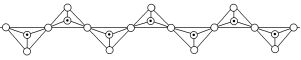
10.(2022·任丘第一中学月考)将石墨置于熔融的钾或气态钾中,石墨吸收钾形成名称为钾石墨的物质,其组成可以是C8K、C12K、C24K、C36K、C48K、C60K等。下列分析正确的是( )
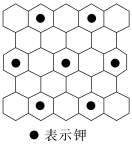
A.题干中所列举的6种钾石墨属于有机高分子
B.钾石墨中碳原子的杂化方式是sp3杂化
C.若某钾石墨的原子分布如图所示,则它所表示的是C12K
D.最近两个K原子之间距离为石墨中C—C键长的2倍
解析:题干中列举的6种物质是石墨吸收钾形成的,不属于有机物,而是无机化合物,A项错误;钾石墨是石墨吸收钾形成的化合物,其中的碳原子形成了键角约为120°的三条共价键,因此采用的是sp2杂化,B项错误;由该种钾石墨的结构可知,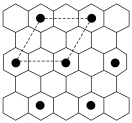 可选择图中虚线框选的部分作为该钾石墨的晶胞,碳原子位于晶胞的内部共有8个,钾原子位于晶胞的4个顶点上,因此均摊法计算该钾石墨的化学式为C8K,C项错误;由该种钾石墨的结构可知,钾原子排列在每个六边形单元格中心位置,并且间隔1个六边形单元格填充,因此钾原子之间的最短距离等于相邻的2个六边形单元格中心连线的长度的2倍,即C—C键长的2倍,D项正确。
可选择图中虚线框选的部分作为该钾石墨的晶胞,碳原子位于晶胞的内部共有8个,钾原子位于晶胞的4个顶点上,因此均摊法计算该钾石墨的化学式为C8K,C项错误;由该种钾石墨的结构可知,钾原子排列在每个六边形单元格中心位置,并且间隔1个六边形单元格填充,因此钾原子之间的最短距离等于相邻的2个六边形单元格中心连线的长度的2倍,即C—C键长的2倍,D项正确。
答案:D
二、非选择题
11.(2022·龙岩第一次模拟)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并随着环的大小不同而与不同金属离子作用。
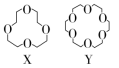
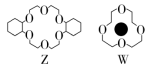
(1)Li+的体积与X的空腔大小相近,恰好能进入X的环内,且Li+与氧原子的一个孤电子对作用形成稳定结构W(如图)。
①基态锂离子核外能量最高的电子所处能层符号为________________。
②W中Li+与孤电子对之间的作用属于________(填字母)。
A.离子键 B.配位键
C.氢键 D.以上都不是
(2)冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构,理由是____________
________________________________________________________________________。
(3)烯烃难溶于水,被KMnO4水溶液氧化的效果较差。若烯烃中溶入冠醚Z,氧化效果明显提升。
①水分子中键角________(填“>”“<”或“=”)109°28′。
②已知:冠醚Z与KMnO4可以发生如图所示的转化。加入冠醚Z后,烯烃的氧化效果明显提升的原因是_____________________________________________________________
________________________________________________________________________。
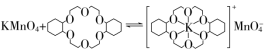
解析:(1)①基态锂离子核外只有1s能级上有电子,为K层上的电子,所以其能层符号为K。②Li+提供空轨道、O原子提供孤电子对,二者形成配位键。(2)冠醚Y的空腔较大,Li+的体积较小,导致该离子不易与氧原子上的孤电子对形成配位键,所以得不到稳定结构。(3)①水分子中氧原子的价层电子对数是4,根据价层电子对互斥模型判断水分子的价层电子对空间结构为四面体。由于水分子中O原子上含有2个孤电子对,孤电子对之间的排斥力较强,导致水分子中键角小于109°28′。②根据“相似相溶”的规律可知,冠醚Z可溶解烯烃,加入冠醚Z中的K+因静电作用将MnO带入烯烃中,增大反应物的接触面积,提高氧化效果。
答案:(1)①K ②B
(2)Li+的体积比Y的空腔小很多,不易与空腔内O原子上的孤电子对作用形成稳定结构
(3)①< ②冠醚Z可溶解烯烃,加入冠醚Z中的K+因静电作用将MnO带入烯烃中,增大反应物的接触面积,提高氧化效果
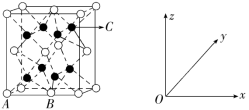
12.(2022·漯河高级实验中学月考)M、N、A、B、D、E均为原子序数依次递增的前四周期元素,M原子内的电子只有一种运动状态,N原子的双原子分子内的键能在同周期非金属元素的单质中最大,A与B同主族,且A元素的原子序数是B元素原子序数的,D属于第ⅡB的元素,E元素原子的4p轨道上有3个未成对电子。
(1)A原子核外电子能量最高的能层的符号是________,D原子价电子的排布式为__________。
(2)设计实验,比较A元素与B元素非金属活泼性:____________________________
________________________________________________________________________。
(3)NM3的键角________(填“>”“<”或“=”)EM3的键角,NM3的沸点______(填“高于”“低于”或“等于”)EM3的沸点。
(4)与E同周期的主族元素中,第一电离能最大的是________(填元素名称)。A和E形成分子的结构如图所示,该分子的分子式为____________,E原子的杂化类型为__________。
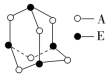
(5)与BA2分子的中心原子价电子对几何构型不同但分子构型相同的是________(填字母)。
A.BeCl2 B.PH3
C.H2O D.OF2
(6)金属D晶体中的原子堆积方式如图所示,这种堆积方式称为________,D原子的配位数为________,六棱柱高为c cm,底边边长为a cm,阿伏加德罗常数的值为NA,D晶体的密度为_____________________________________________________g·cm-3(列出计算式)。
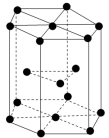
解析:前四周期元素,由M原子内的电子只有一种运动状态知M为H(氢);由N原子的双原子分子内的键能在同周期非金属元素的单质中最大知N为氮;由A与B同主族,且A元素的原子序数是B元素原子序数的知A为氧,B为硫;由D属于第ⅡB的元素,且是第四周期知D是锌;由E元素原子的4p轨道上有3个未成对电子知E是As(砷)。(1)A为O原子,电子排布式是1s22s22p4,所以能量最高的能层的符号是2p,D原子电子的排布式为1s22s22p63s23p63d104s2,价电子的排布式为3d104s2。(2)设计实验比较O与S的非金属性,可利用气态氢化物的稳定性,H2O在通电条件下分解,H2S加热下分解,可说明非金属性:O>S。(3)因为氮的电负性强于砷的,所以键角:NH3>AsH3,因为氨中存在氢键,所以沸点:NH3>AsH3。(4)同周期的主族元素中从左到右第一电离能逐渐增大,所以第一电离能最大的是溴,根据O和As形成的分子结构可知化合物的分子式为As2O3,As原子形成了3个共价键,且有一对孤电子对,所以原子的杂化类型为sp3。(5)SO2分子的中心原子价电子对为2+(6-2×2)=2+1=3,几何构型为平面三角形,但分子构型为V形。A项,BeCl2分子的中心原子价电子对为2+(4-2×1)=2+1=3,几何构型为平面三角形,但分子构型为V形。B项,PH3分子的中心原子价电子对为3+(5-3×1)=3+1=4,几何构型为正四面体形,但分子构型为三角锥形。C项,H2O分子的中心原子价电子对为2+(6-2×1)=2+2=4,几何构型为正四面体形,但分子构型为V形。D项,OF2分子的中心原子价电子对为2+(6-2×1)=2+2=4,几何构型为正四面体形,但分子构型为V形。故与SO2分子的中心原子价电子对几何构型不同但分子构型相同的是CD。(6)由题中金属锌晶体中的原子堆积方式图示可知,堆积方式称为立方最密堆积,配位数为12,图中结构单元中Zn原子数目为3+12×+2×=6,结构单元中Zn的总质量为6× g,晶体密度为(6× g)÷(3×a cm×a cm×sin 60°×c cm)= g·cm-3。
答案:(1)2p 3d104s2 (2)可利用气态氢化物的稳定性,H2O在通电条件下分解,H2S加热下分解,可说明非金属性:O>S (3)> 高于 (4)溴 As2O3 sp3 (5)CD (6)立方最密堆积 12
13.(2022·玉田县第一中学期末)2019年是国际纯粹与应用化学联合会(IUPAC)成立一百周年,也是元素周期表诞生150周年,IUPAC等从世界范围征集优秀青年化学家提名,形成一张“青年化学家元素周期表”,向世界介绍118位优秀青年化学家,有8位中国青年化学家成为“N、Hg、U”等元素的代言人。回答下列问题:
(1)Fe3+基态核外电子排布式为_______________________________________________。
(2)加碘食盐中含有KIO3,其立体结构如图,边长为a=0.446 nm,晶胞中K、I、O分别处于顶角、体心、面心位置。K与O间的最短距离为________nm,与K紧邻的I个数为__________。
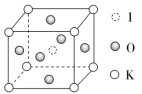
(3)下列有关性质的比较,能用元素周期律解释的是______________(填字母)。
a.酸性:HCl>H2SO3
b.非金属性:O>S
c.碱性:NaOH>Mg(OH)2
d.热稳定性:Na2CO3>NaHCO3
(4)2020年新冠肺炎疫情席卷全球,酒精(CH3CH2OH)成为家庭必备品,乙醇分子中碳原子轨道的杂化类型是______,1 mol乙醇分子中含有σ键的数目为__________________________。
(5)可用原子坐标参数表示晶胞内各原子的相对位置。如图所示的晶胞中,原子坐标参数A为(0,0,0);B为(,,);C为(0,1,1)。则D原子的坐标参数为________________。
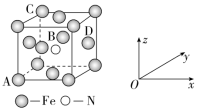
解析:(1)铁元素的原子序数为26,铁原子失去3个电子变成Fe3+,基态离子核外电子排布式为1s22s22p63s23p63d5或[Ar]3d5。(2)由题中晶胞结构可知,K与O之间的最短距离是面对角线的一半,由边长为a=0.446 nm可得K与O之间的最短距离为×0.446 nm=0.315 nm;K位于晶胞的顶点,I位于晶胞的体心,则与K紧邻的I个数为8。(3)a.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,非金属性:Cl>S,则酸性:HClO4>H2SO4,而酸性:HCl>H2SO3无法用元素周期律解释,故错误;b.同主族元素从上到下非金属性依次减弱,则非金属性:O>S,能用元素周期律解释,故正确;c.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,金属性:Na>Mg,则碱性:NaOH>Mg(OH)2,能用元素周期律解释,故正确;d.酸式碳酸盐易分解,碳酸盐难分解,则热稳定性:Na2CO3>NaHCO3,热稳定性与元素周期律无关,不能用元素周期律解释,故错误。(4)乙醇分子中的碳原子均为饱和碳原子,碳原子的杂化方式为sp3杂化;由乙醇的结构简式为CH3CH2OH可知,分子中含有8个σ键,则1 mol乙醇分子中含有σ键的数目为8NA或4.816×1024。(5)由题图所示的晶胞中,原子坐标参数A为(0,0,0)、B为(,,)、C为(0,1,1)可知,以A为参照,晶胞边长为1,由晶胞结构可知,D位于晶胞右侧的面心上,则D原子的坐标参数为(1,,)。
答案:(1)[Ar]3d5(或1s22s22p63s23p63d5) (2)0.315 8 (3)bc (4)sp3 8NA(或4.816×1024) (5)(1,,)
2024届高考化学一轮总复习课时跟踪练30烃: 这是一份2024届高考化学一轮总复习课时跟踪练30烃,共11页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2024届高考化学一轮总复习课时跟踪练18晶体结构与性质: 这是一份2024届高考化学一轮总复习课时跟踪练18晶体结构与性质,共11页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2024届高考化学一轮总复习课时跟踪练16化学键: 这是一份2024届高考化学一轮总复习课时跟踪练16化学键,共9页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












