化学九年级上册课题4 化学式与化合价精品第2课时教案
展开课题4 化学式与化合价
课时2
一、教学目标
1.理解化合价的本质,掌握化合价的一些规律;
2.了解化合价与离子符号表示方法的不同。
3.根据物质的化学式,会判断某元素的化合价;
4.熟记一些常见元素和根的化合价,并学会根据化合价推求化学式的方法。
二、教学重难点
重点:记住常见元素和原子团的化合价,会利用化合价书写化学式,会根据化学式判断某元素的化合价。
难点:化合价含义的理解、应用和记忆。
三、教学准备
教师准备:多媒体课件
四、教学过程
教学环节
教师活动
学生活动
设计意图
环节一
创设情境
引入新课
【导入】在十九世纪初英国科学家道尔顿提出了原子理论。为了说明该理论,科学家们提出了原子价,也就是现在所说的化合价。
同生在一个时期的阿仑尼乌斯在提出电离理论之后,认为原子价有正负之分,也就是构成化合物的各原子的原子价的代数和为0。按照现代化学的观点,即:化合价分为正价和负价。
那么,化合价究竟是什么?今天我们就一起来学习化合价的相关内容。
倾听,思考
通过介绍化合价的发展史来激发学生的学习兴趣。
环节二
新课讲解
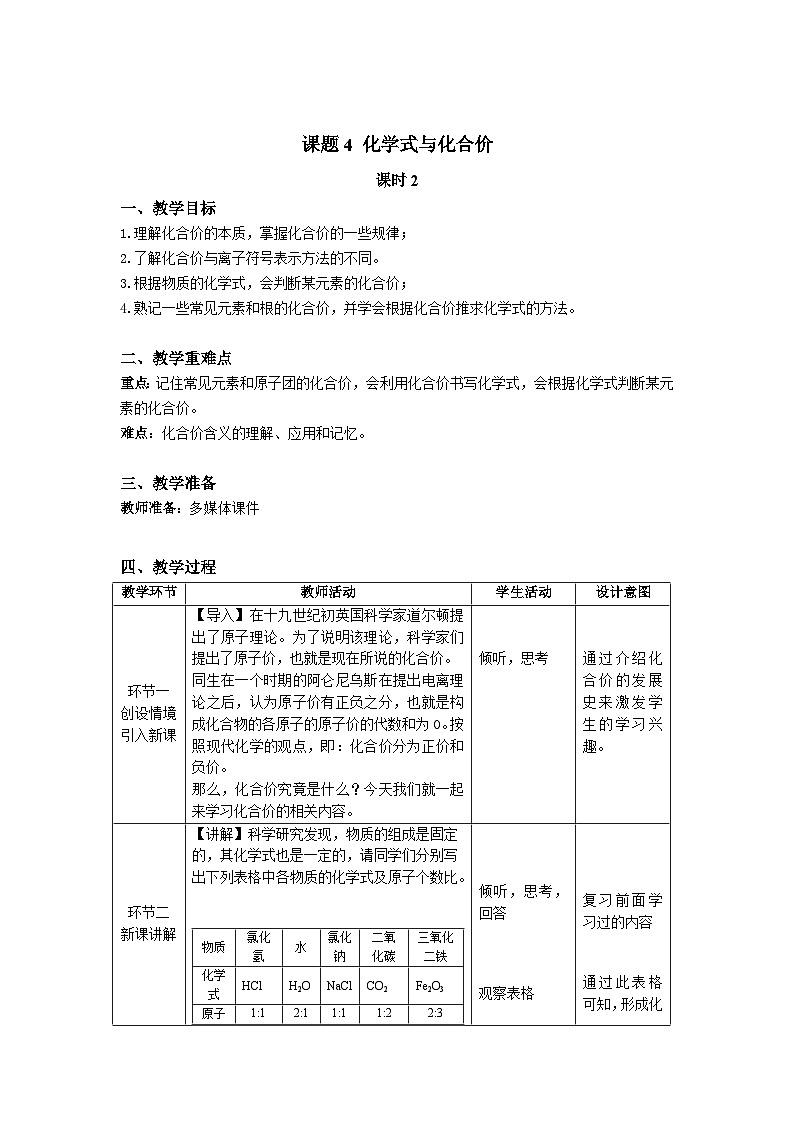
【讲解】科学研究发现,物质的组成是固定的,其化学式也是一定的,请同学们分别写出下列表格中各物质的化学式及原子个数比。
物质
氯化氢
水
氯化钠
二氧化碳
三氧化二铁
化学式
HCl
H2O
NaCl
CO2
Fe2O3
原子个数比
1:1
2:1
1:1
1:2
2:3
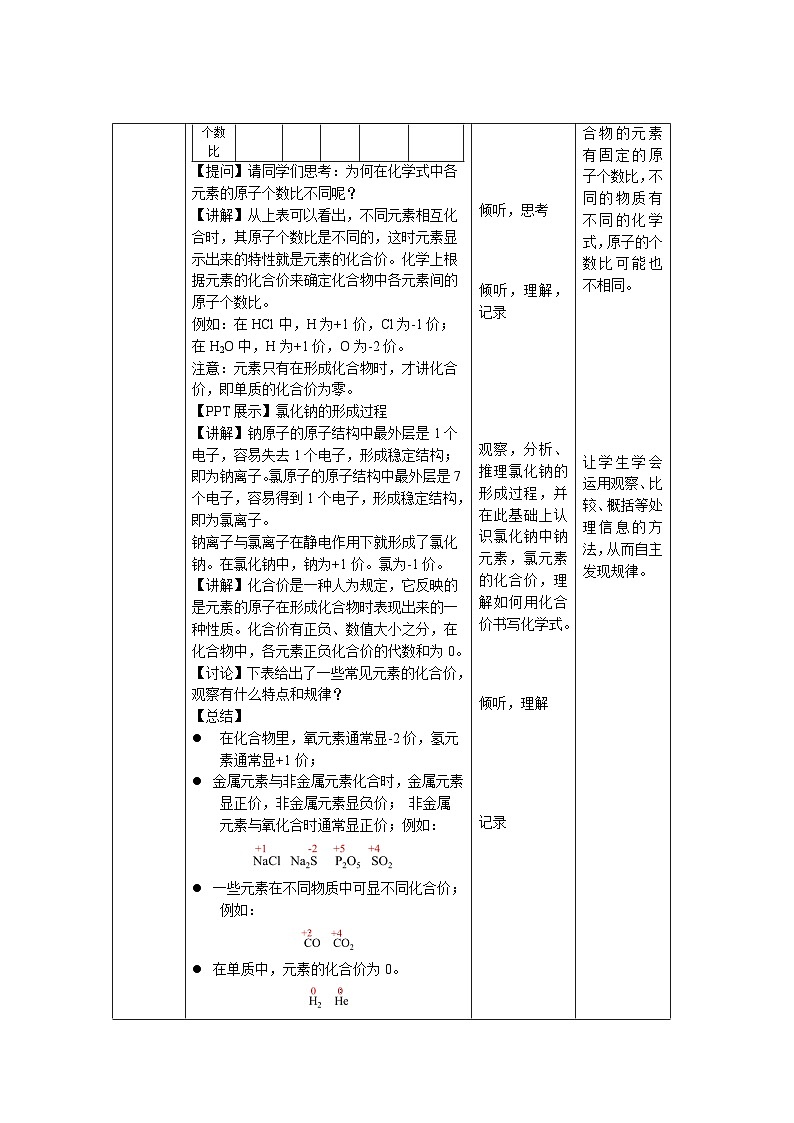
【提问】请同学们思考:为何在化学式中各元素的原子个数比不同呢?
【讲解】从上表可以看出,不同元素相互化合时,其原子个数比是不同的,这时元素显示出来的特性就是元素的化合价。化学上根据元素的化合价来确定化合物中各元素间的原子个数比。
例如:在HCl中,H为+1价,Cl为-1价;在H2O中,H为+1价,O为-2价。
注意:元素只有在形成化合物时,才讲化合价,即单质的化合价为零。
【PPT展示】氯化钠的形成过程
【讲解】钠原子的原子结构中最外层是1个电子,容易失去1个电子,形成稳定结构;即为钠离子。氯原子的原子结构中最外层是7个电子,容易得到1个电子,形成稳定结构,即为氯离子。
钠离子与氯离子在静电作用下就形成了氯化钠。在氯化钠中,钠为+1价。氯为-1价。
【讲解】化合价是一种人为规定,它反映的是元素的原子在形成化合物时表现出来的一种性质。化合价有正负、数值大小之分,在化合物中,各元素正负化合价的代数和为0。
【讨论】下表给出了一些常见元素的化合价,观察有什么特点和规律?
【总结】
l 在化合物里,氧元素通常显-2价,氢元素通常显+1价;
l 金属元素与非金属元素化合时,金属元素显正价,非金属元素显负价; 非金属元素与氧化合时通常显正价;例如:
l 一些元素在不同物质中可显不同化合价;例如:
l 在单质中,元素的化合价为0。
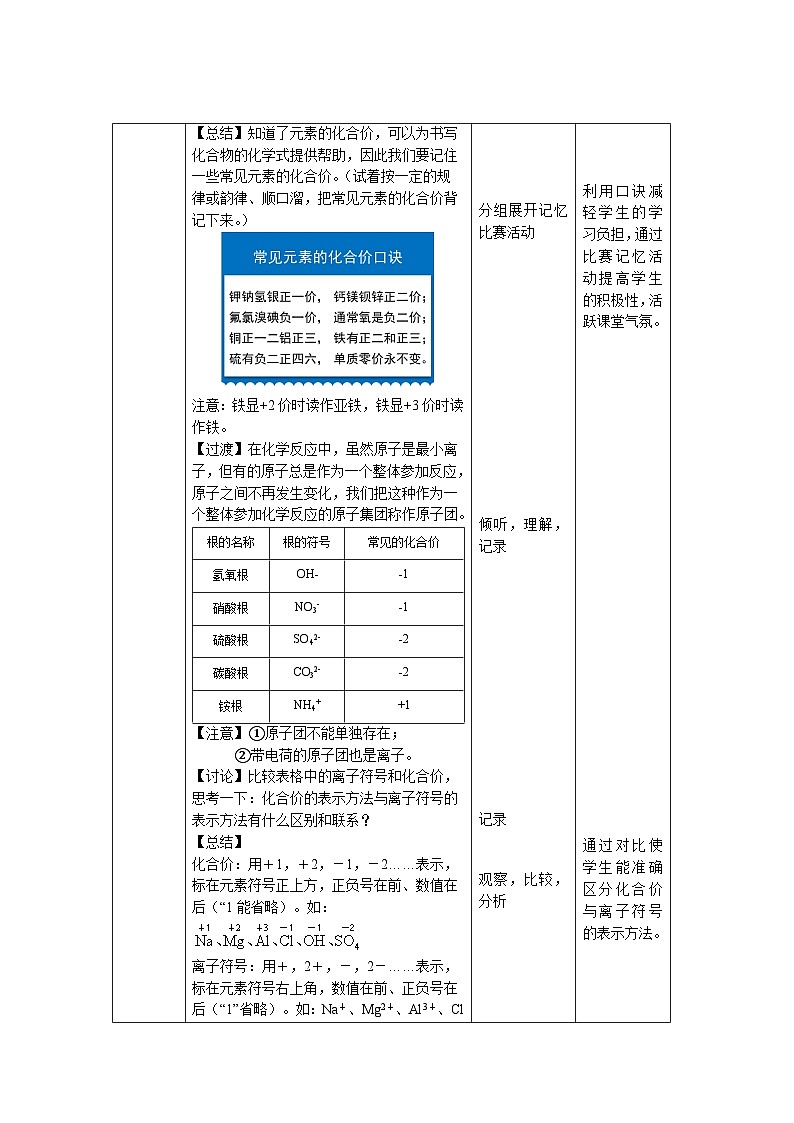
【总结】知道了元素的化合价,可以为书写化合物的化学式提供帮助,因此我们要记住一些常见元素的化合价。(试着按一定的规律或韵律、顺口溜,把常见元素的化合价背记下来。)
注意:铁显+2价时读作亚铁,铁显+3价时读作铁。
【过渡】在化学反应中,虽然原子是最小离子,但有的原子总是作为一个整体参加反应,原子之间不再发生变化,我们把这种作为一个整体参加化学反应的原子集团称作原子团。
根的名称
根的符号
常见的化合价
氢氧根
OH-
-1
硝酸根
NO3-
-1
硫酸根
SO42-
-2
碳酸根
CO32-
-2
铵根
NH4+
+1
【注意】①原子团不能单独存在;
②带电荷的原子团也是离子。
【讨论】比较表格中的离子符号和化合价,思考一下:化合价的表示方法与离子符号的表示方法有什么区别和联系?
【总结】
化合价:用+1,+2,-1,-2……表示,标在元素符号正上方,正负号在前、数值在后(“1能省略)。如:
离子符号:用+,2+,-,2-……表示,标在元素符号右上角,数值在前、正负号在后(“1”省略)。如:Na+、Mg2+、Al3+、Cl-、OH-、SO42-
联系:一般情况下,同种元素(或原子团)的化合价与其离子符号数值大小相等、正负号相同;先后顺序相反。
【总结】常见根的化合价口诀
【过渡】知道了元素的化合价,可以确定实际存在的化合物中各元素原子的个数比,从而写出化合物的化学式;
【讲解】书写化学式的步骤总共有3步:
步骤一:根据物质物质名称确定元素种类和位置;
步骤二:标上相应元素的化合价;
步骤三:根据化合价确定右下角数字。
例如:氧化铝
第一步:根据物质物质名称确定元素种类和位置为:
第二步:标上相应元素的化合价:
第三步:根据化合价确定右下角数字。
即氧化铝的化学式为:,此法即为十字交叉法。
【提问】请同学根据上述步骤书写以下物质的化学式:氯化钙、硫酸铝、氢氧化钙
【总结】
【讲解】同学们书写过程中会发现与氧化铝书写不同的是,本道题中所给的物质中有原子团的存在。而当原子团个数不为“1”时,需要给原子团加上括号,并将原子团个数写在括号的右下角。
【过渡】学习完了根据化合价书写化学式。
我们再来巩固下化学式的书写。
【练习】应用一:根据化合价写化学式
应用二:铁的化学式的写法和读法
判断下列化学式的名称是否正确。
写出下列物质的化学式或物质名称。
应用三:根据化学式求化合价
求下列化学式中氮元素的化合价。
应用四:求原子团中元素的化合价
分别计算下列C、N、S元素的化合价。
倾听,思考,回答
观察表格
倾听,思考
倾听,理解,记录
观察,分析、推理氯化钠的形成过程,并在此基础上认识氯化钠中钠元素,氯元素的化合价,理解如何用化合价书写化学式。
倾听,理解
记录
分组展开记忆比赛活动
倾听,理解,记录
记录
观察,比较,分析
倾听,理解,记录
分组展开记忆
倾听,理解,记录
练习书写化学式
练习,回答
分析,回答
练习
理解,记录
练习
理解,记录
复习前面学习过的内容
通过此表格可知,形成化合物的元素有固定的原子个数比,不同的物质有不同的化学式,原子的个数比可能也不相同。
让学生学会运用观察、比较、概括等处理信息的方法,从而自主发现规律。
利用口诀减轻学生的学习负担,通过比赛记忆活动提高学生的积极性,活跃课堂气氛。
通过对比使学生能准确区分化合价与离子符号的表示方法。
利用口诀减轻学生的学习负担,提高学生的积极性,活跃课堂气氛。
理论联系实际能让大部分学生掌握如何通过化合价来书写化学式。
通过设置陷阱,使得学生体会化学式书写中的注意事项,加强对化合价的运用。
讲练结合以达到能熟练运用化合价解决问题,培养学生运用所学知识解决问题的能力。
环节三拓展延伸
【播放】氯化钠的形成的视频介绍
观看
化抽象具体,让学生了解物质的形成。
随堂作业
PPT展示
做题
通过习题巩固本节所学知识
环节四
课堂小结
展示PPT21页。
倾听并理解。
帮助学生梳理本节知识,便于学生记忆。
五、板书设计
课题4 化学式与化合价
课时2
1.化合价
2.常见元素和根的化合价
3.化合价与离子符号表示方法的区别
4.化合价的应用
人教版九年级上册课题4 化学式与化合价获奖第3课时教学设计: 这是一份人教版九年级上册课题4 化学式与化合价获奖第3课时教学设计,共5页。教案主要包含了教学目标,教学重难点,教学准备,教学过程,板书设计等内容,欢迎下载使用。
人教版九年级上册课题4 化学式与化合价精品第1课时教学设计: 这是一份人教版九年级上册课题4 化学式与化合价精品第1课时教学设计,共5页。教案主要包含了教学目标,教学重难点,教学准备,教学过程,板书设计等内容,欢迎下载使用。
初中化学人教版九年级上册第四单元 自然界的水课题4 化学式与化合价第3课时教案及反思: 这是一份初中化学人教版九年级上册第四单元 自然界的水课题4 化学式与化合价第3课时教案及反思,共5页。教案主要包含了教学目标,教学重难点,教学准备,教学过程,板书设计等内容,欢迎下载使用。













