






所属成套资源:2023高考化学二轮专题复习与测课件(16份)
2023高考化学二轮专题复习与测试第二部分题型解读六物质结构与性质题型突破课件
展开这是一份2023高考化学二轮专题复习与测试第二部分题型解读六物质结构与性质题型突破课件,共35页。PPT课件主要包含了续上表等内容,欢迎下载使用。
题型解读六 物质结构与性质题型突破
【题型分析】 纵观近几年各地新课改高考试题,稳定加创新是本专题的基本特点,命题采取结合新科技,新能源等社会热点为背景,命题的形式没有太大的变化,原子的结构与性质、分子的结构与性质和晶体的结构与性质是命题的三大要点。从题目情况来看,给出一定的知识背景,然后设置成3~4个小题,每个小题考查一个知识要点是主要的命题模式。从题型分析主要以填空命题、内容可考查基本概念,如电子排布式、轨道式、电离能、电负性、杂化方式以及空间构型等,也可联系有机化学基础知识考查有机物中C原子的杂化,联系数学几何知识考查晶体的计算等。本专题的压轴考点是利用均摊法考查晶胞中的原子个数,或者考查晶体的化学式的书写、晶体类型的判断等。
(2022·全国乙卷)卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:(1)氟原子激发态的电子排布式有________,其中能量较高的是________。(均填字母)a.1s22s22p43s1 b.1s22s22p43d2c.1s22s12p2 d.1s22s22p33p2
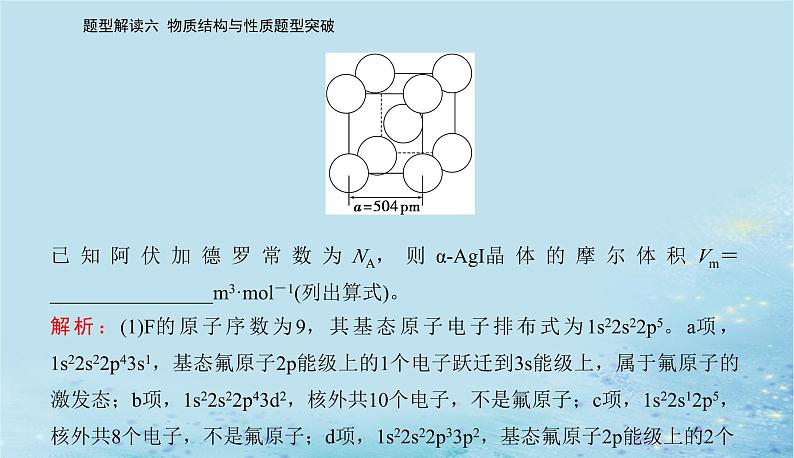
②一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C—Cl键长的顺序是____________________________,理由:(ⅰ)C的杂化轨道中s成分越多,形成的C—Cl越强;(ⅱ)__________________________________________________________________________________________________。(3)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为________。解释X的熔点比Y高的原因:________________________________________________________________________________________。(4)αAgI晶体中I-离子作体心立方堆积(如图所示),Ag+主要分布在由I-构成的四面体、八面体等空隙中。在电场作用下,Ag+不需要克服太大的阻力即可发生迁移。因此,αAgI晶体在电池中可作为________。
已知阿伏加德罗常数为NA,则αAgI晶体的摩尔体积Vm=________________m3·ml-1(列出算式)。
解析:(1)F的原子序数为9,其基态原子电子排布式为1s22s22p5。a项,1s22s22p43s1,基态氟原子2p能级上的1个电子跃迁到3s能级上,属于氟原子的激发态;b项,1s22s22p43d2,核外共10个电子,不是氟原子;c项,1s22s12p5,核外共8个电子,不是氟原子;d项,1s22s22p33p2,基态氟原子2p能级上的2个
(2022·广东卷)硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如下:
(1)Se与S同族,基态硒原子价电子排布式为________。(2)H2Se的沸点低于H2O,其原因是___________________________________________________________________________________________________。(3)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有________(填字母)。A.Ⅰ中仅有σ键B.Ⅰ中的Se—Se为非极性共价键C.Ⅱ易溶于水D.Ⅱ中原子的杂化轨道类型只有sp与sp2E.Ⅰ~Ⅲ含有的元素中,O电负性最大(4)Ⅳ中具有孤电子对的原子有________。
①X的化学式为________。②设X的最简式的式量为Mr,晶体密度为ρ g·cm-3,则X中相邻K之间的最短距离为____________nm(列出计算式,NA为阿伏加德罗常数的值)。
解析:(1)基态硫原子价电子排布式为3s23p4,Se与S同族,Se为第四周期元素,因此基态硒原子价电子排布式为4s24p4。(2)H2Se的沸点低于H2O,其原因是两者都是分子晶体,由于水存在分子间氢键,沸点高。(3)Ⅰ中有σ键,还有大π键,故A项错误;Se—Se是同种元素,因此Ⅰ中的Se—Se为非极性共价键,故B项正确;烃都是难溶于水,因此Ⅱ难溶于水,故C项错误;Ⅱ中苯环上的碳原子和碳碳双键上的碳原子杂化类型为sp2,碳碳三键上的碳原子杂化类型为sp,故D项正确;根据同周期从左到右电负性逐渐增大,同主族从上到下电负
1.物质结构与性质题目中的各种表达式(1)原子、离子核外电子排布式和价电子排布式、排布图。(2)离子、分子的等电子体等。【方法提炼】①提高审题能力,圈画出题干中的关键词语,一定要看清楚题干的要求。②回归教材,熟记第四周期元素在周期表中的信息,熟悉常考化学用语的定义。2.化学键的类型(1)大多数的盐、碱、活泼金属氧化物都有离子键。(2)共价键是原子之间通过共用电子对所形成的相互作用。共价键可分为极性共价键和非极性共价键。非极性键存在于同种原子之间(如H2的H—H键)。
(3)金属键:使金属原子形成金属晶体的化学键,主要存在于金属中。(4)化学键的分类与判断。出现频率较高的:σ键、π键、极性键、非极性键、配位键、键参数。(5)杂化轨道、分子和离子的空间构型、分子间作用力、分子的极性的判断。一些常见的分子立体构型及其分子极性(见下表)。
(6)运用氢键解释一些物理性质。①由于分子间存在氢键,除了要克服纯粹的分子间力外,还必须提高温度,获得额外的能量来破坏分子间氢键,所以这些物质的熔、沸点比同系列氢化物的熔、沸点高。
②在极性溶剂中,若溶质分子与溶剂分子之间可以形成氢键,则溶质的溶解度增大。例如,HF和NH3在水中的溶解度比较大,就是这个缘故。(7)晶体类型和晶体常识的判断:晶体与其他团体的区分方法:X衍射射线法。【方法提炼】①熟记成键原理,突破价层电子对数与杂化轨道,价层电子对数与分子、离子的立体构型。②注意审题细节。如“型”与“形”的区别、题干括号内注明填“大于或小于”我们答题时就不要用“ > 或 < ”、注明用abcd就不要用ABCD 。
3.物质结构与性质题目中的常见分析、比较类考点(1)第一电离能、电负性:掌握规律和特殊。随着原子序数的递增,元素的第一电离能、电负性呈周期性变化:同周期从左到右,第一电离能有逐渐增大的趋势,稀有气体的第一电离能最大,碱金属的第一电离能最小;同主族从上到下,第一电离能有逐渐减小的趋势。(2)稳定性强弱:化学键的稳定性、分子的稳定性比较。(3)熔、沸点的高低,晶体类型,构成晶体微粒间作用力大小。①不同晶体类型的熔、沸点比较。②同种晶体类型的熔、沸点比较。③金属晶体由于金属键的差别很大,金属晶体的熔沸点差别也很大。
【方法提炼】①回归教材,弄清基本概念。如晶格能的定义以及晶格能与离子晶体性质的关系。②多了解评卷原则,减少不必要的失分。如题干比较大小时的顺序(如“由大至小”“由小到大”“大于”或“小于”)等。③注意语言描述的准确性和逻辑性。4.物质结构与性质题目中的计算类型(1)配位数的计算。(2)晶胞参数的计算:边长、密度、质量。晶体晶胞中的微粒数N与摩尔质量M、密度ρ、晶胞边长a之间的关系:NM=ρ a3NA(N用均摊法计算)。(3)空间利用率的计算:类型和计算方法(难点)。
【方法提炼】①熟悉各种典型的晶体结构。
②空间利用率的计算:类型和计算方法(难点突破)。一般是计算金属的密度,采用密度计算公式,式中为晶胞中粒子的总质量(注意:单位的换算)。突破口:先算出一个晶胞中含有多少个微粒,再找准球体半径与晶胞体积(或边长)的关系。
③注意审题:看清楚题干中各物理量的单位,先统一单位再计算。④金属晶体中的原子堆积模型及其配位数。面心立方最密堆积、六方最密堆积、简单立方堆积、体心立方堆积中,金属元素的配位数分别为12、12、6、8。总之,《物质结构与性质》其实就是把原子、分子结构和性质、晶体结构和性质等知识拼盘成一个大题,设置若干个小问题,每一个小题考查相应的知识,实现了三者的有机融合,覆盖面广,综合性强,考查学生对知识的整合能力。
[变式练习1] (2022·广州一模)铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下。
回答下列问题:(1)基态铝原子的核外电子排布式为_________________________________。
(2)基态氮原子的价层电子排布图为________(填字母)。
(3)化合物Ⅰ中碳原子的杂化轨道类型为__________,化合物Ⅱ中阳离子的空间构型为__________。(4)化合物Ⅲ中O、F、S电负性由大到小的顺序为________________。(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是__________________________________________________________________________________________________________________________________。
(6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如下图所示。
③已知该晶体属于立方晶系,晶胞参数为a pm,阿伏加德罗常数的值为NA,则晶体的密度为____________g·cm-3(列出计算式)。
[变式练习2] 镍及其化合物在工业生产和科研领域有重要的用途。请回答下列问题:(1)基态Ni原子中,电子填充的能量最高的能级符号为________,价层电子的轨道表达式为___________________________________________________________________________________________________________________。(2)Ni的两种配合物结构如图所示:
A B
①A的熔、沸点高于B的原因为_______________________________________________________________________________________________________。②A晶体含有化学键的类型为__________(填字母)。A.σ键 B.π键C.配位键 D.金属键③A晶体中N原子的杂化形式是________。(3)人工合成的砷化镍常存在各种缺陷,某缺陷砷化镍的组成为Ni1.2As,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为________。
(4)NiAs的晶胞结构如图所示:
①镍离子的配位数为________。②若阿伏加德罗常数的值为NA,晶体密度为ρ g·cm-3,则该晶胞中最近的砷离子之间的距离为________pm。
相关课件
这是一份2024届高考化学二轮专题复习与测试第二部分题型解读五有机化学题型突破课件,共43页。PPT课件主要包含了有机推断的解题技能等内容,欢迎下载使用。
这是一份2024届高考化学二轮专题复习与测试第二部分题型解读三化学工业流程题解题突破课件,共40页。PPT课件主要包含了常考化工术语,续上表等内容,欢迎下载使用。
这是一份2024届高考化学二轮专题复习与测试第二部分题型解读四化学反应原理题解题突破课件,共39页。












