





2024年高考化学一轮复习第二章第二节物质的量浓度课件
展开(1)1 ml·L 的 NaCl 溶液是指此溶液中含有 1 ml Na 。(
物质的量浓度为 0.5 ml·L 。(
浓度为 1 ml·L 。(
(4)0.5 ml·L 的稀 H2SO4 溶液中,c(H+)为 1.0 ml·L 。(
[ 自主测评 ]1.易错易混辨析(正确的画“√”,错误的画“×”)。
(2)从 100 mL 5 ml·L
H2SO4 溶液中取出了 10 mL,所得硫酸的
(3)将 62 g Na2O 溶于水中,配成 1 L 溶液,所得溶质的物质的量
(5)将 25 g CuSO4·5H2O 晶体溶于 75 g 水中所得溶液的溶质质量
(2)× (3)×
(4)√ (5)×
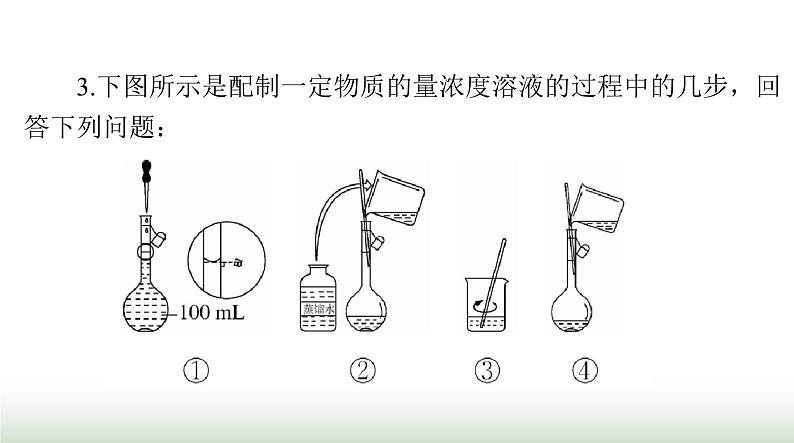
3.下图所示是配制一定物质的量浓度溶液的过程中的几步,回
(1)图示几个步骤的先后顺序应是________(填字母)。
(2)其中①对应的操作方法为________________________________________________________________________________________________________________________________________。
(2)将蒸馏水注入容量瓶,当液面离容量瓶颈部
的刻度线 1~2 cm 时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切
考点一 物质的量浓度1.物质的量浓度(1)概念
物质的量浓度表示单位体积的溶液里所含溶质B的物质的
量,也称为B的物质的量浓度,符号为cB。
(4)注意:对于某浓度的溶液,取出任意体积的溶液,其浓度、密度、质量分数均不变,但所含溶质的质量、物质的量因体积不同而改变。
2.物质的量浓度和溶质质量分数的比较
对物质的量浓度表达式的理解(1)正确判断溶液的溶质①与水发生反应生成新的物质:
Na、Na2O、Na2O2
②特殊物质:如 NH3 溶于水后溶质为 NH3·H2O,但计算浓度时仍以 NH3 作为溶质。
考点二 配制一定物质的量浓度的溶液1.两种重要仪器——托盘天平和容量瓶①托盘天平的构造及使用
称量前先调零,称量固体药品时,药品放在左盘,砝码放在
右盘,读数精确到 0.1 g。
a.容量瓶上标有温度、规格和刻度线。常用规格有 50 mL、
100 mL、250 mL、500 mL、1000 mL 等。
b.容量瓶在使用前要检查是否漏水,其操作顺序为装水→盖塞
→倒立→正立→玻璃塞旋转 180°→倒立。
①不能将固体或浓溶液直接在容量瓶中溶解或稀释;②容量瓶不能用作反应容器或用来长期贮存溶液;③不能配制任意体积的溶液,只能配制容量瓶上规定容积的溶液;④不能将过冷或过热的溶液转移到容量瓶中;⑤向容量瓶中注入液体时,不能直接注入,一定要用玻璃棒引流且玻璃棒的下端要在刻度线以下,防止溶液洒落。
以配制 500 mL 1.0 ml·L-1
3.误差分析(1)从改变溶质物质的量角度分析产生的误差(填“偏大”“偏
①配制 450 mL 0.1 ml·L-1
的 NaOH 溶液,用托盘天平称量
NaOH 固体 1.8 g:________。矾 8.0 g:________。③配制 NaOH 溶液,用托盘天平称量 NaOH 时,托盘天平的两个托盘上放两张质量相等的纸片,把 NaOH 固体放在纸上称量,其他操作均正确:________。
②配制500 mL 0.1 ml·L-1的硫酸铜溶液,用托盘天平称取胆
④配制一定物质的量浓度的 NaOH 溶液,需称量溶质 4.4 g,称量时物码放置颠倒:______。⑤配制一定物质的量浓度的稀 H2SO4 溶液时,用量筒量取浓硫酸时,仰视读数:______。⑥定容时,加水超过刻度线,用胶头滴管吸取多余的液体至
刻度线:________。
⑦配制一定物质的量浓度溶液时,烧杯及玻璃棒未洗涤:________。
(2)从改变溶液体积角度分析产生的误差(填“偏大”“偏小”
①配制 NaOH 溶液时,将称量好的 NaOH 固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容:________。②定容摇匀后,发现液面下降,继续加水至刻度线:_____。③定容时仰视刻度线:________。④定容摇匀后少量溶液外流:________。
⑤容量瓶中原有少量蒸馏水:________。
考向1 物质的量浓度的相关计算
答案:(1)0.2 ml·L
1000Vρ17V+2240
考向2 一定物质的量浓度溶液的配制
3.(2022 年天津河东区期末)实验室需用 450 mL 0.1 ml·L-1酸铜溶液,下列有关该溶液的配制说法正确的是()
A.用天平称取 12.5 g 胆矾(CuSO4·5H2O)B.应选用 450 mL 容量瓶配制溶液C.溶解胆矾的烧杯需用水洗涤 2~3 次,并将洗涤液丢弃D.定容时,眼睛盯着胶头滴管
密度为1.2 g·cm 的消毒液,下列说法正确的是(
4.(2022 年福建师大附中期末)某同学参阅了“84”消毒液说明书中的配方,欲用容量瓶、NaClO固体配制480 mL 含25% NaClO、
A.配制时在烧杯中溶解 NaClO,冷却至室温,将溶液转移到480 mL 容量瓶B.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制C.定容时俯视容量瓶的刻度线,会造成所配溶液物质的量浓度偏低D.需用天平称量的 NaClO 固体的质量为 150.0 g
解析:实验室没有 480 mL 容量瓶,应选用 500 mL 容量瓶来配制溶液,A 错误;定容时要加入蒸馏水,因此容量瓶用蒸馏水洗净后,不需要烘干,可直接用于溶液的配制,B 错误;定容时俯视容量瓶的刻度线,定容完毕,液面会低于刻度线,造成所配溶液物质的量浓度偏高,C 错误;称取 NaClO 固体的质量为
m(NaClO)=500 mL×1.2 g·cm-3×25%=150.0 g,D正确。
考向3 一定物质的量浓度溶液的配制误差分析
5.(2022 年山东省实验中学检测) 欲配制 100 mL 1.0 ml·L-1
Na2SO4 溶液,下列操作会使配得的溶液浓度偏小的是(
A.容量瓶中原有少量蒸馏水B.定容时,俯视容量瓶中液体的凹液面C.称量 Na2SO4 固体时,药品和砝码的位置放反了(1 g 以下用游码)D.将 32.2 g Na2SO4·10H2O 溶于少量水中,再配制成 100 mL 溶液
解析:定容时要加入蒸馏水,因此容量瓶中原有少量蒸馏水,所得溶液的浓度不变,A 错误;定容时,俯视容量瓶中液体的凹液面,定容结束时,液面低于刻度线,则所得溶液的浓度偏大,B 错误;称量 Na2SO4 固体时,药品与砝码位置放反了,且 1 g 以下用游码,则称取 Na2SO4 固体的质量减小,故所配得溶液的浓度偏小,C 正确;32.2 g Na2SO4·10H2O 的物质的量为 0.1 ml,溶于
少量水中,再配成 100 mL 溶液,则有 c(Na2SO4)=
0.1 ml0.1 L
1.0 ml·L-1,D错误。
①用量筒量取浓硫酸后,再用蒸馏水洗涤量筒,并将洗涤液转
②将浓硫酸在烧杯中稀释,转移到 100 mL 的容量瓶
③在转移过程中用玻璃棒引流,因操作不慎
有少量溶液流到了容量瓶外面
④最后定容时,加水超过了刻度线,
马上用胶头滴管吸去多余的水,使溶液凹液面最低处刚好与刻度线相切
解析:用量筒量取浓硫酸,不需要用蒸馏水洗涤量筒,若洗涤且将洗涤液转移到容量瓶中,所取溶质 H2SO4 偏多,导致溶液浓度偏高,①错误;未洗涤烧杯,使溶质 H2SO4 损失,导致溶液浓度偏低,②正确;少量溶液流到容量瓶外面,使溶质 H2SO4 损失,导致溶液浓度偏低,③正确;加水超过了刻度线,马上用胶头滴管吸去多余的水,会损失 H2SO4,导致溶液浓度偏低,④正确。
[方法技巧] 一定物质的量浓度溶液的配制误差分析(1)误差分析的基本方法
误差分析中变量是 m 或 V,一般情况要固定其一,分析另一
物理量的变化对溶液浓度的影响:
(2)定容操作中视线引起误差的分析
①定容时,仰视容量瓶的刻度线(如图 1),导致溶液的体积偏
大,则所配溶液的浓度偏低。
②定容时,俯视容量瓶的刻度线(如图 2),导致溶液的体积偏
小,则所配溶液的浓度偏高。
考向 4 物质的量浓度、质量分数、溶解度的换算
(1)用 m、V 表示溶液的物质的量浓度:___________________
____________________。
(2)用 w、ρ表示溶液的物质的量浓度:___________________
______________。
(3)用 c、ρ表示溶质的质量分数:_____________________。(4)用ω表示该温度下 NaCl 的溶解度:__________________。
58.5c(3)1000ρ
1.(2020 年全国Ⅰ卷) 由 FeSO4·7H2O 固体配制 0.10 ml·L
FeSO4 溶液,需要的仪器有药匙、玻璃棒、____________(从下列图中选择,写出名称)。
解析:根据用固体物质配制一定物质的量浓度溶液的方法可知,题图给出的仪器中还需要烧杯、量筒和托盘天平。
答案:烧杯、量筒、托盘天平
2.(2019 年浙江 4 月选考改编)下列图示表示一定物质的量浓度溶液配制的是________(填字母)。
3.下列实验过程可以达到实验目的的是(
2025版高考化学一轮复习真题精练第二章物质的量第5练物质的量浓度课件: 这是一份2025版高考化学一轮复习真题精练第二章物质的量第5练物质的量浓度课件,共5页。
2024届高考化学一轮复习 第二章 化学常用计量 第2讲 物质的量浓度及配制课件PPT: 这是一份2024届高考化学一轮复习 第二章 化学常用计量 第2讲 物质的量浓度及配制课件PPT,共54页。PPT课件主要包含了2查漏操作,答案A,气体的溶解度,溶解度曲线的意义,答案B等内容,欢迎下载使用。
2024年高考化学一轮复习物质的量浓度课件: 这是一份2024年高考化学一轮复习物质的量浓度课件,共39页。PPT课件主要包含了复习目标,物质的量浓度,考点一,必备知识,易错辨析,专项突破,归纳总结,考点二,使用容量瓶的“五不”,真题演练等内容,欢迎下载使用。












