所属成套资源:2024届高三新高考化学大一轮专题练习(47份)
2024届高三新高考化学大一轮专题练习--氮族元素及其化合物
展开
这是一份2024届高三新高考化学大一轮专题练习--氮族元素及其化合物,共16页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题练习--氮族元素及其化合物
一、单选题
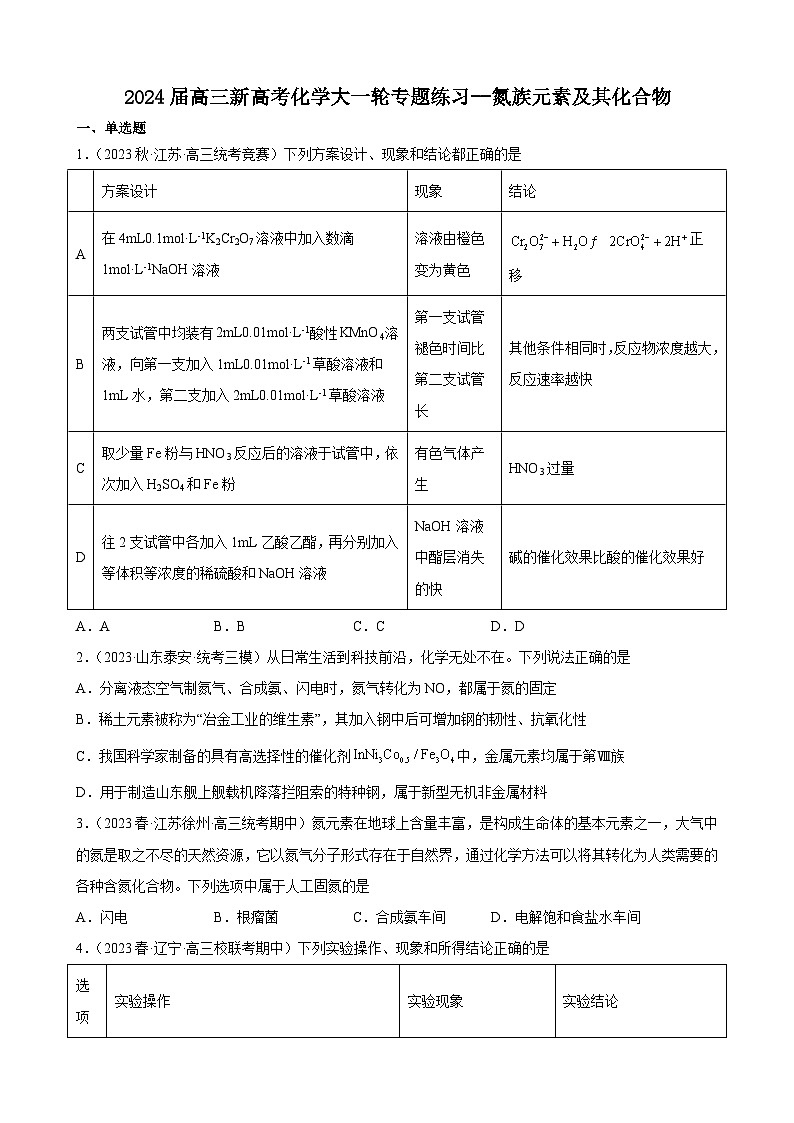
1.(2023秋·江苏·高三统考竞赛)下列方案设计、现象和结论都正确的是
方案设计
现象
结论
A
在4mL0.1mol·L-1K2Cr2O7溶液中加入数滴1mol·L-1NaOH溶液
溶液由橙色变为黄色
正移
B
两支试管中均装有2mL0.01mol·L-1酸性KMnO4溶液,向第一支加入1mL0.01mol·L-1草酸溶液和1mL水,第二支加入2mL0.01mol·L-1草酸溶液
第一支试管褪色时间比第二支试管长
其他条件相同时,反应物浓度越大,反应速率越快
C
取少量Fe粉与HNO3反应后的溶液于试管中,依次加入H2SO4和Fe粉
有色气体产生
HNO3过量
D
往2支试管中各加入1mL乙酸乙酯,再分别加入等体积等浓度的稀硫酸和NaOH溶液
NaOH溶液中酯层消失的快
碱的催化效果比酸的催化效果好
A.A B.B C.C D.D
2.(2023·山东泰安·统考三模)从日常生活到科技前沿,化学无处不在。下列说法正确的是
A.分离液态空气制氮气、合成氨、闪电时,氮气转化为NO,都属于氮的固定
B.稀土元素被称为“冶金工业的维生素”,其加入钢中后可增加钢的韧性、抗氧化性
C.我国科学家制备的具有高选择性的催化剂中,金属元素均属于第Ⅷ族
D.用于制造山东舰上舰载机降落拦阻索的特种钢,属于新型无机非金属材料
3.(2023春·江苏徐州·高三统考期中)氮元素在地球上含量丰富,是构成生命体的基本元素之一,大气中的氮是取之不尽的天然资源,它以氮气分子形式存在于自然界,通过化学方法可以将其转化为人类需要的各种含氮化合物。下列选项中属于人工固氮的是
A.闪电 B.根瘤菌 C.合成氨车间 D.电解饱和食盐水车间
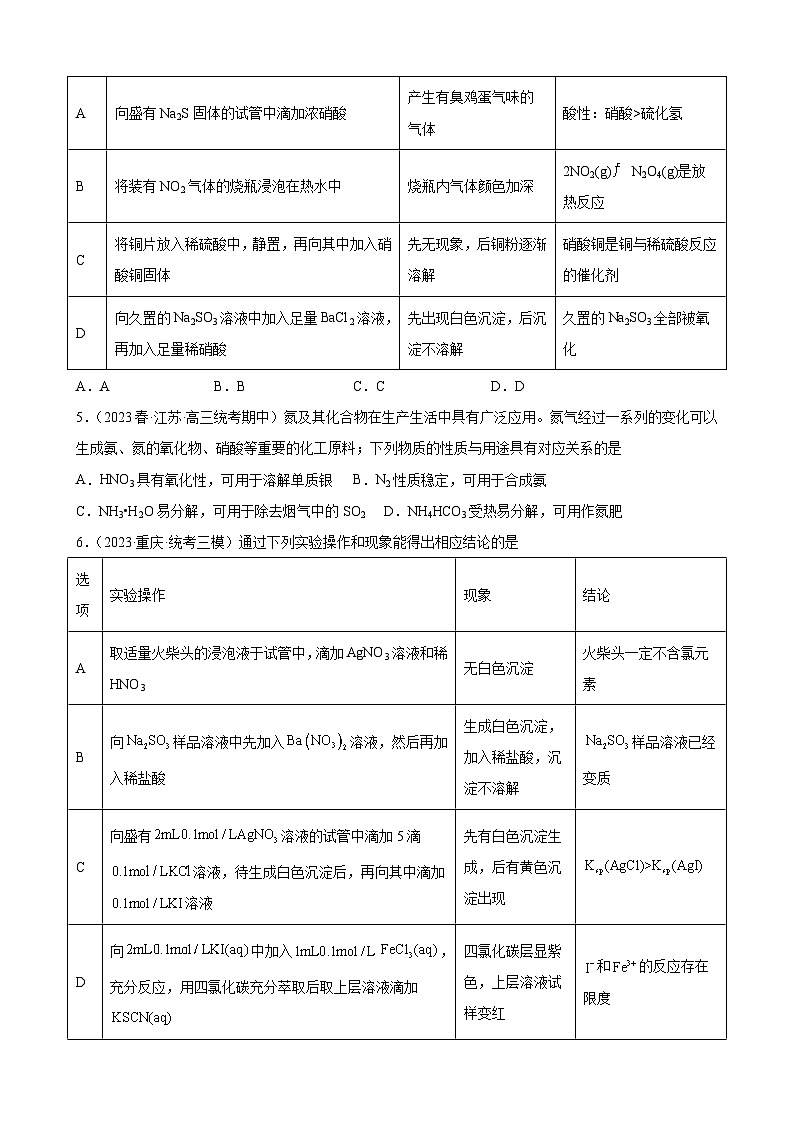
4.(2023春·辽宁·高三校联考期中)下列实验操作、现象和所得结论正确的是
选项
实验操作
实验现象
实验结论
A
向盛有Na2S固体的试管中滴加浓硝酸
产生有臭鸡蛋气味的气体
酸性:硝酸>硫化氢
B
将装有NO2气体的烧瓶浸泡在热水中
烧瓶内气体颜色加深
2NO2(g)N2O4(g)是放热反应
C
将铜片放入稀硫酸中,静置,再向其中加入硝酸铜固体
先无现象,后铜粉逐渐溶解
硝酸铜是铜与稀硫酸反应的催化剂
D
向久置的Na2SO3溶液中加入足量BaCl2溶液,再加入足量稀硝酸
先出现白色沉淀,后沉淀不溶解
久置的Na2SO3全部被氧化
A.A B.B C.C D.D
5.(2023春·江苏·高三统考期中)氮及其化合物在生产生活中具有广泛应用。氮气经过一系列的变化可以生成氨、氮的氧化物、硝酸等重要的化工原料;下列物质的性质与用途具有对应关系的是
A.HNO3具有氧化性,可用于溶解单质银 B.N2性质稳定,可用于合成氨
C.NH3•H2O易分解,可用于除去烟气中的SO2 D.NH4HCO3受热易分解,可用作氮肥
6.(2023·重庆·统考三模)通过下列实验操作和现象能得出相应结论的是
选项
实验操作
现象
结论
A
取适量火柴头的浸泡液于试管中,滴加AgNO3溶液和稀HNO3
无白色沉淀
火柴头一定不含氯元素
B
向样品溶液中先加入溶液,然后再加入稀盐酸
生成白色沉淀,加入稀盐酸,沉淀不溶解
样品溶液已经变质
C
向盛有溶液的试管中滴加5滴溶液,待生成白色沉淀后,再向其中滴加溶液
先有白色沉淀生成,后有黄色沉淀出现
D
向中加入,充分反应,用四氯化碳充分萃取后取上层溶液滴加
四氯化碳层显紫色,上层溶液试样变红
和的反应存在限度
A.A B.B C.C D.D
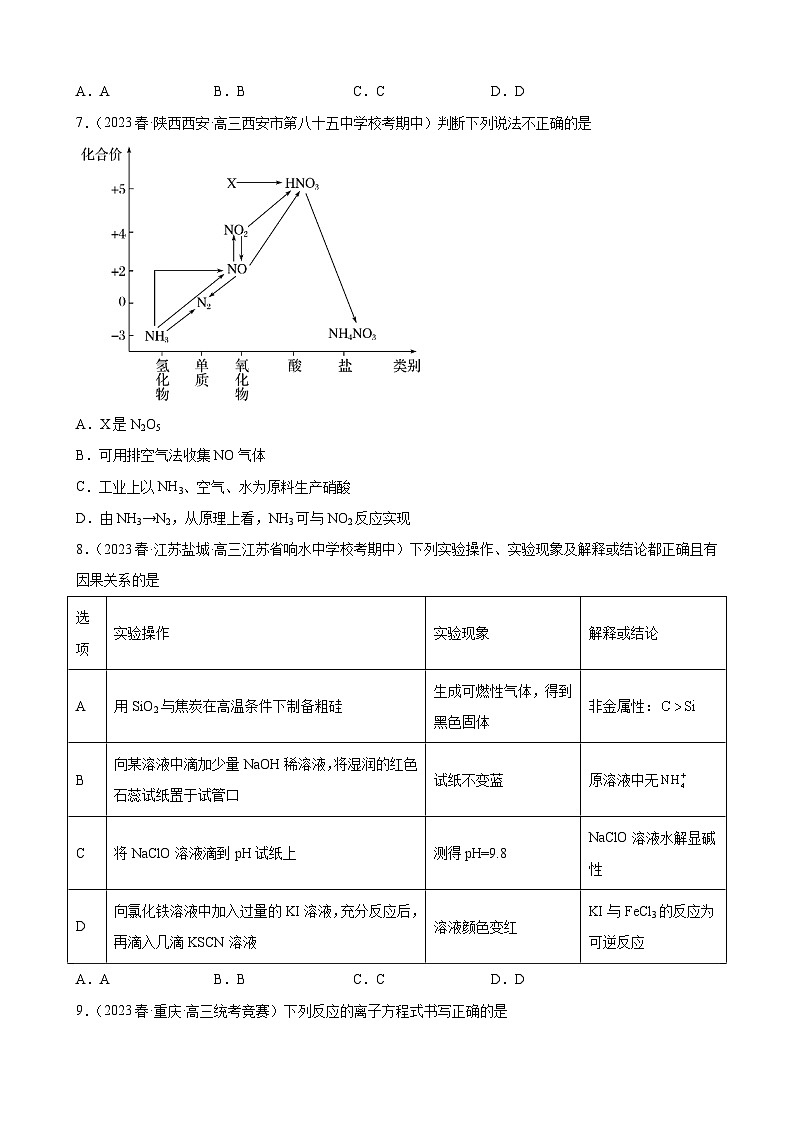
7.(2023春·陕西西安·高三西安市第八十五中学校考期中)判断下列说法不正确的是
A.X是N2O5
B.可用排空气法收集NO气体
C.工业上以NH3、空气、水为原料生产硝酸
D.由NH3→N2,从原理上看,NH3可与NO2反应实现
8.(2023春·江苏盐城·高三江苏省响水中学校考期中)下列实验操作、实验现象及解释或结论都正确且有因果关系的是
选项
实验操作
实验现象
解释或结论
A
用SiO2与焦炭在高温条件下制备粗硅
生成可燃性气体,得到黑色固体
非金属性:
B
向某溶液中滴加少量NaOH稀溶液,将湿润的红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无
C
将NaClO溶液滴到pH试纸上
测得pH=9.8
NaClO溶液水解显碱性
D
向氯化铁溶液中加入过量的KI溶液,充分反应后,再滴入几滴KSCN溶液
溶液颜色变红
KI与FeCl3的反应为可逆反应
A.A B.B C.C D.D
9.(2023春·重庆·高三统考竞赛)下列反应的离子方程式书写正确的是
A.溶液中通入少量:
B.溶液中滴加少量盐酸:
C.溶液中通入过量:
D.溶液中加入过量溶液:
10.(2023春·甘肃金昌·高三永昌县第一高级中学校考期中)下列有关氮元素的单质及其化合物的说法错误的是
①医学上常用液氮作冷冻剂,是利用了氮气化学性质的不活泼性
②铵盐都不稳定,受热分解都生成氨气
③向溶液中滴加稀盐酸无明显的变化
④实验室加热氯化铵固体,用碱石灰除去氯化氢的方法制备氨气
A.①③ B.①② C.①②③ D.①②③④
11.(2023春·广东江门·高三江门市培英高级中学校考期中)下列物质性质对应的离子方程式书写错误的是
A.向硫酸氢钠溶液中滴加氢氧化钡溶液至中性:
B.向1mol/L溶液中滴加盐酸:
C.用食醋清洗水垢()的原理:
D.实验室若用磨砂玻璃塞盖在了盛放NaOH溶液的试剂瓶上:
12.(2023春·河北保定·高三河北安国中学校联考阶段练习)铁元素的价类二维图如图所示。下列说法错误的是
A.④可用作红色涂料
B.⑦的溶液可用于清洗青铜文物表面的锈迹
C.⑤被溶液中的氧气氧化为⑥的化学方程式为
D.③溶于过量稀硝酸的离子方程式为
13.(2023春·陕西宝鸡·高三统考期中)已知NH4NO3爆炸时的反应为4NH4NO33N2↑+2NO2↑+8H2O↑,下列说法不正确的是
A.NH4NO3在高温下爆炸时有红棕色气体生成
B.NH4NO3既是氧化剂又是还原剂,N2是氧化产物,NO2是还原产物
C.实验室不能用NH4NO3固体与Ca(OH)2固体混合加热制备NH3
D.乘坐火车时不能携带NH4NO3固体
14.(2023春·河北邢台·高三校联考阶段练习)下列实验中,现象及结论都正确的是
选项
实验操作
现象结论
A
常温下,将晶体与晶体在小烧杯中混合
烧杯壁变凉
该反应的
B
取少量浓硝酸加热分解,将产物先通入浓硫酸,后用集气瓶收集气体,并将带火星的木条放置瓶内
木条复燃
支持燃烧
C
25℃,向浓度均为0.1 mol·L的和混合溶液中滴加几滴溶液
出现白色沉淀
在25℃下,
D
分别向盛有0.1 mol·L的甲酸和饱和硼酸溶液的试管中滴加等浓度溶液
前者产生无色气泡,后者无明显现象
酸性:甲酸>硼酸>碳酸
A.A B.B C.C D.D
二、非选择题
15.(2023·全国·高三假期作业)N元素的循环是人类社会中重要的物质循环之一
(1)人工合成,并以其为原料生产硝酸。
①合成反应中氧化剂的电子式是___________。
②写出催化氧化反应的化学方程式___________。
③若直接排放到空气中会形成硝酸型酸雨,反应的化学方程式为___________。
(2)燃煤电厂烟气中存在氮氧化物,我国科学家正着力研究SCR技术(选择性催化还原氮氧化物)对烟气进行脱硝处理。
铁基催化剂在范围内实现SCR技术的过䅣如下:
①下列有关上述铁基倠化剂实现SCR技术的说法正确的是___________。
a.反应ⅰ体现了的碱性
b.反应ⅳ中消耗的与NO的物质的量之比为。
c.是反应的催化剂之一
②上述铁基催化剂实现SCR技术的总反应是___________。
③相比于铁基催化剂,便用锰基催化剂(活性物质为)时,烟气中含有的会明显降低NO脱除率。推测与会发生反应使倠化剂失效,其化学方程式是___________。
16.(2023·全国·高三专题练习)硝酸铜晶体[Cu(NO3)2·6H2O],是一种重要的化工原料,常用于农药、镀铜、搪瓷等工业。以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备硝酸铜晶体的某工艺如图所示。
滤渣2的主要成分是___________,滤渣2与稀硝酸反应时,需向装置内通入适量空气,这样做的目的是___________。
17.(2023春·陕西榆林·高三校考阶段练习)如图是氮元素的几种价态与物质类别的对应关系。回答下列问题:
(1)写出的一种用途:___________。
(2)B物质的电子式为:___________。
(3)与图中的物质C常用于检验的存在,则C的化学式为___________。
(4)实验室制取物质B的化学方程式为___________。
(5)浓硝酸与木炭在加热条件下反应的化学方程式为___________。
(6)将3.2g铜与60.0mL一定浓度的硝酸发生反应,铜完全溶解,产生和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入的NaOH溶液,恰好使溶液中的全部转化成沉淀,则原硝酸溶液的浓度为___________。
18.(2022秋·山东威海·高三统考期末)铁及其化合物在工业上用途广泛。部分含铁物质的分类与相应铁元素的化合价关系如图所示。回答下列问题:
(1)在高温条件下,Al粉可与a的粉末反应。写出该反应的一个用途______。
(2)电子工业中,人们常用b的溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板。该反应的离子方程式为______,设计实验证明腐蚀后的废液中含有b的阳离子:______。
(3)工业上可以用c制造的容器盛放冷的浓硝酸,体现了浓硝酸的______性;在加热条件下二者可剧烈反应,c与足量浓硝酸在加热条件下反应的化学方程式为______。
(4)d为K2FeO4,是一种新型、高效的水处理剂。已知湿法制备它的体系中参加反应的六种微粒为:d的阴离子、e、H2O、、、。该反应的离子方程式为______。若要制备0.2mol,理论上需要______gNaClO。
参考答案:
1.A
【解析】略
2.B
【详解】A.氮的固定是指游离态的氮变为化合态的氮,因此分离液态空气制氮气不属于氮的固定,合成氨、闪电时氮气转化为NO属于氮的固定,故A错误;
B.稀土元素加入钢中有多种作用,例如改变合金的结构增加钢的韧性、抗氧化性,故B正确;
C.Ni、Co、Fe都是第Ⅷ族元素,In是第IIIA族元素,故C错误;
D.用于制造山东舰上舰载机降落拦阻索的特种钢,属于金属材料,故D错误;
答案选B。
3.C
【详解】A.闪电过程中空气中氮气和氧气化合生成NO,属于自然固氮,A不符合;
B.根瘤菌固氮,属于自然固氮,B不符合;
C.合成氨车间过程中氮气和氢气化合生成氨气,属于人工固氮,C符合;
D.电解饱和食盐水生成的是氢氧化钠、氢气和氯气,与固氮没有关系,D不符合;
答案选C。
4.B
【详解】A.硝酸具有强氧化性,能将H2S氧化为S,故向盛有Na2S固体的试管中滴加浓硝酸,产生不了产生有臭鸡蛋气味的气体H2S,A不合题意;
B.将装有NO2气体的烧瓶存在2NO2(g)N2O4(g)浸泡在热水中,观察到烧瓶内气体颜色加深,说明NO2浓度增大,上述平衡逆向移动,故能说明2NO2(g)N2O4(g)是放热反应,B符合题意;
C.将铜片放入稀硫酸中,静置,再向其中加入硝酸铜固体,硝酸铜电离出的硝酸根和稀硫酸电离出H+形成了具有强氧化性的HNO3,能与Cu反应,原理为:3Cu+2+8H+=3Cu2++2NO↑+4H2O,Cu(NO3)2不是催化剂而是反应物之一,C不合题意;
D.亚硫酸钡可被硝酸氧化生成硫酸钡,由操作和现象不能证明久置的Na2SO3溶液已全部变质,D不合题意;
故答案为:B。
5.A
【详解】A.HNO3具有氧化性,能将单质银溶解转化成AgNO3,A项符合题意;
B.N2用于合成NH3是因为N2与H2在催化剂、高温和高压下能化合成NH3,该反应中N2表现氧化性,与N2性质稳定无关,B项不符合题意;
C.NH3∙H2O除去烟气中的SO2发生反应2NH3∙H2O+SO2=(NH4)2SO3+H2O,该反应中体现NH3∙H2O的碱性,与NH3∙H2O易分解无关,C项不符合题意;
D.NH4HCO3用作氮肥是因为含氮元素,与NH4HCO3受热易分解无关,D项不符合题意;
答案选A。
6.D
【详解】A.火柴头中含氯酸根离子,不能电离出氯离子,不能加AgNO3溶液和稀HNO3检验氯元素的存在,由实验操作和现象,不能证明火柴头是否含氯元素,A错误;
B.酸性溶液中硝酸根离子可氧化亚硫酸钠,生成的硫酸根离子与钡离子结合生成硫酸钡沉淀,由实验操作和现象可知,不能证明Na2SO3样品溶液已经变质,B错误;
C.由于实验中AgNO3过量,故AgNO3溶液与KCl、KI反应生成沉淀,不存在AgCl转化为AgI的过程,由实验操作和现象可知,不能比较Ksp(AgCl)、Ksp(AgI)的大小,C错误;
D.氯化铁不足,充分反应后,用四氯化碳充分萃取后取上层溶液滴加KSCN(aq),四氯化碳层显紫色,上层溶液试样变红,可知铁离子不能完全转化,则I-和Fe3+的反应存在限度,D正确;
故答案为:D。
7.B
【详解】A.根据图中氮元素及其化合物的转化关系可知,氮的氧化物X中的氮元素的化合价为+5价,对应的物质是N2O5,A项正确;
B.NO和空气中氧气生成二氧化氮,故不可用排空气法收集NO气体,B项错误;
C.氨气催化氧化生成一氧化氮和水,一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,故工业上以NH3、空气、水为原料生产硝酸,C项正确;
D.根据氧化还原反应原理分析,NH3可与NO2反应生成氮气,化学方程式为:8NH3+6NO2=7N2+12H2O,D项正确;
答案选B。
8.D
【详解】A.SiO2与焦炭在高温条件下生成Si和CO,为非自发进行的氧化还原反应,不能比较C、Si的非金属性,A错误;
B.由于NH3极易溶于水,故溶液中滴加少量NaOH稀溶液,没有产生使红色石蕊试纸变蓝的气体,溶液中可能含有,B错误;
C.次氯酸钠溶液具有漂白性,不能用pH试纸测定其溶液的pH,C错误;
D.加入过量的KI溶液,由操作和现象可知反应后含铁离子,则KI与FeCl3的反应为可逆反应,D正确;
故答案为:D。
9.D
【详解】A.向FeBr2溶液中通入少量的氯气,还原性:Fe2+>Br -,少量Cl2 先氧化亚铁离子而不是Br -,故A正确;
B.溶液中滴加少量盐酸,生成碳酸氢钠,反应的离子方程式: ,故B错误;
C.溶液中通入过量生成硅酸和碳酸氢钠,反应的离子方程式为SiO+2H2O+2CO2=H2SiO3↓+ 2HCO,故C错误;
D.溶液中加入过量溶液,生成硫酸钡沉淀、一水合氨,反应的离子方程式为,故D正确;
故选D。
10.D
【详解】①液氮气化时吸收大量的热,使周围温度降低,因此医学上常用液氮作冷冻剂,故①错误;②铵盐都不稳定,受热分解不一定都生成氨气,比如硝酸铵受热分解没有氨气生成,故②错误;③向溶液中滴加稀盐酸,会发生氧化还原反应,有无色气泡产生,无色气体变为红棕色,故③错误;④加热氯化铵固体生成氨气和氯化氢,氯化氢和氨气在试管口变为氯化铵,因此不能用加热氯化铵的方法制备氨气,故④错误;因此①②③④错误;故D错误。
综上所述,答案为D。
11.B
【详解】A.硫酸氢钠与氢氧化钡为2: 1时溶液显中性,此时钡离子、氢氧根离子完全反应生成硫酸钡沉淀、水,离子方程式为:2H++SO+Ba2++2OH-=BaSO4↓+2H2O,A正确;
B.向1mol/L溶液中滴加盐酸,酸性条件下硝酸根离子氧化亚铁离子生成铁离子和一氧化氮气体,,B错误;
C.醋酸为弱酸,不能拆,用食醋清洗水垢(CaCO3)的离子方程式为:2CH3COOH+CaCO3=CO2↑+Ca2++2CH3COO-+H2O,C正确;
D.用磨砂玻璃塞盖在了盛放NaOH溶液的试剂瓶上,氢氧化钠和二氧化硅生成硅酸钠和水:SiO2+2OH-=SiO+H2O,D正确;
故选B。
12.B
【分析】铁元素的价类二维图分析可知,①为Fe,②为FeO,③为Fe3O4,④为Fe2O3,⑤为Fe(OH)2,⑥为Fe(OH)3,⑦为Fe3+的盐,⑧为Fe2+的盐。
【详解】A.氧化铁为红色固体,可用作红色涂料,故A正确;
B.Fe3+的溶液和铜反应,2Fe3++Cu=2Fe2++Cu2+,不可用于清洗青铜文物表面的锈迹,故B错误;
C.氢氧化亚铁被溶液中的氧气氧化,白色沉淀迅速转化为灰绿色,最后变为红褐色,生成氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,故C正确;
D.Fe3O4溶于过量稀硝酸反应生成硝酸铁、一氧化氮和水,电子守恒、电荷守恒和原子守恒配平写出,反应的离子方程式为:,故D正确;
故选:B。
13.B
【详解】A.由方程式可知,硝酸铵在高温下爆炸时有红棕色的二氧化氮生成,所以可以看到红棕色的烟雾,故A正确;
B.由方程式可知,硝酸铵在高温下爆炸时铵根离子中氮元素化合价升高被氧化,硝酸根离子中氮元素的化合价降低被还原,所以硝酸铵既是氧化剂又是还原剂,由得失电子数目守恒可知,氮气既是氧化产物也是还原产物,二氧化氮是还原产物,故B错误;
C.由硝酸铵受热易爆炸可知,实验室不能用硝酸铵固体与氢氧化钙固体混合加热制备氨气,故C正确;
D.由硝酸铵受热易爆炸可知,乘坐火车时不能携带硝酸铵固体,否则会发生意外事故,故D正确;
故选B。
14.B
【详解】A.烧杯壁变凉,说明该反应常温下能自发进行,且为吸热反应,当时反应能自发进行,该反应,若满足此条件,则,即为熵增反应,A错误;
B.浓硝酸分解的反应为(浓),生成的和的体积比为4∶1,而空气中和的体积比为4∶1,故带火星的木条复燃,能说明支持燃烧,B正确;
C.和都是白色沉淀,由沉淀颜色不能确定沉淀是哪种物质,无法比较两者的溶度积,C错误;
D.强酸能和弱酸盐反应生成弱酸,前者生成气体而后者不能,说明酸性:甲酸>碳酸>硼酸,D错误;
故答案选B。
15.(1) 4NH3+5O24NO+6H2O 4NO2+2H2O+O2=4HNO3
(2) abc 4NH3+4NO+O24N2+6H2O MnO2+SO2═MnSO4
【详解】(1)①氮气和氢气反应合成,反应中氧化剂为氮气,氮气电子式是;
②催化氧化反应的化学方程式4NH3+5O24NO+6H2O。
③若直接排放到空气中会形成硝酸型酸雨,反应的化学方程式为4NO2+2H2O+O2=4HNO3。
(2)①a.反应ⅰ可以认为发生了酸碱中和反应,体现了的碱性,a正确;
b.结合得失电子守恒,反应ⅳ中消耗的与NO的物质的量之比为,b正确;
c.在反应开始参与反应,最终又生成氢离子,可以认为氢离子为反应的催化剂之一,c正确;
故选abc;
②上述铁基催化剂实现SCR技术的总反应是4NH3+4NO+O24N2+6H2O。
③SO2与MnO2会发生反应生成硫酸锰,反应的化学方程式:MnO2+SO2═MnSO4。
16. Cu 将生成的NO、NO2氧化为硝酸,提高硝酸利用率,可以减少污染气体NO、NO2的产生
【详解】由于前面加入了适当过量的铁粉,铁置换出铜,因此滤渣2的主要成分是Cu,还有少量的Fe。滤渣2与稀硝酸反应时,金属与硝酸反应生成NO、NO2,向装置内通入适量空气,可以将NO氧化成NO2,最终转化为硝酸,提高硝酸利用率,并且可以减少污染气体NO、NO2的产生。
17.(1)作保护气(或用于合成氨等)
(2)
(3)
(4)
(5)(浓)
(6)10
【详解】(1)氮气性质不活泼,可以作保护气,氮气可以与氢气反应生成氨气,氮气可用于合成氨;故答案为作保护气或用于合成氨;
(2)B为气态氮的氢化物,N显-3价,即B为NH3,其电子式为 ;故答案为 ;
(3)C为硝酸盐,硝酸与C用于检验Cl-,检验Cl-常用AgNO3,因此C为AgNO3;故答案为AgNO3;
(4)实验室制备氨气,常采用加热NH4Cl和Ca(OH)2,其反应方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O,故答案为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;
(5)浓硝酸具有强氧化性,能与木炭反应,其方程式为C+4HNO3(浓) CO2↑+4NO2↑+2H2O,故答案为C+4HNO3(浓) CO2↑+4NO2↑+2H2O;
(6)溶液中加入NaOH溶液,恰好使Cu2+全部转化成沉淀,此时溶质为NaNO3,根据N原子守恒,n(HNO3)=n(NaNO3)+n(NO2、NO)=n(NaOH)+ n(NO2、NO)=100mL×10-3L/mL×2.0mol/L+=0.6mol,c(HNO3)= =10mol/L;故答案为10。
18.(1)焊接钢轨、制备金属纳米复合材料
(2) 取腐蚀后的废液少许于试管中,滴加滴KSCN溶液,溶液变红,证明含有
(3) 氧化
(4) 22.35
【分析】a为氧化铁,b为铁盐,c为铁,d为高铁酸盐,e为氢氧化铁。
【详解】(1)在高温条件下,Al和某些金属氧化物发生置换反应,例如:2Al+Fe2O 32Fe+Al2O3,可用于焊接钢轨、制备金属纳米复合材料等。
(2)用浓氯化铁溶液腐蚀铜得到氯化亚铁和氯化铜,可用于制作印刷电路板。该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,以下实验可证明腐蚀后的废液中含有b的阳离子即铁离子:取腐蚀后的废液少许于试管中,滴加滴KSCN溶液,溶液变红,证明含有Fe3+。
(3)常温下,浓硝酸可用铁槽贮存,是因为铁与浓硝酸发生钝化反应,因为硝酸是氧化性酸,具有强氧化性;在加热条件下二者可剧烈反应,c即铁与足量浓硝酸在加热条件下反应的化学方程式为。
(4)湿法制备d即K2FeO4的体系中参加反应的六种微粒为:d的阴离子、e即氢氧化铁、H2O、、、,则该反应中铁元素化合价从+3升高到+6,发生氧化反应,同时中Cl从+1价降低到-1价被还原为,则该离子方程式为。若要制备0.2mol,理论上需要0.3molNaClO,即0.3mol×74.5g/mol =22.35gNaClO。
相关试卷
这是一份2024届高三新高考化学大一轮专题练习--氮族元素及其化合物,共16页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。
这是一份2024届高三新高考化学大一轮专题练习—氮族元素及其化合物,共17页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
这是一份2024届高三新高考化学大一轮专题练习——氮族元素及其化合物,共17页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。








