
2023年北京高考化学真题试卷及答案
展开
这是一份2023年北京高考化学真题试卷及答案,共37页。试卷主要包含了 下列过程与水解反应无关的是等内容,欢迎下载使用。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Mg-24 S-32 第一部分本部分共 14 小题,每题 3 分,共 42 分。在每题列出的四个选项中,选出最符合题目要求的一项。
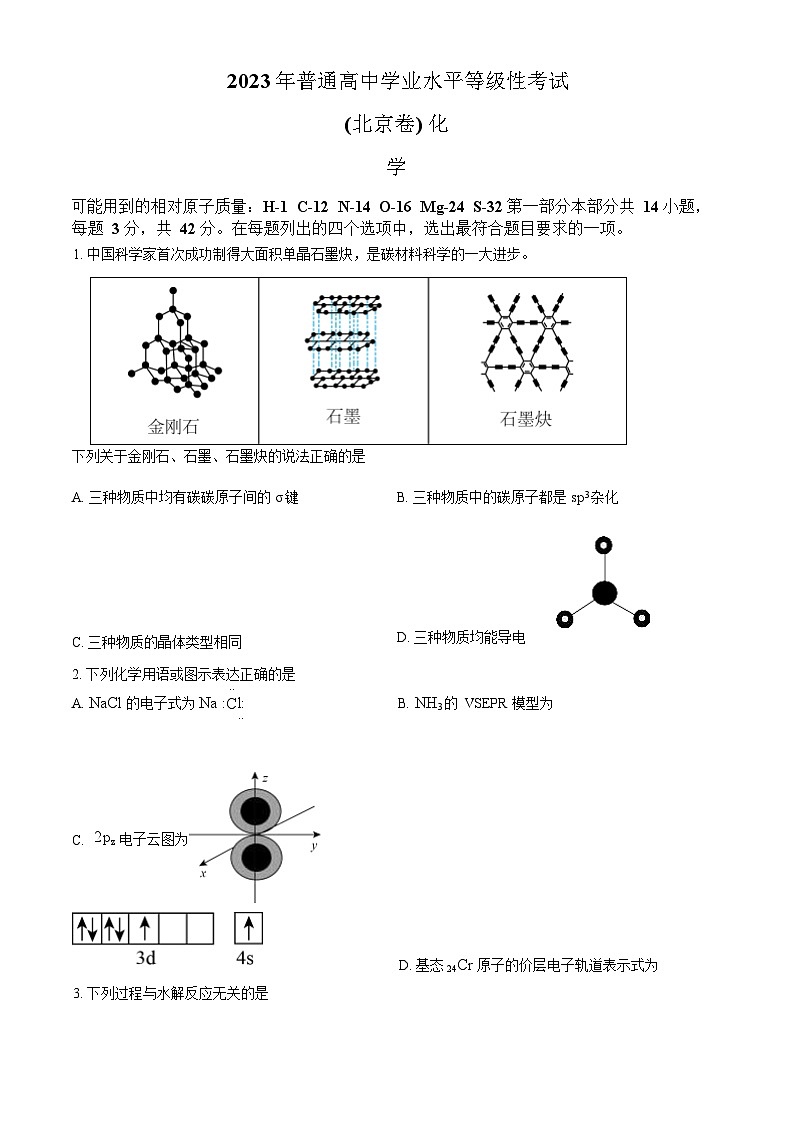
1. 中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
A. NaCl的电子式为Na :l: B. NH3的 VSEPR 模型为
··
C.
z
2
p
电子云图为
D. 基态24Cr 原子的价层电子轨道表示式为
3. 下列过程与水解反应无关的是
热的纯碱溶液去除油脂
重油在高温、高压和催化剂作用下转化为小分子烃
蛋白质在酶的作用下转化为氨基酸
向沸水中滴入饱和FeCl3 溶液制备Fe(OH)3胶体
4. 下列事实能用平衡移动原理解释的是
A H O2 2溶液中加入少量MnO2固体,促进H O2 2分解
B. 密闭烧瓶内的NO2 和NO2 4 的混合气体,受热后颜色加深
C 铁钉放入浓HNO3中,待不再变化后,加热能产生大量红棕色气体
D. 锌片与稀H SO24反应过程中,加入少量CuSO4固体,促进H2 的产生
5. 回收利用工业废气中的CO2和SO2,实验原理示意图如下。
下列说法不正确的是
废气中SO2排放到大气中会形成酸雨
装置 a 中溶液显碱性的原因是HCO3−的水解程度大于HCO3−的电离程度
装置 a 中溶液的作用是吸收废气中的CO2和SO2
电解
装置b中的总反应为SO32− +CO H O2 + 2HCOOH SO+ 42−
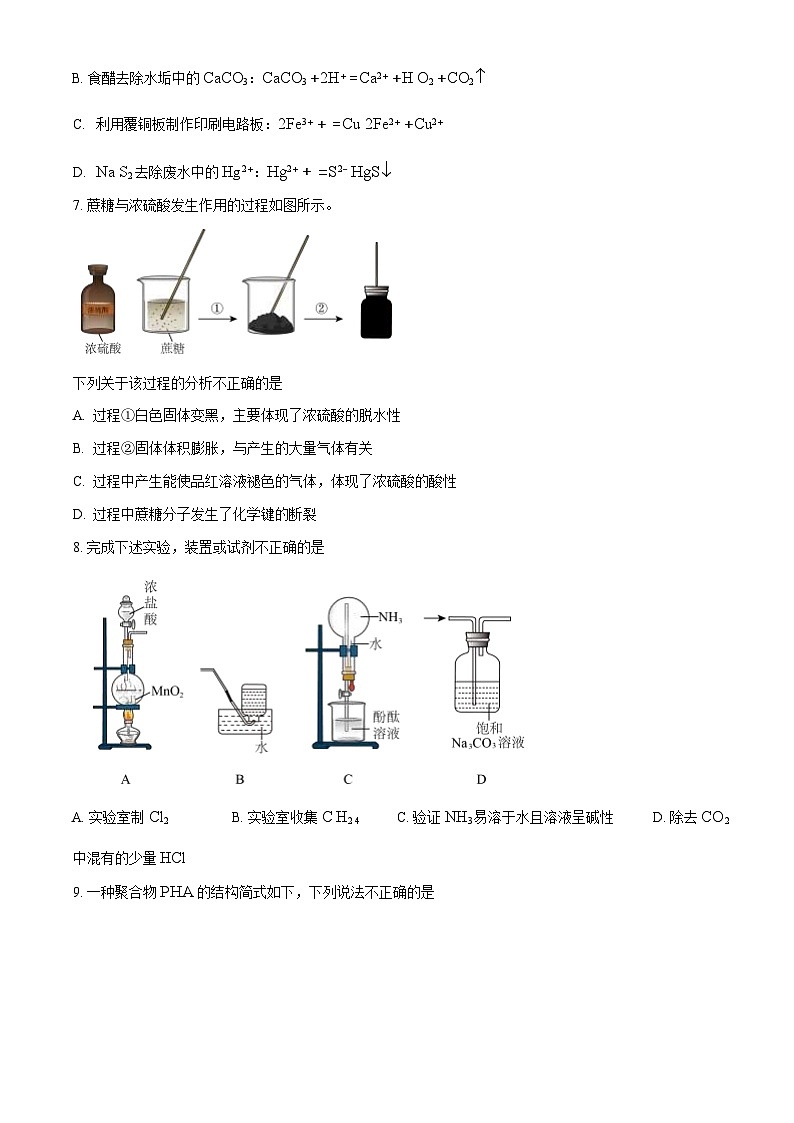
6. 下列离子方程式与所给事实不相符的是
A. Cl2 制备 84 消毒液(主要成分是NaClO):Cl2 +2OH− = Cl− +ClO− +H O2
B. 食醋去除水垢中的CaCO3:CaCO3 +2H+ =Ca2+ +H O2 +CO2
利用覆铜板制作印刷电路板:2Fe3+ + =Cu 2Fe2+ +Cu2+
Na S2 去除废水中的Hg2+:Hg2+ + =S2− HgS
7. 蔗糖与浓硫酸发生作用的过程如图所示。
下列关于该过程的分析不正确的是
过程①白色固体变黑,主要体现了浓硫酸的脱水性
过程②固体体积膨胀,与产生的大量气体有关
过程中产生能使品红溶液褪色的气体,体现了浓硫酸的酸性
过程中蔗糖分子发生了化学键的断裂
8. 完成下述实验,装置或试剂不正确的是
A. 实验室制Cl2 B. 实验室收集C H2 4 C. 验证NH3易溶于水且溶液呈碱性 D. 除去CO2
中混有的少量HCl
9. 一种聚合物PHA的结构简式如下,下列说法不正确的是
PHA的重复单元中有两种官能团
PHA可通过单体 缩聚合成
PHA在碱性条件下可发生降解
PHA中存在手性碳原子
10. 下列事实不能通过比较氟元素和氯元素的电负性进行解释的是
F F− 键的键能小于Cl−Cl键的键能
三氟乙酸的Ka 大于三氯乙酸的Ka
氟化氢分子的极性强于氯化氢分子的极性
气态氟化氢中存在(HF)2,而气态氯化氢中是HCl分子
11. 化合物K与L反应可合成药物中间体M ,转化关系如下。
已知 L 能发生银镜反应,下列说法正确的是
A. K 核磁共振氢谱有两组峰 B. L 是乙醛
C. M 完全水解可得到 K 和 L D. 反应物 K 与 L 的化学计量比是 1∶1
12. 离子化合物 Na O22 和 CaH2 与水的反应分别为① 2Na O 2H O 4NaOH O22 + 2 =+ 2 ;②
CaH2 +2H O Ca(OH2 =)2 +2H2 。下列说法正确的是
Na O22、CaH2中均有非极性共价键
①中水发生氧化反应,②中水发生还原反应
Na O22中阴、阳离子个数比为1:2,CaH2中阴、阳离子个数比为2:1
当反应①和②中转移的电子数相同时,产生的O2和H2 的物质的量相同
13. 一种分解氯化铵实现产物分离的物质转化关系如下,其中b、d 代表MgO或Mg OH Cl() 中的一种。
下列说法正确的是
A. a、c 分别是HCl、NH3
B. d 既可以是MgO,也可以是Mg OH Cl()
已知MgCl2 为副产物,则通入水蒸气可减少MgCl2 的产生
等压条件下,反应①、②的反应热之和,小于氯化铵直接分解的反应热
14. 利用平衡移动原理,分析一定温度下Mg2+在不同pH的Na CO2 3体系中的可能产物。已知:i.图 1 中曲线表示Na CO2 3体系中各含碳粒子的物质的量分数与pH的关系。
ii.2 中曲线Ⅰ的离子浓度关系符合c Mg(2+)c OH2 (−) = Ksp Mg(OH)2;曲线Ⅱ的离子浓度关系符合
c Mg( 2+)c CO( 32−) = Ksp (MgCO3) [注:起始c Na CO( 2 3) = 0.1ml L −1,不同pH下c CO( 32−)由图 1 得到]。
下列说法不正确的是
A. 由图 1,pH =10.25,c HCO(3−) = c CO(32−)
由图 2,初始状态pH =11、lg c Mg (2+)=−6,无沉淀生成
由图 2,初始状态pH = 9、lg c Mg (2+)=−2,平衡后溶液中存在
c H CO( 23) +c HCO(3−)+c CO(32−) = 0.1ml L −1
D. 由图 1 和图 2,初始状态pH 8= 、lg c Mg (2+)=−1,发生反应:
Mg2+ +2HCO3− = MgCO3 +CO2 +H O2
第二部分
本部分共 5 小题,共 58 分。
15. 硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根(S O232−)可看作是SO24−中的一个O原子被S 原子取代的产物。
基态S原子价层电子排布式是__________。
比较S原子和O原子的第一电离能大小,从原子结构的角度说明理由:____________________。
(3)S O232−的空间结构是__________。
同位素示踪实验可证实S O232−中两个S原子的化学环境不同,实验过程为
SO32− ⎯⎯ⅰS→S O2 32− ⎯ ⎯Ag⎯→ⅱ+ Ag S2 +SO42−。过程ⅱ中,S O2 32−断裂的只有硫硫键,若过程ⅰ所用试剂是 Na SO232 3和35S,过程ⅱ含硫产物是__________。
MgS O2 3 6H O2 的晶胞形状为长方体,边长分别为anm、bnm cnm、 ,结构如图所示。
2+−1,阿伏加德罗晶胞中的Mg H O( 2 )6 个数为__________。已知MgS O2 3 6H O2 的摩尔质量是Mg ml
常数为NΛ ,该晶体的密度为__________g cm−3。(1nm =10−7cm)
浸金时,S O232−作为配体可提供孤电子对与Au+形成Au S O( 2 3)23− 。分别判断S O232−中的中心S 原子和端基S原子能否做配位原子并说明理由:____________________。
16. 尿素CO NH(2)2合成的发展体现了化学科学与技术的不断进步。(1)十九世纪初,用氰酸银(AgOCN)与NH Cl4 在一定条件下反应制得CO NH(2)2,实现了由无机物
到有机物的合成。该反应的化学方程式是____________________。
(2)二十世纪初,工业上以CO2和NH3 原料在一定温度和压强下合成尿素。反应分两步:
ⅰ.CO2和NH3生成NH COONH24;
ⅱ.NH COONH24分解生成尿素。
结合反应过程中能量变化示意图,下列说法正确的是__________(填序号)。
a.活化能:反应ⅰ”或“”“I1(S),氧原子半径小,原子核对最外层电子的吸引力大,不易失去一个电子;
【小问 3 详解】
SO24的中心原子 S 的价层电子对数为 4,无孤电子对,空间构型为四面体形,S2O32可看作是S O24中 1
个 O 原子被 S 原子取代,则S2O32的空间构型为四面体形。答案为四面体形;
【小问 4 详解】
过程Ⅱ中S2O32断裂的只有硫硫键,根据反应机理可知,整个过程中S O32最终转化为S O24,S 最终转化
为Ag2S。若过程ⅰ所用的试剂为 Na232SO3 和35S,过程Ⅱ的含硫产物是 Na232SO4 和Ag235S。答案为
Na232SO4 和Ag235S;
【小问 5 详解】
由晶胞结构可知,1 个晶胞中含有8 4 2 1 4 个 MgH2O62,含有 4 个S2O32 ;该晶
体的密度ρ NNMAV NAabc4M1021 g cm3 。答案为 4; N4AMabc 1021;
【小问 6 详解】
具有孤电子对的原子就可以给个中心原子提供电子配位。S2O32中的中心原子 S 的价层电子对数为 4,无孤
电子对,不能做配位原子;端基 S 原子含有孤电子对,能做配位原子。
16. 尿素 CONH22 合成的发展体现了化学科学与技术的不断进步。
十九世纪初,用氰酸银AgOCN与NH4Cl在一定条件下反应制得CONH22,实现了由无机物到
有机物的合成。该反应的化学方程式是____________________。
二十世纪初,工业上以CO2和 NH3为原料在一定温度和压强下合成尿素。反应分两步: ⅰ.CO2和 NH3生成 NH2COONH4; ⅱ. NH2COONH4分解生成尿素。
结合反应过程中能量变化示意图,下列说法正确的是__________(填序号)。
a.活化能:反应ⅰ Ksp Ag2S;
②根据信息,在H2SO4 溶液中二氧化锰可将Fe2氧化为Fe3,自身被还原为Mn2,则浸锰液中主要的金
属阳离子有Fe3、Mn2。
【小问 2 详解】
①Ag2S中 S 元素化合价升高,Fe 元素化合价降低,根据得失电子守恒、元素守恒,该离子方程式为
2Fe3 Ag2S 4Cl2Fe2 2ΛgCl2 S;
②Cl是为了与Ag2S 电离出的Ag结合生成AgCl2,使平衡正向移动,提高Ag2S 的浸出率;H是为
了抑制Fe3水解,防止生成 Fe(OH)3沉淀。
【小问 3 详解】
①铁粉可将AgCl2还原为单质银,过量的铁粉还可以与铁离子发生反应,因此离子方程式为
2AgCl2 Fe Fe2 2Ag 4Cl 、2Fe3 Fe 3Fe2;
②溶液中生成的Fe2会被空气中的氧气缓慢氧化为Fe3,Fe3把部分Ag 氧化为Ag,因此 t min 后银的
沉淀率逐渐降低。
【小问 4 详解】
联合提取银和锰的优势在于“浸锰”过程可将两种矿石中的锰元素同时提取到浸锰液中,将银元素和锰元素分离开,利用MnO2 的氧化性将FeS2 中的Fe2氧化为Fe3,同时生成的Fe3还可以用于浸银,节约氧化剂,同时得到MnSO4。
19. 资料显示,I2 可以将Cu 氧化为Cu2 。某小组同学设计实验探究Cu 被I2 氧化的产物及铜元素的价态。
已知:I2 易溶于KI溶液,发生反应I2 I I3 (红棕色);I2 和I3 氧化性几乎相同。
I.将等体积的KI溶液加入到mml铜粉和nmlI2(n m)的固体混合物中,振荡。
实验记录如下:
初始阶段,Cu 被氧化的反应速率:实验Ⅰ__________(填“>”“
相关试卷
这是一份2023年新高考北京化学高考真题文档版(含答案),文件包含高考北京卷化学真题docx、高考北京卷化学真题纯答案版docx等2份试卷配套教学资源,其中试卷共19页, 欢迎下载使用。
这是一份2023年新高考真题北京化学卷及答案解析,文件包含北京化学-解析pdf、北京化学-试题pdf等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。
这是一份2023年高考真题——化学(北京卷)无答案,共11页。










