


高中化学重要知识点易错点整理
展开排查点一
元素化合物
1.漂白粉可用于生活用水的消毒。
2.氢氧化铝可用于中和过多胃酸。
3.钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火。
4.钠与O 2的反应产物与反应条件有关,即使钠在少量O 2中燃烧也生成Na 2O 2。
5.常温下铁、铝遇浓HNO 3、浓H 2SO 4发生钝化。钝化并不是不反应,而是属于化学变化,钝化体现了浓HNO 3和浓H 2SO 4的强氧化性。
6.1 mol Na 2O 2固体中含离子总数为3 N A。
7.1 mol Na 2O 2参与反应转移电子的物质的量不一定为1 mol。
8.钠与盐溶液反应,不能置换出盐的金属。
9.往盛有足量NH 3的饱和NaCl溶液中通入足量的CO 2,反应方程式是:NaCl(饱和)+NH 3+CO 2+H 2O===NaHCO 3↓+NH 4Cl。
10.往BaCl 2、CaCl 2、Ba(NO 3) 2等溶液中通入CO 2气体不发生反应,而往Ca(ClO) 2、NaAlO 2、Na 2SiO 3溶液中通入CO 2发生反应。
11.往Ca(ClO) 2、Ba(NO 3) 2溶液中通入SO 2气体发生反应生成白色沉淀。
12.Al 2O 3、Al(OH) 3既能与盐酸,又能与氢氧化钠溶液反应。
13.Al 2O 3、MgO可用作耐高温材料。
14.并不是铝与所有金属氧化物均能组成铝热剂。
15.铁与氯气反应只能生成FeCl 3,氮气与氧气反应只能生成NO,硫在氧气中燃烧只生成二氧化硫,铁与足量稀HNO 3反应只生成硝酸铁。
16.Fe与O 2点燃Fe与H 2O(g)(高温)反应的固体产物都是Fe 3O 4而不是Fe 2O 3。
17.铜在潮湿的空气中最终不是生成CuO,而是生成铜绿[Cu 2(OH) 2CO 3]。
18.SiO 2可用于制光导纤维,硅可制光电池。
19.酸性氧化物一般能与水反应生成相应的酸,但SiO 2不溶于水;酸性氧化物一般不与酸作用,但SiO 2能与氢氟酸反应。
20.SO 2使含有酚酞的NaOH溶液褪色,表现SO 2酸性氧化物的性质;使品红溶液褪色,表现SO 2的漂白性;使溴水、酸性KMnO 4溶液褪色,表现SO 2的还原性;SO 2与H 2S反应,表现SO 2的氧化性;SO 2和Cl 2等体积混合通入溶液中,漂白性不但不增强,反而消失。
21.把SO 2气体通入BaCl 2溶液中,没有沉淀生成,但若通入NH 3或加入NaOH溶液,或把BaCl 2改成Ba(NO 3) 2均有白色沉淀生成,前两者生成BaSO 3沉淀,后者生成BaSO 4沉淀。
22.浓硝酸和Cu(足量)、浓硫酸和Cu(足量)、浓盐酸和MnO 2(足量)在反应时,随反应的进行,产物会发生变化或反应停止。
23.强氧化性酸(如HNO 3、浓硫酸)与金属反应不生成H 2;金属与浓硝酸反应一般生成NO 2,而金属与稀硝酸反应一般生成NO。
24.实验室制备NH 3,除了用Ca(OH) 2和NH 4Cl反应外,还可用浓氨水的分解(加NaOH固体或加CaO或加热)制取。而检验NH 4+需用NaOH溶液并加热,用湿润的红色石蕊试纸检验生成的气体,以确定NH4+的存在。
25.Cu和一定量的浓硝酸反应,产生的是NO 2和NO的混合气体,当Cu有剩余时,再加入稀硫酸,Cu可继续溶解。
排查点2
基本理论、基本概念
1.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物。
2.酸性氧化物不一定是非金属氧化物,非金属氧化物也不一定是酸性氧化物。
3.含有离子键的化合物一定是离子化合物,共价化合物一定不含离子键。
4.同种元素组成的物质可能是纯净物,也可能是混合物。
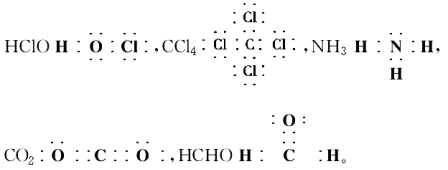
6.比例模型:如甲烷的比例模型:
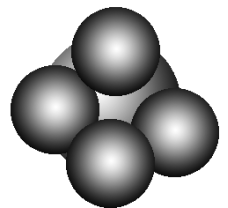
7.球棍模型:如甲烷的球棍模型:
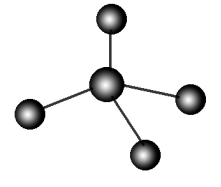
8.Cl、Br、I的+1价含氧酸的结构式都可用“
”表示。
9.熔融状态下能导电的化合物是离子化合物,熔融状态下不能导电的化合物是共价化合物。
10.ClO -不论在酸性环境中还是在碱性环境中均能体现强氧化性,如ClO -与SO 32-、I -、Fe 2+均不能大量共存;ClO -能水解,因HClO酸性很弱,ClO -水解使溶液显碱性,如Fe 3++3ClO -+3H 2O===Fe(OH) 3↓+3HClO,所以ClO -与Fe 3+、Al 3+均不能大量共存。
11.比较元素非金属性强弱时,应是该元素最高价氧化物对应水化物酸性的强弱,而不是非金属元素对应氢化物酸性的强弱。
12.化学键影响物质的化学性质,如稳定性等;分子间作用力和氢键影响物质的物理性质,如熔、沸点等。
13.常见吸热反应:所有盐的水解和电离过程、大多数的分解反应。
常见放热反应:燃烧、爆炸反应、金属与酸的置换、酸碱中和反应、2NO 2N 2O 4、大多数的化合反应是放热的。
14.原电池放电时,电解质溶液中的离子是阳离子向正极移动,阴离子向负极移动。
15.原电池充电时,电解质溶液中的离子是阳离子向负极移动,阴离子向正极移动。
16.原电池放电时,盐桥中的离子是阳离子向正极移动、阴离子向负极移动。
17.电解池里电解质溶液中离子的移动方向为:阳离子向阴极移动,阴离子向阳极移动。
18.钢铁的析氢腐蚀或吸氧腐蚀的负极反应均为Fe-2e -===Fe 2+。
19.金属腐蚀快慢与两极材料的活泼性有关,活泼性相差越大,金属腐蚀越快。
20.金属腐蚀快慢与接触介质有关,一般在非电解质溶液中的腐蚀较慢。
21.升高温度,不论吸热还是放热反应,也不论正反应速率还是逆反应速率都增大。
22.向恒温恒容已达平衡的反应体系中,充入“惰性气体”(不参加反应的气体),对平衡无影响。
23.增大压强(缩小体积),化学平衡向气体物质的量减小的方向移动,但 v 正、 v 逆均增大。
24.平衡常数 K 只受温度影响,既与任何一种反应物或生成物的浓度变化无关,也与压强的改变无关。
25.对于一个可逆反应,若升高温度, K 值增大,则正反应为吸热反应。
26.盐水解规律:有弱才水解,越弱越水解,谁强显谁性,同强显中性,越热越水解,越稀越水解。
27.除去酸性溶液ZnCl 2溶液中的FeCl 2,应先通入Cl 2或加入H 2O 2,再加入ZnO,使Fe 3+水解生成沉淀过滤除去。
28.FeCl 3、Fe 2(SO 4) 3的水溶液蒸干所得固体不同:FeCl 3溶液加热蒸干得Fe(OH) 3,灼烧Fe(OH) 3可得Fe 2O 3;Fe 2(SO 4) 3溶液蒸干仍为Fe 2(SO 4) 3。
29.弱酸酸式盐水溶液酸碱性,取决于酸式酸根离子电离程度和水解程度的相对大小。
30.碳酸钙与稀盐酸反应,实质是H +与沉淀溶解平衡中的CO 32-反应,促进平衡向生成离子的方向移动。
31.盐溶液蒸干后并灼烧,有的能得到原溶质,有的不能得到原溶质而转化成其他物质,有的得不到任何物质。
排查点3
化学实验
1.使用容量瓶、滴定管、分液漏斗第一步操作是“检漏”。
2.配制Fe 2+、Sn 2+等易水解、易被氧化的盐溶液,先把蒸馏水煮沸,再溶解,并加少量相应金属粉末和相应酸。
3.酸式滴定管不能装碱性溶液,碱式滴定管不能装酸性及氧化性溶液。
4.容量瓶不能长期存放溶液,更不能作为反应容器,也不可加热,瓶塞不可互用。
5.烧瓶、烧杯、锥形瓶不可直接加热。
6.能与盐酸反应产生有刺激性气味的无色气体,且产生的气体能使品红溶液褪色,加热又恢复原色的,只有SO32-和HSO3-。
7.点燃可燃性气体(如H 2、CO、CH 4、C 2H 4)或用CO、H 2还原Fe 2O 3、CuO之前,要检验气体的纯度。
8.制取有毒气体(如Cl 2、CO、SO 2、H 2S、NO 2、NO)时,应在通风橱中进行,且进行尾气处理。
9.加热法制取并用排水法收集气体或吸收溶解度较大的气体(如NH 3、HCl)时,要注意熄灯顺序或加装安全瓶。
排查点4
有机化学
1.淀粉、纤维素、蛋白质都是天然高分子化合物,它们都是混合物。
2.能与Na 2CO 3或NaHCO 3溶液反应放出CO 2或使石蕊试液变红的有机物中必含有—COOH。
3.能发生消去反应的有机物为醇或卤代烃。遇浓硝酸变黄,可推知该物质是含有苯环结构的蛋白质。遇碘水变蓝,可推知该物质为淀粉。加入过量浓溴水,出现白色沉淀,可推知该物质为苯酚或其衍生物。
4.能发生水解反应的有机物为卤代烃、酯、二糖、多糖、蛋白质或含有肽键的物质。
5.检验卤代烃中的卤元素时,在水解后的溶液中先加稀HNO 3再加AgNO 3溶液。
6.检验蔗糖、淀粉等是否水解时,先在水解后溶液中加NaOH溶液中和,后加银氨溶液或Cu(OH) 2悬浊液。








