

所属成套资源:新教材2023高中化学新人教版选择性必修1同步测试(36份)
新教材2023高中化学第一章化学反应的热效应章末整合提升新人教版选择性必修1 试卷
展开
这是一份新教材2023高中化学第一章化学反应的热效应章末整合提升新人教版选择性必修1,共5页。
化学反应的热效应章末整合提升 ![]()
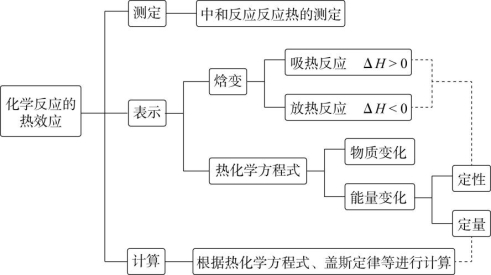
![]() 专题1 “五审法”判断热化学方程式的正误(1)审“+”“-”——放热反应ΔH一定为“-”,吸热反应ΔH一定为“+”。(2)审单位——单位一定为“kJ·mol-1”或“kJ/mol”,易错写成“kJ”或漏写。(3)审状态——物质的聚集状态必须正确,特别是溶液中的反应易写错。(4)审数值——反应热的数值必须与热化学方程式中的化学计量数相对应,即ΔH与化学计量数成正比。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。(5)审是否符合概念——如燃烧热(燃料的化学计量数为1,生成稳定的产物)。【例1】已知在25 ℃、101 kPa下,1 g C8H18(辛烷)完全燃烧生成二氧化碳和液态水时放出48.4 kJ热量。下列表示该反应的热化学方程式中正确的是 ( )A.C8H18(l)+
专题1 “五审法”判断热化学方程式的正误(1)审“+”“-”——放热反应ΔH一定为“-”,吸热反应ΔH一定为“+”。(2)审单位——单位一定为“kJ·mol-1”或“kJ/mol”,易错写成“kJ”或漏写。(3)审状态——物质的聚集状态必须正确,特别是溶液中的反应易写错。(4)审数值——反应热的数值必须与热化学方程式中的化学计量数相对应,即ΔH与化学计量数成正比。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。(5)审是否符合概念——如燃烧热(燃料的化学计量数为1,生成稳定的产物)。【例1】已知在25 ℃、101 kPa下,1 g C8H18(辛烷)完全燃烧生成二氧化碳和液态水时放出48.4 kJ热量。下列表示该反应的热化学方程式中正确的是 ( )A.C8H18(l)+![]() O2(g)
O2(g)![]() 8CO2(g)+9H2O(g) ΔH=-48.4 kJ/molB.C8H18(l)+
8CO2(g)+9H2O(g) ΔH=-48.4 kJ/molB.C8H18(l)+![]() O2(g)
O2(g)![]() 8CO2(g)+9H2O(l) ΔH=-5 517.6 kJ/molC.C8H18(l)+
8CO2(g)+9H2O(l) ΔH=-5 517.6 kJ/molC.C8H18(l)+![]() O2(g)
O2(g)![]() 8CO2(g)+9H2O(l) ΔH=+5 517.6 kJ/molD.C8H18(l)+
8CO2(g)+9H2O(l) ΔH=+5 517.6 kJ/molD.C8H18(l)+![]() O2(g)
O2(g)![]() 8CO2(g)+9H2O(l) ΔH=-48.4 kJ/mol【思维提示】解答本题的思维流程如下:(1)计算1 mol C8H18完全燃烧放出的能量——审数值排除A、D项。(2)明确燃烧反应是放热反应——审ΔH符号排除C项,确定B项正确。答案:B专题2 利用键能计算反应热的方法步骤(1)明确每个反应物和生成物分子中的化学键数目。(2)根据热化学方程式中各物质的化学计量数,计算反应物的总键能和生成物的总键能。(3)依据“ΔH=反应物的总键能-生成物的总键能”计算反应热。(4)注意ΔH的符号,若计算结果为负值,则ΔH为“-”,反之为“+”。【例2】工业上,在一定条件下利用乙烯与水蒸气反应制备乙醇:CH2
8CO2(g)+9H2O(l) ΔH=-48.4 kJ/mol【思维提示】解答本题的思维流程如下:(1)计算1 mol C8H18完全燃烧放出的能量——审数值排除A、D项。(2)明确燃烧反应是放热反应——审ΔH符号排除C项,确定B项正确。答案:B专题2 利用键能计算反应热的方法步骤(1)明确每个反应物和生成物分子中的化学键数目。(2)根据热化学方程式中各物质的化学计量数,计算反应物的总键能和生成物的总键能。(3)依据“ΔH=反应物的总键能-生成物的总键能”计算反应热。(4)注意ΔH的符号,若计算结果为负值,则ΔH为“-”,反之为“+”。【例2】工业上,在一定条件下利用乙烯与水蒸气反应制备乙醇:CH2![]() CH2(g)+H2O(g)
CH2(g)+H2O(g)![]() CH3CH2OH(g)。已知上述反应中相关的化学键键能如下表所示: 化学键C—HC
CH3CH2OH(g)。已知上述反应中相关的化学键键能如下表所示: 化学键C—HC![]() CO—HC—CC—O
CO—HC—CC—O![]() 413615463348351则该反应的ΔH= 。 【思维提示】解答本题的思维流程如下:(1)准确判断物质中的化学键数目;(2)根据“ΔH=反应物的总键能-生成物的总键能”列计算式;(3)计算得出结果:(615 kJ/mol+413 kJ/mol×4+463 kJ/mol×2)-(348 kJ/mol+413 kJ/mol×5+463 kJ/mol+351 kJ/mol)=-34 kJ/mol。答案:-34 kJ/mol专题3 应用盖斯定律计算ΔH的一般步骤
413615463348351则该反应的ΔH= 。 【思维提示】解答本题的思维流程如下:(1)准确判断物质中的化学键数目;(2)根据“ΔH=反应物的总键能-生成物的总键能”列计算式;(3)计算得出结果:(615 kJ/mol+413 kJ/mol×4+463 kJ/mol×2)-(348 kJ/mol+413 kJ/mol×5+463 kJ/mol+351 kJ/mol)=-34 kJ/mol。答案:-34 kJ/mol专题3 应用盖斯定律计算ΔH的一般步骤 【例3】CO2是一种廉价的碳资源,其综合利用对于缓解温室效应增强有积极的意义。CO2与CH4经催化重整后,可制得合成气,反应为CH4(g)+CO2(g)
【例3】CO2是一种廉价的碳资源,其综合利用对于缓解温室效应增强有积极的意义。CO2与CH4经催化重整后,可制得合成气,反应为CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。已知:①C(s)+2H2(g)
2CO(g)+2H2(g)。已知:①C(s)+2H2(g)![]() CH4(g) ΔH1=-75 kJ/mol②C(s)+O2(g)
CH4(g) ΔH1=-75 kJ/mol②C(s)+O2(g)![]() CO2(g) ΔH2=-394 kJ/mol③C(s)+
CO2(g) ΔH2=-394 kJ/mol③C(s)+![]() O2(g)
O2(g)![]() CO(g) ΔH3=-111 kJ/mol该催化重整反应的ΔH= kJ/mol。 【思维提示】根据盖斯定律,由2×③-①-②得CH4(g)+CO2(g)
CO(g) ΔH3=-111 kJ/mol该催化重整反应的ΔH= kJ/mol。 【思维提示】根据盖斯定律,由2×③-①-②得CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),故ΔH=2×(-111 kJ/mol)-(-75 kJ/mol)-(-394 kJ/mol)=+247 kJ/mol。答案:+247专题4 反应热的比较1.与“符号”相关的反应热比较对于放热反应来说,ΔH=-Q kJ/mol(Q>0),虽然“-”仅表示放热的意思,但在比较大小时要将其看成真正意义上的“负号”,即放热越多,ΔH反而越小。2.与“化学计量数”相关的反应热比较例如:H2(g)+
2CO(g)+2H2(g),故ΔH=2×(-111 kJ/mol)-(-75 kJ/mol)-(-394 kJ/mol)=+247 kJ/mol。答案:+247专题4 反应热的比较1.与“符号”相关的反应热比较对于放热反应来说,ΔH=-Q kJ/mol(Q>0),虽然“-”仅表示放热的意思,但在比较大小时要将其看成真正意义上的“负号”,即放热越多,ΔH反而越小。2.与“化学计量数”相关的反应热比较例如:H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH1=-a kJ/mol,2H2(g)+O2(g)
H2O(l) ΔH1=-a kJ/mol,2H2(g)+O2(g)![]() 2H2O(l) ΔH2=-b kJ/mol,a<b,ΔH1>ΔH2。3.与“物质聚集状态”相关的反应热比较(1)同一反应,生成物状态不同时。A(g)+B(g)
2H2O(l) ΔH2=-b kJ/mol,a<b,ΔH1>ΔH2。3.与“物质聚集状态”相关的反应热比较(1)同一反应,生成物状态不同时。A(g)+B(g)![]() C(g) ΔH1<0,A(g)+B(g)
C(g) ΔH1<0,A(g)+B(g)![]() C(l) ΔH2<0,因为C(g)
C(l) ΔH2<0,因为C(g)![]() C(l) ΔH3<0,则ΔH3=ΔH2-ΔH1,所以ΔH2<ΔH1。(2)同一反应,反应物状态不同时。S(g)+O2(g)
C(l) ΔH3<0,则ΔH3=ΔH2-ΔH1,所以ΔH2<ΔH1。(2)同一反应,反应物状态不同时。S(g)+O2(g)![]() SO2(g) ΔH1<0S(s)+O2(g)
SO2(g) ΔH1<0S(s)+O2(g)![]() SO2(g) ΔH2<0S(g)
SO2(g) ΔH2<0S(g)![]() S(s) ΔH3<0
S(s) ΔH3<0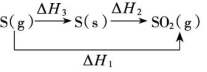 ΔH2+ΔH3=ΔH1,则ΔH3=ΔH1-ΔH2,又ΔH3<0,所以ΔH1<ΔH2。4.与“可逆反应”相关的反应热比较例如:3H2(g)+N2(g)
ΔH2+ΔH3=ΔH1,则ΔH3=ΔH1-ΔH2,又ΔH3<0,所以ΔH1<ΔH2。4.与“可逆反应”相关的反应热比较例如:3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,是指生成2 mol NH3(g)时放出92.4 kJ的热量,而不是3 mol H2(g)与 1 mol N2(g)混合在一定条件下反应就可放出92.4 kJ的热量,实际上3 mol H2(g)与1 mol N2(g)混合在一定条件下反应放出的热量小于 92.4 kJ,因为该反应的反应物不能完全转化为生成物。【例4】已知:C(s)+O2(g)
2NH3(g) ΔH=-92.4 kJ/mol,是指生成2 mol NH3(g)时放出92.4 kJ的热量,而不是3 mol H2(g)与 1 mol N2(g)混合在一定条件下反应就可放出92.4 kJ的热量,实际上3 mol H2(g)与1 mol N2(g)混合在一定条件下反应放出的热量小于 92.4 kJ,因为该反应的反应物不能完全转化为生成物。【例4】已知:C(s)+O2(g)![]() CO2(g) ΔH1CO2(g)+C(s)
CO2(g) ΔH1CO2(g)+C(s)![]() 2CO(g) ΔH22CO(g)+O2(g)
2CO(g) ΔH22CO(g)+O2(g)![]() 2CO2(g) ΔH32Cu(s)+O2(g)
2CO2(g) ΔH32Cu(s)+O2(g)![]() 2CuO(s) ΔH4CO(g)+CuO(s)
2CuO(s) ΔH4CO(g)+CuO(s)![]() CO2(g)+Cu(s) ΔH5下列关于上述反应焓变的判断中正确的是 ( )A.ΔH1>0,ΔH3<0 B.ΔH2<0,ΔH4>0C.ΔH2=ΔH1-ΔH3 D.ΔH3=ΔH4+ΔH5答案:C【例5】在同温同压下,下列各组热化学方程式中,Q2>Q1的是 ( )A.2H2(g)+O2(g)
CO2(g)+Cu(s) ΔH5下列关于上述反应焓变的判断中正确的是 ( )A.ΔH1>0,ΔH3<0 B.ΔH2<0,ΔH4>0C.ΔH2=ΔH1-ΔH3 D.ΔH3=ΔH4+ΔH5答案:C【例5】在同温同压下,下列各组热化学方程式中,Q2>Q1的是 ( )A.2H2(g)+O2(g)![]() 2H2O(l) ΔH=-Q1 kJ/mol2H2(g)+O2(g)
2H2O(l) ΔH=-Q1 kJ/mol2H2(g)+O2(g)![]() 2H2O(g) ΔH=-Q2 kJ/molB.S(g)+O2(g)
2H2O(g) ΔH=-Q2 kJ/molB.S(g)+O2(g)![]() SO2(g) ΔH=-Q1 kJ/molS(s)+O2(g)
SO2(g) ΔH=-Q1 kJ/molS(s)+O2(g)![]() SO2(g) ΔH=-Q2 kJ/molC.C(s)+
SO2(g) ΔH=-Q2 kJ/molC.C(s)+![]() O2(g)
O2(g)![]() CO(g) ΔH=-Q1 kJ/molC(s)+O2(g)
CO(g) ΔH=-Q1 kJ/molC(s)+O2(g)![]() CO2(g) ΔH=-Q2 kJ/molD.H2(g)+Cl2(g)
CO2(g) ΔH=-Q2 kJ/molD.H2(g)+Cl2(g)![]() 2HCl(g) ΔH=-Q1 kJ/mol
2HCl(g) ΔH=-Q1 kJ/mol![]() H2(g)+
H2(g)+![]() Cl2(g)
Cl2(g)![]() HCl(g) ΔH=-Q2 kJ/mol答案:C
HCl(g) ΔH=-Q2 kJ/mol答案:C






