


人教版 (2019)选择性必修1第一节 反应热复习练习题
展开第一节 反应热
课时2 热化学方程式 燃烧热
【基础巩固】
1.下列说法中错误的是 ( )
A.热化学方程式各物质前的化学计量数不能表示粒子个数,只代表物质的物质的量
B.热化学方程式未注明温度和压强时,ΔH表示 0 ℃、101 kPa时的数据
C.同一反应化学计量数不同,ΔH不同,化学计量数相同而物质的状态不同,ΔH不相同
D.化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比
解析:热化学方程式各物质前的化学计量数不表示粒子个数,只代表物质的物质的量,可以是分数和整数,A项正确;在书写热化学方程式时要注明温度和压强,未注明温度和压强时,ΔH表示25 ℃、101 kPa下测得的数据,B项错误;化学反应热与物质的状态和物质的量有关,同一化学反应,化学计量数不同,ΔH不同,化学计量数相同而物质的状态不同,ΔH也不相同,C项正确;化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比,D项正确。
答案:B
2.热化学方程式C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.5 kJ/mol表示 ( )
CO(g)+H2(g) ΔH=+131.5 kJ/mol表示 ( )
A.碳与水反应吸收131.5 kJ热量
B.1 mol碳与1 mol水反应生成一氧化碳和氢气,并吸收131.5 kJ热量
C.1 mol固态碳与1 mol水蒸气反应生成 1 mol 一氧化碳气体和1 mol氢气,并吸收131.5 kJ热量
D.1个固态碳原子与1分子水蒸气反应吸收131.5 kJ热量
解析:ΔH的数值要与热化学方程式中物质的化学计量数、状态相对应,A、B项错误,C项正确;热化学方程式中的化学计量数表示对应物质的物质的量,D项错误。
答案:C
3.N2H4是一种高效、清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出136 kJ热量。则下列热化学方程式中正确的是 ( )
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)
O2(g)![]()
![]() N2(g)+H2O(g) ΔH=+272 kJ/mol
N2(g)+H2O(g) ΔH=+272 kJ/mol
B.N2H4(g)+O2(g)![]() N2(g)+2H2O(g) ΔH=-544 kJ/mol
N2(g)+2H2O(g) ΔH=-544 kJ/mol
C.N2H4(g)+O2(g)![]() N2(g)+2H2O(g) ΔH=+544 kJ/mol
N2(g)+2H2O(g) ΔH=+544 kJ/mol
D.N2H4(g)+O2(g)![]() N2(g)+2H2O(l) ΔH=-136 kJ/mol
N2(g)+2H2O(l) ΔH=-136 kJ/mol
解析:该反应为放热反应,A、C项错误;0.25 mol N2H4(g)完全燃烧生成氮气和气态水,放出136 kJ热量,则1 mol N2H4(g)完全燃烧生成氮气和气态水放出热量为544 kJ,B项正确、D项错误。
答案:B
4.(2022·辽宁沈阳)下列有关说法正确的是 ( )
A.已知:①C(s,石墨)+O2(g)![]() CO2(g) ΔH1=-393.5 mol/L;②C(s,金刚石)+O2(g)
CO2(g) ΔH1=-393.5 mol/L;②C(s,金刚石)+O2(g)![]() CO2(g) ΔH2=-395.0 mol/L。则石墨比金刚石稳定
CO2(g) ΔH2=-395.0 mol/L。则石墨比金刚石稳定
B.在101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ/mol
C.中和热实验测定时,可以用铜棒代替易碎的玻璃搅拌器
D.在一定温度和压强下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3 kJ,则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ/mol
2NH3(g) ΔH=-38.6 kJ/mol
解析:石墨的化学能小于金刚石的化学能,化学能越高,物质稳定性越差,故石墨比金刚石稳定,A项正确;燃烧热指在25 ℃、101 kPa时,
1 mol 纯物质完全燃烧生成指定产物时所放出的热量,题中未指明环境温度,故无法定义H2燃烧热,B项错误;铜是金属,导热性好,所以中和热测定时用铜棒代替玻璃搅拌器搅拌,测定反应的最高温度偏小,不能达到实验目的,C项错误;N2(g)+3H2(g)![]() 2NH3(g)反应为可逆反应,实际测得的放热值比理论值偏小,热化学方程式ΔH为理论值,是生成物总能量与反应物总能量的差值,故不能根据实际反应放热得出反应热,D项错误。
2NH3(g)反应为可逆反应,实际测得的放热值比理论值偏小,热化学方程式ΔH为理论值,是生成物总能量与反应物总能量的差值,故不能根据实际反应放热得出反应热,D项错误。
答案:A
5.据悉,长征系列火箭的燃料为偏二甲肼![]() 。已知:1.5 g偏二甲肼完全燃烧生成稳定产物放出50 kJ热量,则偏二甲肼的燃烧热为 ( )
。已知:1.5 g偏二甲肼完全燃烧生成稳定产物放出50 kJ热量,则偏二甲肼的燃烧热为 ( )
A.1 000 kJ/mol B.1 500 kJ/mol
C.2 000 kJ/mol D.3 000 kJ/mol
解析:由偏二甲肼的摩尔质量为60 g/mol得n=![]() =0.025 mol,所以偏二甲肼的燃烧热为
=0.025 mol,所以偏二甲肼的燃烧热为![]() =2 000 kJ/mol。
=2 000 kJ/mol。
答案:C
6.已知1.2 g C(石墨,s)不完全燃烧生成CO,放出11.1 kJ热量,继续燃烧生成CO2,又放出28.3 kJ热量,则下列能表示C(石墨,s)燃烧热的热化学方程式的是 ( )
A.C(石墨,s)+![]() O2(g)
O2(g)![]() CO(g) ΔH=-11.1 kJ/mol
CO(g) ΔH=-11.1 kJ/mol
B.C(石墨,s)+![]() O2(g)
O2(g)![]() CO(g) ΔH=-111.1 kJ/mol
CO(g) ΔH=-111.1 kJ/mol
C.C(石墨,s)+O2(g)![]() CO2(g) ΔH=-394 kJ/mol
CO2(g) ΔH=-394 kJ/mol
D.C(石墨,s)+O2(g)![]() CO2(g) ΔH=-28.3 kJ/mol
CO2(g) ΔH=-28.3 kJ/mol
解析:1.2 g石墨的物质的量为0.1 mol,其完全燃烧生成指定产物CO2(g)时放热11.1 kJ+28.3 kJ=39.4 kJ,故石墨的燃烧热为
394 kJ/mol。
答案:C
7.氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)燃烧的热化学方程式分别如下:
H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH=-285.8 kJ/mol
H2O(l) ΔH=-285.8 kJ/mol
CO(g)+![]() O2(g)
O2(g)![]() CO2(g) ΔH=-283.0 kJ/mol
CO2(g) ΔH=-283.0 kJ/mol
C8H18(l)+![]() O2(g)
O2(g)![]() 8CO2(g)+9H2O(l) ΔH=-5 518.0 kJ/mol
8CO2(g)+9H2O(l) ΔH=-5 518.0 kJ/mol
CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol
CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是 ( )
A.H2(g) B.CO(g) C.C8H18(l) D.CH4(g)
解析:假设H2、CO、C8H18、CH4的质量均为m g,由热化学方程式可知,m g的H2(g)、CO(g)、C8H18(l)、CH4(g)完全燃烧放出的热量分别为![]() ×
×
285.8 kJ=142.9m kJ、![]() ×283.0 kJ≈10.1m kJ、
×283.0 kJ≈10.1m kJ、![]() ×5 518.0 kJ≈48.4m kJ、
×5 518.0 kJ≈48.4m kJ、![]() ×890.3 kJ≈55.6m kJ,比较可知B项正确。
×890.3 kJ≈55.6m kJ,比较可知B项正确。
答案:B
8.25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是
393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式中正确的是 ( )
A.C(s)+![]() O2(g)
O2(g)![]() CO(g) ΔH=-393.5 kJ/mol
CO(g) ΔH=-393.5 kJ/mol
B.2H2(g)+O2(g)![]() 2H2O(g) ΔH=-571.6 kJ/mol
2H2O(g) ΔH=-571.6 kJ/mol
C.CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH=-890.3 kJ/mol
CO2(g)+2H2O(g) ΔH=-890.3 kJ/mol
D.![]() C6H12O6(s)+3O2(g)
C6H12O6(s)+3O2(g)![]() 3CO2(g)+3H2O(l) ΔH=-1 400 kJ/mol
3CO2(g)+3H2O(l) ΔH=-1 400 kJ/mol
解析:根据燃烧热的概念及生成指定产物的含义可知,碳元素应变为CO2,生成的H2O应该为液态,故只有D项正确。
答案:D
9.碳是形成化合物种类最多的元素,其单质及化合物是人类生产、生活的主要能源物质。请回答下列问题。
(1)已知CH3OH(l)的燃烧热为726.5 kJ/mol,CH3OH(l)+![]() O2(g)
O2(g)![]()
CO2(g)+2H2(g) ΔH=-a kJ/mol,则a (填“>”“<”或“=”)726.5。
(2)使Cl2与H2O(g)通过灼热的炭层,生成HCl(g)和CO2,当有1 mol Cl2参加反应时释放出145 kJ热量,写出该反应的热化学方程式:
。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合,并在高温下煅烧,所得物质可作耐高温材料。该反应化学方程式为4Al(s)+3TiO2(s)+3C(s)![]() 2Al2O3(s)+3TiC(s)
2Al2O3(s)+3TiC(s)
ΔH=-1 176 kJ/mol,则反应过程中,每转移 1 mol 电子放出的热量为 。
解析:(1)甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量少,故a<726.5。(2)根据题意确定化学方程式为2Cl2+2H2O+C![]() 4HCl+
4HCl+
CO2,2 mol Cl2参加反应放出热量为2×145 kJ=290 kJ,故该反应的热化学方程式为2Cl2(g)+2H2O(g)+C(s)![]() 4HCl(g)+CO2(g) ΔH=
4HCl(g)+CO2(g) ΔH=
-290 kJ/mol。(3)所给反应中转移12 mol 电子放出的热量为1 176 kJ,故每转移1 mol电子放出的热量为1 176 kJ÷12=98 kJ。
答案:(1)< (2)2Cl2(g)+2H2O(g)+C(s)![]() 4HCl(g)+CO2(g) ΔH=
4HCl(g)+CO2(g) ΔH=
-290 kJ/mol (3)98 kJ
【拓展提高】
10.已知1 mol燃料完全燃烧的数据如下表:
燃料 | 一氧化碳 | 甲烷 | 辛烷(C8H18) | 乙醇 |
| -283.0 | -890.3 | -5 518.0 | -1 366.8 |
使用上述燃料最能体现“低碳经济”理念的是 ( )
A.一氧化碳 B.甲烷 C.辛烷 D.乙醇
解析:低碳经济即尽可能地减少煤炭、石油等高碳能源消耗,减少温室气体排放,达到经济社会发展与生态环境保护双赢的一种经济发展形态。要求使用的燃料最能体现“低碳经济”的理念,即每生成 1 mol 二氧化碳时,放出热量最多的物质符合题意。生成1 mol CO2时各物质放出的热量分别为:一氧化碳283.0 kJ,甲烷890.3 kJ,辛烷(C8H18)![]() ≈689.8 kJ,乙醇
≈689.8 kJ,乙醇![]() =683.4 kJ。故B项正确。
=683.4 kJ。故B项正确。
答案:B
11.(2022·天津)研究污染物NO2、NO、CO的处理,对建设美丽中国具有重要意义。反应NO2(g)+CO(g)![]() NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是 ( )
NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是 ( )
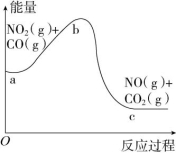
A.图中a→b为放热过程
B.理论上该反应可以设计成原电池
C.该反应转移的电子数为e-
D.1 mol NO2(g)和1 mol CO(g)的总能量低于1 mol NO(g)和1 mol CO2(g)的总能量
解析:a→b总能量增大,为吸热过程,A项错误;该反应属于氧化还原反应,有电子转移,理论上该反应可以设计成原电池,B项正确;没有给出参与反应的反应物的量,无法计算转移的电子数,C项错误;由图可知,1 mol NO2(g)和1 mol CO(g)的总能量高于1 mol NO(g)和1 mol CO2(g)的总能量,D项错误。
答案:B
【挑战创新】
12.中国“嫦娥四号”探测器成功在月球背面软着陆,成为人类首次在月球背面软着陆的探测器,首次实现月球背面与地面站通过中继卫星通信。
(1)发射“嫦娥四号”的“长征三号”乙运载火箭的第三级使用的推进剂是液氢和液氧,这种推进剂的优点是 ;
(请写出两条)。
(2)下列是298 K时,氢气(H2)、碳(C)、辛烷(C8H18)、甲烷(CH4)燃烧的热化学方程式:
H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH=-285.8 kJ/mol
H2O(l) ΔH=-285.8 kJ/mol
C(s)+O2(g)![]() CO2(g) ΔH=-393.5 kJ/mol
CO2(g) ΔH=-393.5 kJ/mol
C8H18(l)+![]() O2(g)
O2(g)![]() 8CO2(g)+9H2O(l) ΔH=-5 518 kJ/mol
8CO2(g)+9H2O(l) ΔH=-5 518 kJ/mol
CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol
CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol
相同质量的H2、C、C8H18、CH4完全燃烧时,放出热量最多的是 ,通过计算说明等质量的氢气和碳燃烧时产生热量的比是
(结果精确到0.1)。
解析:(1)相同质量的H2比其他燃料燃烧放出的热量多,产物H2O不对大气造成污染。(2)根据各物质的燃烧热数据可算出,等质量的H2、C、C8H18、CH4完全燃烧时,H2放出热量最多,等质量的H2和C燃烧产生的热量比为285.8∶![]() ≈4.4∶1。
≈4.4∶1。
答案:(1)相同质量时,氢气放出的热量多 产物为水,无污染(或其他合理答案) (2)H2 4.4∶1
人教版 (2019)选择性必修1第一节 反应热复习练习题: 这是一份人教版 (2019)选择性必修1第一节 反应热复习练习题,共11页。
高中化学人教版 (2019)选择性必修1第一节 反应热第二课时同步达标检测题: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热第二课时同步达标检测题,共11页。试卷主要包含了 下列热化学方程式中,正确的是, 已知, 已知下列热化学方程式, 请回答下列问题等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 反应热第2课时达标测试: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热第2课时达标测试,共4页。试卷主要包含了3 kJ·ml-1,含NaOH 20,7 kJ·ml-1,4 kJ·ml-1,写出下列反应的热化学方程式等内容,欢迎下载使用。













