

- 新教材2023高中化学第一章化学反应的热效应第二节反应热的计算同步测试新人教版选择性必修1 试卷 0 次下载
- 新教材2023高中化学章末质量评估第二章化学反应速率与化学平衡新人教版选择性必修1 试卷 试卷 0 次下载
- 新教材2023高中化学第二章化学反应速率与化学平衡第一节化学反应速率课时1化学反应速率同步测试新人教版选择性必修1 试卷 0 次下载
- 新教材2023高中化学第二章化学反应速率与化学平衡第一节化学反应速率课时2影响化学反应速率的因素活化能同步测试新人教版选择性必修1 试卷 0 次下载
- 新教材2023高中化学第二章化学反应速率与化学平衡第三节化学反应的方向同步测试新人教版选择性必修1 试卷 0 次下载
新教材2023高中化学第二章化学反应速率与化学平衡章末整合提升新人教版选择性必修1 试卷
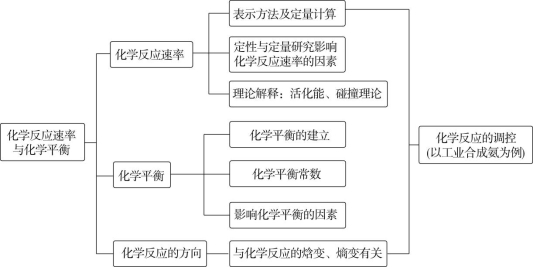
展开第二章 化学反应速率与化学平衡
章末整合提升
![]()
![]()
专题1 “控制变量”思想探究化学反应速率的影响因素
“控制变量”实验探究题主要是以表格或图像的形式给出多组实验数据,让学生找出每组数据的变化对化学反应速率的影响,或给出影响化学反应速率的几种因素,让学生设计实验分析各因素对化学反应速率的影响。它能够很好地考查学生的实验设计与探究能力、比较归纳能力、数据分析与处理能力、信息提炼能力、知识迁移与应用能力。解答该类题目的方法思路如下。
(1)确定变量:解答这类题目时首先要认真审题,厘清影响实验探究结果的因素有哪些。
(2)定多变一:在探究时,应该先确定其他因素不变,只变化一种因素,看这种因素与探究的问题存在怎样的关系;这样确定一种以后,再确定另一种,通过分析每种因素与所探究问题之间的关系,得出所有影响因素与所探究问题之间的关系。
(3)数据有效:解答时注意选择数据(或设置实验)要有效,且变量统一,否则无法作出正确判断。
【例1】I-可以作为水溶液中SO2自身发生氧化还原反应的催化剂,可能的催化过程如下:
Ⅰ.SO2+4I-+4H+![]() S↓+2I2+2H2O
S↓+2I2+2H2O
Ⅱ.I2+2H2O+ ![]() + +2I-
+ +2I-
(1)将反应Ⅱ补充完整。
(2)探究Ⅰ、Ⅱ的反应速率与SO2自身发生氧化还原反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解于KI溶液中)
序号 | 试剂组成 | 实验现象 |
A | 0.4 mol/L KI | 溶液变黄,一段时间后出现浑浊 |
B | a mol/L KI 0.2 mol/L H2SO4 | 溶液变黄,出现浑浊比A快 |
C | 0.2 mol/LH2SO4 | 无明显现象 |
D | 0.2 mol/L KI 0.000 2 mol I2 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊比A快 |
② B是A的对比实验,则a= 。
②比较A、B、C,可得出的结论是 。
③实验表明,SO2的自身氧化还原反应速率D>A,结合Ⅰ、Ⅱ反应速率解释原因: 。
【思维提示】(1)根据SO2自身发生氧化还原反应,则反应Ⅰ生成S,则反应Ⅱ需生成H2SO4,即I2将SO2氧化为H2SO4,反应的离子方程式为I2+2H2O+SO2![]() S
S![]() +4H++2I-。(2)①对比实验只能存在一个变量,因实验B比实验A多了H2SO4,则B中KI溶液的浓度应不变,故a=0.4。②由表中实验现象可知,I-是SO2自身发生氧化还原反应的催化剂,H+单独存在时不具有催化作用,但H+可以增大反应速率。③加入少量I2时,反应明显加快,说明反应Ⅱ比反应Ⅰ快;D中由反应Ⅱ产生的H+使反应Ⅰ加快。
+4H++2I-。(2)①对比实验只能存在一个变量,因实验B比实验A多了H2SO4,则B中KI溶液的浓度应不变,故a=0.4。②由表中实验现象可知,I-是SO2自身发生氧化还原反应的催化剂,H+单独存在时不具有催化作用,但H+可以增大反应速率。③加入少量I2时,反应明显加快,说明反应Ⅱ比反应Ⅰ快;D中由反应Ⅱ产生的H+使反应Ⅰ加快。
答案:(1)SO2 S![]() 4H+ (2)①0.4 ②I-是SO2自身发生氧化还原反应的催化剂,H+单独存在时不具有催化作用,但H+可以增大反应速率 ③反应Ⅱ比Ⅰ快;D中由反应Ⅱ产生的H+使反应Ⅰ加快
4H+ (2)①0.4 ②I-是SO2自身发生氧化还原反应的催化剂,H+单独存在时不具有催化作用,但H+可以增大反应速率 ③反应Ⅱ比Ⅰ快;D中由反应Ⅱ产生的H+使反应Ⅰ加快
专题2 关于平衡转化率的变化规律
1.对于反应aA(g)+bB(g)![]() cC(g)+dD(g)
cC(g)+dD(g)
(1)增加反应物的量对转化率的影响(恒温恒容)。
①若增加A的量,则α(A)减小,α(B)增大。
②若成比例增加A、B的量,平衡正向移动,但转化率出现以下三种变化情况。
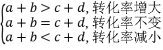
注:此时可虚拟一个路径来理解转化率的变化。如:
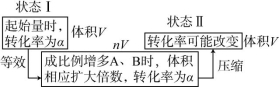
(2)若将相同量的物质充入以下四种容器,(起始V相同),则转化率的比较如下。
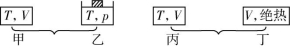
①无论a+b>c+d,还是a+b<c+d,转化率:乙>甲。
②无论ΔH>0,还是ΔH<0,转化率:丙>丁。
2.对于反应aA(g)![]() bB(g)+cC(g)
bB(g)+cC(g)
若增加A的量(恒温恒容),则转化率变化如下:
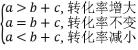
【例2】 反应:X(g)+Y(g)![]() 2Z(g) ΔH<0,达到平衡时,下列说法中不正确的是 ( )
2Z(g) ΔH<0,达到平衡时,下列说法中不正确的是 ( )
A.缩小容器容积,平衡不移动,X的转化率不变
B.增大c(X),X的转化率减小
C.保持容器容积不变,同时充入0.1 mol X和 0.1 mol Y,X的转化率不变
D.加入催化剂,正反应速率增大,Z的产率增大
【思维提示】解答本题的思维流程如下:
(1)明确反应的特点(物质的状态、化学计量数、热效应);
(2)分析条件改变—速率是否改变—平衡是否移动;
(3)结合平衡移动原理及转化率、产率等相关概念综合分析;
(4)逐项分析,得出正确判断。
答案:D
专题3 关于化学平衡移动的判断方法
1.根据勒夏特列原理判断
如果改变影响平衡的一个条件(如浓度、压强或温度等)平衡就向能够减弱这种改变的方向移动。
2.根据图示中v正、v逆的相对大小判断
(1)若v正>v逆,平衡向正反应方向移动(注意v正增大,平衡不一定向正反应方向移动);
(2)若v正<v逆,则平衡向逆反应方向移动;
(3)若v正=v逆,则平衡不移动。
3.根据平衡常数与浓度商的相对大小判断
(1)若K>Q,则平衡向正反应方向移动;
(2)若K<Q,则平衡向逆反应方向移动;
(3)若K=Q,则平衡不移动。
【例3】室温下,向圆底烧瓶中加入1 mol C2H5OH 与含1 mol HBr的氢溴酸,溶液中发生反应:C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br 和C2H5OH的沸点分别为 38.4 ℃和78.5 ℃。下列有关叙述中错误的是 ( )
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br 和C2H5OH的沸点分别为 38.4 ℃和78.5 ℃。下列有关叙述中错误的是 ( )
A.加入NaOH,可增大乙醇的物质的量
B.增大HBr浓度,有利于生成C2H5Br
C.若反应物均增大至2 mol,则两种反应物平衡转化率之比不变
D.若起始温度提高至60 ℃,可缩短反应达到平衡的时间
【思维提示】解答该类题目的思维模型如下:
(1)关注容器的特点——恒温恒容,恒温恒压;
反应的特点——物质状态,ΔVg是否为0,ΔH的正负。
(2)分析条件(浓度、温度、压强等)的变化。
(3)判断移动的方向(联想平衡移动原理)。
(4)综合分析、判断,得出结论。
答案:D









