

- 新教材2023高中化学第二章化学反应速率与化学平衡第一节化学反应速率课时1化学反应速率同步测试新人教版选择性必修1 试卷 0 次下载
- 新教材2023高中化学第二章化学反应速率与化学平衡第一节化学反应速率课时2影响化学反应速率的因素活化能同步测试新人教版选择性必修1 试卷 0 次下载
- 新教材2023高中化学第二章化学反应速率与化学平衡第二节化学平衡课时1化学平衡状态同步测试新人教版选择性必修1 试卷 0 次下载
- 新教材2023高中化学第二章化学反应速率与化学平衡第二节化学平衡课时2化学平衡常数同步测试新人教版选择性必修1 试卷 0 次下载
- 新教材2023高中化学第二章化学反应速率与化学平衡第二节化学平衡课时3影响化学平衡的因素同步测试新人教版选择性必修1 试卷 0 次下载
人教版 (2019)选择性必修1第三节 化学反应的方向同步达标检测题
展开第三节 化学反应的方向
【基础巩固】
1.下列说法中正确的是 ( )
A.凡是放热反应都是自发的,凡是吸热反应都是非自发的
B.自发反应熵一定增大,非自发反应熵一定减小或不变
C.自发反应在适当条件下才能实现
D.自发反应在任何条件下都能实现
解析:放热反应大多是能够自发进行的过程,而吸热反应有些也是自发反应;自发反应的熵不一定增大,可能减小,也可能不变;过程的自发性只能用于判断过程的方向,反应是否能实现还要看具体的条件。
答案:C
2.以下自发反应可用焓判据来解释的是( )
A.硝酸铵自发溶于水
B.2N2O5(g)![]() 4NO2(g)+O2(g) ΔH=+109.8 kJ/mol
4NO2(g)+O2(g) ΔH=+109.8 kJ/mol
C.(NH4)2CO3(s)![]() NH4HCO3(s)+NH3(g)ΔH=+74.9 kJ/mol
NH4HCO3(s)+NH3(g)ΔH=+74.9 kJ/mol
D.2H2(g)+O2(g)![]() 2H2O(l) ΔH=-571.6 kJ/mol
2H2O(l) ΔH=-571.6 kJ/mol
解析:焓判据能够说明放热反应为自发反应,而A、B、C项三个自发过程均为吸热过程,显然不能单用焓判据来解释,只有D项可以用焓判据来解释。
答案:D
3.“熵”表示体系的混乱程度,它的符号是“S”。下列变化中,ΔS<0的是 ( )
A.3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
B.2NO2(g)![]() N2O4(l)
N2O4(l)
C.2IBr(l)![]() I2(s)+Br2(g)
I2(s)+Br2(g)
D.(NH4)2CO3(s)![]() 2NH3(g)+CO2(g)+H2O(g)
2NH3(g)+CO2(g)+H2O(g)
解析:B项中的反应是由气体转化为液体,混乱程度减小,ΔS<0。
答案:B
4.水结冰的过程的焓变和熵变正确的是( )
A.ΔH>0,ΔS<0 B.ΔH<0,ΔS>0
C.ΔH>0,ΔS>0 D.ΔH<0,ΔS<0
解析:H2O(l)→H2O(s)为ΔS<0的放热(ΔH<0)过程。
答案:D
5.汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,其反应原理是2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。由此可知,下列说法中正确的是 ( )
N2(g)+2CO2(g)。由此可知,下列说法中正确的是 ( )
A.该反应是熵增大的反应
B.该反应不能自发进行,因此需要合适的催化剂
C.该反应常温下能自发进行,催化剂条件只是增大反应的速率
D.该反应常温下能自发进行,因为正反应是吸热反应
解析:只使用催化剂便可使尾气发生转化,故此反应能自发进行。因反应是气体物质的量减小的反应,故熵减小。因熵减小不利于反应自发进行,故自发进行的原因是反应放热。
答案:C
6.下列对熵变的判断中不正确的是 ( )
A.少量的食盐溶于水中:ΔS>0
B.炭与氧气反应生成CO(g):ΔS>0
C.气态水变成液态水:ΔS>0
D.CaCO3(s)受热分解为CaO(s)和CO2(g):ΔS>0
解析:食盐溶于水是典型的熵增加过程;2C(s)+O2(g)![]() 2CO(g),气体的物质的量增大,为熵增加的反应;气态水变成液态水是体系混乱程度减小的过程,为熵减小的过程;CaCO3(s)的分解产生了气体,为熵增加的反应。
2CO(g),气体的物质的量增大,为熵增加的反应;气态水变成液态水是体系混乱程度减小的过程,为熵减小的过程;CaCO3(s)的分解产生了气体,为熵增加的反应。
答案:C
7.下列反应过程中,ΔH>0且ΔS>0的是 ( )
A.NH3(g)+HCl(g)![]() NH4Cl(s)
NH4Cl(s)
B.CaCO3(s)![]() CaO(s)+CO2(g)
CaO(s)+CO2(g)
C.4Al(s)+3O2(g)![]() 2Al2O3(s)
2Al2O3(s)
D.HCl(aq)+NaOH(aq)![]() NaCl(aq)+H2O(l)
NaCl(aq)+H2O(l)
解析:A项是熵减的放热反应,C项是熵减的放热反应,D项是放热反应。
答案:B
8.25 ℃、1.01×105 Pa时,反应2N2O5(g)![]() 4NO2(g)+O2(g) ΔH=
4NO2(g)+O2(g) ΔH=
+109.8 kJ/mol,自发进行的原因是该反应 ( )
A.是吸热反应 B.是放热反应
C.是熵减反应 D.熵增效应大于焓增效应
解析:由所给的热化学方程式可知,该反应为熵增加的吸热反应,其中熵增效应大于焓增效应是自发进行的原因。
答案:D
9.实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应过程中能量(单位为kJ/mol)的变化。
CH3OH(g)+H2O(g),如图表示该反应过程中能量(单位为kJ/mol)的变化。
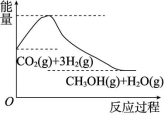
下列关于该反应的说法中,正确的是 ( )
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS<0 D.ΔH<0,ΔS>0
解析:根据反应过程中能量变化的情况可知反应物的总能量高于生成物的总能量,反应放热,ΔH<0;该反应发生后气体的物质的量减小, ΔS<0。
答案:C
10.在化学反应A(g)+B(g)![]() 2C(g)+D(g) ΔH=Q kJ/mol过程中的能量变化如图所示,回答下列问题。
2C(g)+D(g) ΔH=Q kJ/mol过程中的能量变化如图所示,回答下列问题。
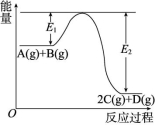
(1)Q (填“>”“<”或“=”)0。
(2)熵变ΔS (填“>”“<”或“=”)0。
(3)该反应 (填“能”或“不能”)自发进行。
(4)升高温度,平衡常数K (填“增大”“减小”或“不变”),平衡向 方向移动。
解析:(1)根据图像可知,该反应是放热反应,故Q<0。(2)根据反应特点可知,该反应是熵增大的反应。(3)根据ΔG=ΔH-TΔS<0可知,该反应能自发进行。(4)升高温度,平衡向逆反应方向移动,平衡常数减小。
答案:(1)< (2)> (3)能 (4)减小 逆反应
【拓展提高】
11.反应CH3OH(l)+NH3(g)![]() CH3NH2(g)+H2O(g)在一定温度下才能自发向右进行,若反应的|ΔH|=17 kJ/mol,|ΔH-TΔS|=17 kJ/mol,则下列说法中正确的是 ( )
CH3NH2(g)+H2O(g)在一定温度下才能自发向右进行,若反应的|ΔH|=17 kJ/mol,|ΔH-TΔS|=17 kJ/mol,则下列说法中正确的是 ( )
A.ΔH>0,ΔH-TΔS<0 B.ΔH<0,ΔH-TΔS>0
C.ΔH>0,ΔH-TΔS>0 D.ΔH<0,ΔH-TΔS<0
解析:该反应在一定温度下能够自发地向右进行,这说明ΔH-TΔS一定小于0,根据化学方程式可知该反应的ΔS>0,所以如果ΔH<0,则该反应在任何温度下都能自发进行,而该反应在一定温度下才能自发地向右进行,因此该反应的反应热ΔH>0,故选A项。
答案:A
12.下列内容与结论不对应的是 ( )
选项 | 内容 | 结论 |
A | 一个反应的ΔH>0,ΔS>0 | 反应一定不能自发进行 |
B | 硝酸铵溶于水可自发进行 | 因为该反应的ΔS>0 |
C | H2O(g)变成H2O(l) | ΔS<0 |
D | H2(g)+F2(g) ΔH=-271 kJ/mol,ΔS=+8 J/(mol·K) | 反应在任意温度下都能自发进行 |
解析:根据ΔG=ΔH-TΔS可知,如果一个反应的ΔH>0、ΔS>0,则在高温下可以自发进行,A项错误;硝酸铵溶于水为熵增的过程,B项正确;对于同一种物质气态时熵值最大,其次是液态、固态,因此H2O(g)变成H2O(l),熵变小于0,C项正确;由于该反应是放热的熵增加的反应,因此根据ΔG=ΔH-TΔS可知,反应在任意温度下都能自发进行,D项正确。
答案:A
13.在图Ⅰ中A、B两容器里,分别收集着两种互不反应的理想气体。若将中间活塞打开(如图Ⅱ)两种气体分子立即都占据了两个容器。这是一个不伴随能量变化的自发过程。关于此过程的下列说法中不正确的是 ( )
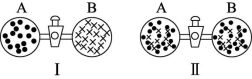
理想气体的自发混合
A.此过程是从混乱程度小的状态向混乱程度大的状态变化的过程,即熵增大的过程
B.此过程为自发过程,而且没有热量的吸收或放出
C.此过程是自发可逆的
D.此过程从有序到无序,混乱程度增大
解析:气体扩散过程是熵增加的过程,A、D项正确;该过程不伴随能量变化,B项正确;两种气体混合后,不会再自发地分开,所以逆过程不能自发进行,C项不正确。
答案:C
14.根据所学的知识和经验,判断下列变化在常温下的焓变、熵变及方向性,并填写下列表格。
变化 | ΔH | ΔS | 方向性 |
H2O(l) |
|
|
|
CaO(s)+SO2(g) |
|
|
|
2Fe3+(aq)+Cu(s) Cu2+(aq) |
|
|
|
NH4Cl(s) |
|
|
|
解析:先判断ΔH的“+”“-”,再由S(g)>S(l)>S(s)判断ΔS的“+”“-”,最后根据常温(298 K)判断ΔH-TΔS的“+”“-”。
答案:
变化 | ΔH | ΔS | 方向性 |
H2O(l) | ΔH>0 | ΔS>0 | 不能自发 |
CaO(s)+SO2(g) | ΔH<0 | ΔS<0 | 自发 |
2Fe3+(aq)+Cu(s) Cu2+(aq) | ΔH<0 | ΔS>0 | 自发 |
NH4Cl(s) | ΔH>0 | ΔS>0 | 不能自发 |
【挑战创新】
15.(1)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2,发生反应:2CO2(g)![]() 2CO(g)+O2(g),该反应的ΔH (填“>”“<”或“=”,下空同)0,ΔS 0,在低温下,该反应 (填“能”或“不能”)自发进行。
2CO(g)+O2(g),该反应的ΔH (填“>”“<”或“=”,下空同)0,ΔS 0,在低温下,该反应 (填“能”或“不能”)自发进行。
(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO与CO转化成CO2和N2,化学方程式为2NO+2CO![]() 2CO2+N2。反应在常温下能够自发进行,则反应的ΔH (填“>”“<”或“=”)0。
2CO2+N2。反应在常温下能够自发进行,则反应的ΔH (填“>”“<”或“=”)0。
(3)已知CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) ΔH=+218 kJ/mol,该反应能够自发进行的反应条件是 。
CaO(s)+SO2(g)+CO2(g) ΔH=+218 kJ/mol,该反应能够自发进行的反应条件是 。
解析:(2)因为ΔS<0,且ΔG=ΔH-TΔS<0,故ΔH<0。(3)自发反应的条件是ΔH-TΔS<0,即ΔH<TΔS,ΔH=+218 kJ/mol,ΔS>0,故T>![]() ,即T较大,该反应应在高温下进行。
,即T较大,该反应应在高温下进行。
答案:(1)> > 不能 (2)< (3)高温
高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第三节 化学反应的方向课后测评: 这是一份高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第三节 化学反应的方向课后测评,共10页。试卷主要包含了 下列说法正确的是, 已知等内容,欢迎下载使用。
高中人教版 (2019)第二节 化学平衡同步测试题: 这是一份高中人教版 (2019)第二节 化学平衡同步测试题,共7页。
高中化学人教版 (2019)选择性必修1第二节 化学平衡课堂检测: 这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡课堂检测,共8页。













