


所属成套资源:新教材2023高中化学新人教版选择性必修1同步测试(36份)
- 新教材2023高中化学第二章化学反应速率与化学平衡第二节化学平衡课时1化学平衡状态同步测试新人教版选择性必修1 试卷 0 次下载
- 新教材2023高中化学第二章化学反应速率与化学平衡第二节化学平衡课时2化学平衡常数同步测试新人教版选择性必修1 试卷 0 次下载
- 新教材2023高中化学第二章化学反应速率与化学平衡第四节化学反应的调控同步测试新人教版选择性必修1 试卷 0 次下载
- 新教材2023高中化学第二章化学反应速率与化学平衡素养提升课化学反应速率化学平衡图像同步测试新人教版选择性必修1 试卷 0 次下载
- 新教材2023高中化学章末质量评估第三章水溶液中的离子反应与平衡新人教版选择性必修1 试卷 试卷 0 次下载
高中人教版 (2019)第二节 化学平衡同步测试题
展开
这是一份高中人教版 (2019)第二节 化学平衡同步测试题,共7页。
第二节 化学平衡课时3 影响化学平衡的因素【基础巩固】1.某一化学反应,反应物和生成物都是气体,改变下列条件一定能使化学平衡向正反应方向移动的是 ( )A.增大反应物浓度 B.缩小反应容器的容积C.增大生成物浓度 D.升高反应温度解析:增大反应物浓度,化学平衡向正反应方向移动,增大生成物浓度,化学平衡向逆反应方向移动,A项正确,C项错误;对于反应前后气体物质的量不变的反应,缩小容器容积,相当于增大压强,化学平衡不移动,B项错误;升高温度,平衡向吸热反应方向移动,D项错误。答案:A2.在水溶液中存在反应Ag+(aq)+Fe2+(aq)![]() Ag(s)+Fe3+(aq) ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是 ( )A.升高温度B.加水稀释C.增大Fe2+的浓度D.常温下加压解析:正反应放热,升高温度,平衡向逆反应方向移动,A项错误;加水稀释,平衡向离子数目增多的方向移动,即平衡向逆反应方向移动,B项错误;增大Fe2+的浓度,平衡向正反应方向移动,C项正确;常温下加压对水溶液中的平衡移动几乎无影响,D项错误。答案:C3.反应X(g)+Y(g)
Ag(s)+Fe3+(aq) ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是 ( )A.升高温度B.加水稀释C.增大Fe2+的浓度D.常温下加压解析:正反应放热,升高温度,平衡向逆反应方向移动,A项错误;加水稀释,平衡向离子数目增多的方向移动,即平衡向逆反应方向移动,B项错误;增大Fe2+的浓度,平衡向正反应方向移动,C项正确;常温下加压对水溶液中的平衡移动几乎无影响,D项错误。答案:C3.反应X(g)+Y(g)![]() 2Z(g) ΔH<0,达到平衡后,下列说法中正确的是 ( )A.减小容器容积,平衡向正反应方向移动B.加入催化剂,Z的产率增大C.增大c(X),X的转化率增大D.降低温度,Y的转化率增大解析:因为此反应前后气体分子总数没有变化,故减小容器容积,平衡不发生移动,A项错误;加入催化剂可同时同倍数改变正、逆反应速率,故平衡不会发生移动,B项错误;增大c(X),平衡向正反应方向移动,但X的转化率减小,C项错误;此反应是放热反应,降低温度,平衡向正反应方向移动,Y的转化率增大,D项正确。答案:D4.下列事实不能用勒夏特列原理解释的是 ( )A.打开汽水瓶时,有大量气泡溢出B.在配制硫酸亚铁溶液时往往要加入一定量铁粉C.氨水应密闭保存于低温处D.实验室用排饱和食盐水的方法收集氯气解析:配制FeSO4溶液时,加入铁粉是为了防止Fe2+被氧化。答案:B5.(2021·广东卷改编)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:a.CH4(g)+CO2(g)
2Z(g) ΔH<0,达到平衡后,下列说法中正确的是 ( )A.减小容器容积,平衡向正反应方向移动B.加入催化剂,Z的产率增大C.增大c(X),X的转化率增大D.降低温度,Y的转化率增大解析:因为此反应前后气体分子总数没有变化,故减小容器容积,平衡不发生移动,A项错误;加入催化剂可同时同倍数改变正、逆反应速率,故平衡不会发生移动,B项错误;增大c(X),平衡向正反应方向移动,但X的转化率减小,C项错误;此反应是放热反应,降低温度,平衡向正反应方向移动,Y的转化率增大,D项正确。答案:D4.下列事实不能用勒夏特列原理解释的是 ( )A.打开汽水瓶时,有大量气泡溢出B.在配制硫酸亚铁溶液时往往要加入一定量铁粉C.氨水应密闭保存于低温处D.实验室用排饱和食盐水的方法收集氯气解析:配制FeSO4溶液时,加入铁粉是为了防止Fe2+被氧化。答案:B5.(2021·广东卷改编)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:a.CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH1b.CO2(g)+H2(g)
2CO(g)+2H2(g) ΔH1b.CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2c.CH4(g)
CO(g)+H2O(g) ΔH2c.CH4(g)![]() C(s)+2H2(g) ΔH3d.2CO(g)
C(s)+2H2(g) ΔH3d.2CO(g)![]() CO2(g)+C(s) ΔH4e.CO(g)+H2(g)
CO2(g)+C(s) ΔH4e.CO(g)+H2(g)![]() H2O(g)+C(s) ΔH5上述反应体系在一定条件下建立平衡后,下列说法正确的是 ( )A.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加B.移去部分C(s),反应c、d、e的平衡均向右移动C.加入反应a的催化剂,可提高CH4的平衡转化率D.降低反应温度,反应a~e的正反应速率减小,逆反应速率增大解析:CO2与CH4为a、b、c反应的反应物,增大浓度,对应的正反应速率都增大,故A项正确;移去部分C(s),由于移除的是纯固体,对平衡移动不产生影响,故B项错误;催化剂只会改变化学反应速率,不会改变化学反应的限度,故C项错误;降低反应温度,所有反应速率均减小,故D项错误。答案:A6.已知化学反应2A(?)+B(g)
H2O(g)+C(s) ΔH5上述反应体系在一定条件下建立平衡后,下列说法正确的是 ( )A.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加B.移去部分C(s),反应c、d、e的平衡均向右移动C.加入反应a的催化剂,可提高CH4的平衡转化率D.降低反应温度,反应a~e的正反应速率减小,逆反应速率增大解析:CO2与CH4为a、b、c反应的反应物,增大浓度,对应的正反应速率都增大,故A项正确;移去部分C(s),由于移除的是纯固体,对平衡移动不产生影响,故B项错误;催化剂只会改变化学反应速率,不会改变化学反应的限度,故C项错误;降低反应温度,所有反应速率均减小,故D项错误。答案:A6.已知化学反应2A(?)+B(g)![]() 2C(?)达到平衡后,当增大压强时,平衡向逆反应方向移动,则下列情况中可能的是 ( )A.A是气体,C是固体 B.A、C均为气体C.A、C均为固体 D.A是固体,C是气体解析:增大压强,平衡向逆反应方向移动,说明逆反应是气体物质的量减小的反应,故C为气体,A为非气体(如固体)。答案:D7.在一定容积的密闭容器中,进行化学反应CO2(g)+H2(g)
2C(?)达到平衡后,当增大压强时,平衡向逆反应方向移动,则下列情况中可能的是 ( )A.A是气体,C是固体 B.A、C均为气体C.A、C均为固体 D.A是固体,C是气体解析:增大压强,平衡向逆反应方向移动,说明逆反应是气体物质的量减小的反应,故C为气体,A为非气体(如固体)。答案:D7.在一定容积的密闭容器中,进行化学反应CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示。T/℃7008008301 0001 200K0.60.91.01.72.6回答下列问题。(1)该反应为 反应(填“吸热”或“放热”)。 (2)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为 。 (3)若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol/L、2 mol/L、4 mol/L、4 mol/L,则此时上述反应的平衡 (填“向正反应方向”“向逆反应方向”或“不”)移动。 解析:(1)根据题干中的表格可知,随着温度的升高,平衡常数逐渐增大,说明正反应为吸热反应。(2)某温度下,各物质的平衡浓度有如下关系3c(CO2)·c(H2)=5c(CO)·c(H2O),根据该反应的平衡常数表达式K=
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示。T/℃7008008301 0001 200K0.60.91.01.72.6回答下列问题。(1)该反应为 反应(填“吸热”或“放热”)。 (2)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为 。 (3)若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol/L、2 mol/L、4 mol/L、4 mol/L,则此时上述反应的平衡 (填“向正反应方向”“向逆反应方向”或“不”)移动。 解析:(1)根据题干中的表格可知,随着温度的升高,平衡常数逐渐增大,说明正反应为吸热反应。(2)某温度下,各物质的平衡浓度有如下关系3c(CO2)·c(H2)=5c(CO)·c(H2O),根据该反应的平衡常数表达式K=![]() 可知,K=
可知,K=![]() =0.6,平衡常数只与温度有关,温度一定,平衡常数为定值,所以此时对应的温度为700 ℃。(3)1 200 ℃时,Qc=
=0.6,平衡常数只与温度有关,温度一定,平衡常数为定值,所以此时对应的温度为700 ℃。(3)1 200 ℃时,Qc=![]() ,将各物质的浓度代入可得Q=4,而此温度下的平衡常数为2.6,即Q>K,所以平衡向逆反应方向移动。答案:(1)吸热 (2)700 ℃ (3)向逆反应方向8.现有反应mA(g)+nB(g)
,将各物质的浓度代入可得Q=4,而此温度下的平衡常数为2.6,即Q>K,所以平衡向逆反应方向移动。答案:(1)吸热 (2)700 ℃ (3)向逆反应方向8.现有反应mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率增大;当减小压强时,混合体系中C的质量分数减小。则:(1)该反应的逆反应为 (填“吸热”或“放热”)反应,且m+n (填“>”“=”或“<”)p。 (2)减压使容器容积增大时,A的质量分数 (填“增大”“减小”或“不变”,下同)。 (3)若容积不变,加入B,则A的转化率 ,B的转化率 。 (4)若升高温度,则平衡时B、C的浓度之比
pC(g),达到平衡后,当升高温度时,B的转化率增大;当减小压强时,混合体系中C的质量分数减小。则:(1)该反应的逆反应为 (填“吸热”或“放热”)反应,且m+n (填“>”“=”或“<”)p。 (2)减压使容器容积增大时,A的质量分数 (填“增大”“减小”或“不变”,下同)。 (3)若容积不变,加入B,则A的转化率 ,B的转化率 。 (4)若升高温度,则平衡时B、C的浓度之比![]() 将 。 (5)若加入催化剂,平衡时气体混合物的总物质的量 。 解析:mA(g)+nB(g)
将 。 (5)若加入催化剂,平衡时气体混合物的总物质的量 。 解析:mA(g)+nB(g)![]() pC(g)达到平衡后,升高温度时,B的转化率增大,说明平衡向正反应方向移动,正反应为吸热反应;减小压强时,混合体系中C的质量分数减小,说明平衡向逆反应方向移动,即m+n>p,A的质量分数增大;加入B时,平衡向正反应方向移动,A的转化率增大;升高温度时,平衡向正反应方向移动,c(C)增大,c(B)减小,即
pC(g)达到平衡后,升高温度时,B的转化率增大,说明平衡向正反应方向移动,正反应为吸热反应;减小压强时,混合体系中C的质量分数减小,说明平衡向逆反应方向移动,即m+n>p,A的质量分数增大;加入B时,平衡向正反应方向移动,A的转化率增大;升高温度时,平衡向正反应方向移动,c(C)增大,c(B)减小,即![]() 减小;加入催化剂,平衡不移动,混合物的总物质的量不变。答案:(1)放热 > (2)增大 (3)增大 减小 (4)减小 (5)不变【拓展提高】9.将H2(g)与Br2(g)充入恒容密闭容器中,恒温下发生反应H2(g)+Br2(g)
减小;加入催化剂,平衡不移动,混合物的总物质的量不变。答案:(1)放热 > (2)增大 (3)增大 减小 (4)减小 (5)不变【拓展提高】9.将H2(g)与Br2(g)充入恒容密闭容器中,恒温下发生反应H2(g)+Br2(g)![]() 2HBr(g) ΔH<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是 ( )A.a>b B.a=bC.a<b D.无法确定解析:两反应的温度不同,后者为绝热条件,对于前者相当于升高了温度,Br2的转化率减小。答案:A10.下列事实中,不能用勒夏特列原理解释的是 ( )A.溴水中存在以下平衡:Br2+H2O
2HBr(g) ΔH<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是 ( )A.a>b B.a=bC.a<b D.无法确定解析:两反应的温度不同,后者为绝热条件,对于前者相当于升高了温度,Br2的转化率减小。答案:A10.下列事实中,不能用勒夏特列原理解释的是 ( )A.溴水中存在以下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅B.对反应2H2O2
HBr+HBrO,当加入NaOH溶液后颜色变浅B.对反应2H2O2![]() 2H2O+O2↑,使用MnO2可增大制O2的反应速率C.反应:CO+NO2
2H2O+O2↑,使用MnO2可增大制O2的反应速率C.反应:CO+NO2![]() CO2+NO ΔH<0,升高温度,平衡向逆反应方向移动D.合成氨反应:N2+3H2
CO2+NO ΔH<0,升高温度,平衡向逆反应方向移动D.合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施解析:催化剂只能改变反应速率,对化学平衡的移动无影响。答案:B11.在温度T1和T2(T2>T1)下,X2(g)与H2反应生成HX的平衡常数如下表:反应化学方程式K(T1)K(T2)①Br2(g)+H2(g)
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施解析:催化剂只能改变反应速率,对化学平衡的移动无影响。答案:B11.在温度T1和T2(T2>T1)下,X2(g)与H2反应生成HX的平衡常数如下表:反应化学方程式K(T1)K(T2)①Br2(g)+H2(g)![]() 2HBr(g)5.6×1079.3×106②I2(g)+H2(g)
2HBr(g)5.6×1079.3×106②I2(g)+H2(g)![]() 2HI(g)4334 下列说法中错误的是 ( )A.①和②均是放热反应B.相同条件下,平衡体系中HX所占的比例:①>②C.其他条件不变时,增大压强可提高X2的平衡转化率D.其他条件不变时,升高温度可增大HX的生成速率解析:根据勒夏特列原理,升高温度,平衡向吸热反应方向移动,化学平衡常数只受温度影响,根据表中数据,平衡常数随温度的升高而降低,因此①的正反应为放热反应,同理②的正反应也为放热反应,故A项说法正确;平衡常数越大,说明反应进行的程度越大,因此HX所占的比例:①>②,故B项说法正确;因为反应前后气体体积不变,压强对化学平衡无影响,故C项说法错误;升高温度,反应速率增大,故D项说法正确。答案:C12.将0.4 mol N2O4气体充入2 L固定容积的密闭容器中发生反应N2O4(g)
2HI(g)4334 下列说法中错误的是 ( )A.①和②均是放热反应B.相同条件下,平衡体系中HX所占的比例:①>②C.其他条件不变时,增大压强可提高X2的平衡转化率D.其他条件不变时,升高温度可增大HX的生成速率解析:根据勒夏特列原理,升高温度,平衡向吸热反应方向移动,化学平衡常数只受温度影响,根据表中数据,平衡常数随温度的升高而降低,因此①的正反应为放热反应,同理②的正反应也为放热反应,故A项说法正确;平衡常数越大,说明反应进行的程度越大,因此HX所占的比例:①>②,故B项说法正确;因为反应前后气体体积不变,压强对化学平衡无影响,故C项说法错误;升高温度,反应速率增大,故D项说法正确。答案:C12.将0.4 mol N2O4气体充入2 L固定容积的密闭容器中发生反应N2O4(g)![]() 2NO2(g) ΔH。在T1和T2时,测得NO2的物质的量随时间的变化如图所示。
2NO2(g) ΔH。在T1和T2时,测得NO2的物质的量随时间的变化如图所示。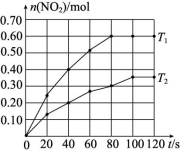 (1)T1时,40~80 s内用N2O4表示该反应的平均反应速率为 mol/(L·s)。 (2)ΔH (填“>”“<”或“=”)0。 (3)改变条件重新达到平衡时,要使
(1)T1时,40~80 s内用N2O4表示该反应的平均反应速率为 mol/(L·s)。 (2)ΔH (填“>”“<”或“=”)0。 (3)改变条件重新达到平衡时,要使![]() 减小,可采取的措施有 (填字母,下同)。 A.增大N2O4的起始浓度B.升高温度C.向混合气体中通入NO2D.使用高效催化剂(4)在温度为T3、T4时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法中正确的是 。
减小,可采取的措施有 (填字母,下同)。 A.增大N2O4的起始浓度B.升高温度C.向混合气体中通入NO2D.使用高效催化剂(4)在温度为T3、T4时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法中正确的是 。 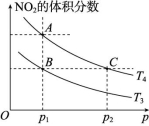 A.A、C两点的反应速率:A>CB.A、B两点N2O4的转化率:A>BC.A、C两点气体的颜色:A深,C浅D.由A点到B点,可以用加热的方法解析:(1)T1时,v(N2O4)=
A.A、C两点的反应速率:A>CB.A、B两点N2O4的转化率:A>BC.A、C两点气体的颜色:A深,C浅D.由A点到B点,可以用加热的方法解析:(1)T1时,v(N2O4)=![]() v(NO2)=
v(NO2)=![]() ×
×![]() =1.25×10-3mol/(L·s)。(2)由图可知,反应在T1时比T2时先达到平衡状态,所以T1>T2,由于T1平衡时n(NO2)比T2平衡时n(NO2)大,故升高温度,平衡向生成NO2的方向移动,即向吸热反应方向移动,所以ΔH>0。(3)A项,增大N2O4的起始浓度相当于增大压强,平衡向左移动,
=1.25×10-3mol/(L·s)。(2)由图可知,反应在T1时比T2时先达到平衡状态,所以T1>T2,由于T1平衡时n(NO2)比T2平衡时n(NO2)大,故升高温度,平衡向生成NO2的方向移动,即向吸热反应方向移动,所以ΔH>0。(3)A项,增大N2O4的起始浓度相当于增大压强,平衡向左移动,![]() 减小;B项,升高温度,平衡向右移动,
减小;B项,升高温度,平衡向右移动,![]() 增大;C项,通入NO2相当于增大压强,
增大;C项,通入NO2相当于增大压强,![]() 减小;D项,使用高效催化剂平衡不移动,
减小;D项,使用高效催化剂平衡不移动,![]() 不变。(4)A项,由图可知,A、C两点温度相同,C点对应压强大,反应速率大。B项,由图可知,A、B两点压强相同,温度不同,A点NO2的体积分数大于B点NO2的体积分数,而反应N2O4(g)
不变。(4)A项,由图可知,A、C两点温度相同,C点对应压强大,反应速率大。B项,由图可知,A、B两点压强相同,温度不同,A点NO2的体积分数大于B点NO2的体积分数,而反应N2O4(g)![]() 2NO2(g) ΔH>0,温度升高,平衡向右移动,NO2的体积分数增大,温度:T4>T3,转化率:A>B;C项,由图可知,A、C两点温度相同,C点对应压强大,NO2的浓度大,故气体颜色C点比A点深;D项,由B项分析知,A点温度T4高于B点温度T3,故由A点到B点需要降低温度。答案:(1)1.25×10-3 (2)> (3)AC (4)B【挑战创新】13.利用传感技术可以探究压强对2NO2(g)
2NO2(g) ΔH>0,温度升高,平衡向右移动,NO2的体积分数增大,温度:T4>T3,转化率:A>B;C项,由图可知,A、C两点温度相同,C点对应压强大,NO2的浓度大,故气体颜色C点比A点深;D项,由B项分析知,A点温度T4高于B点温度T3,故由A点到B点需要降低温度。答案:(1)1.25×10-3 (2)> (3)AC (4)B【挑战创新】13.利用传感技术可以探究压强对2NO2(g)![]() N2O4(g)化学平衡移动的影响。在室温、100 kPa条件下,向针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞并保持活塞位置不变,测定针筒内气体压强的变化如图所示。下列说法中正确的是 ( )
N2O4(g)化学平衡移动的影响。在室温、100 kPa条件下,向针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞并保持活塞位置不变,测定针筒内气体压强的变化如图所示。下列说法中正确的是 ( )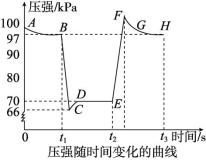 A.B点处NO2的转化率为3%B.E点到H点的过程中,NO2的物质的量先增大后减小C.E、H两点对应的正反应速率大小为vH>vED.B、E两点气体的平均相对分子质量大小为 MB<ME解析:由图可知B点处压强为97 kPa,设起始时二氧化氮的物质的量为1 mol,转化率为a,由题意建立以下“三段式”: 2NO2(g)
A.B点处NO2的转化率为3%B.E点到H点的过程中,NO2的物质的量先增大后减小C.E、H两点对应的正反应速率大小为vH>vED.B、E两点气体的平均相对分子质量大小为 MB<ME解析:由图可知B点处压强为97 kPa,设起始时二氧化氮的物质的量为1 mol,转化率为a,由题意建立以下“三段式”: 2NO2(g)![]() N2O4(g)起始量/mol 1 0变化量/mol a 0.5a平衡量/mol 1-a 0.5a由
N2O4(g)起始量/mol 1 0变化量/mol a 0.5a平衡量/mol 1-a 0.5a由![]() =
=![]() 可得
可得![]() =
=![]() ,解得a=0.06,即二氧化氮的转化率为6%,故A项错误;由图可知,t2时刻移动了活塞,压强迅速增大,说明迅速移动活塞使针筒容积减小,并保持活塞位置不变后,体系因体积减小而压强增大,平衡向生成四氧化二氮的方向移动,则E点到H点的过程中,二氧化氮的物质的量先减小后增大,故B项错误;对于有气体参加的反应,压强越大反应速率越大,由图可知,H点压强大于E点压强,则反应速率vH>vE,故C项正确;由图可知,B点到E点的过程为压强减小的过程,减小压强平衡向生成二氧化氮的方向移动,气体的物质的量增大,由质量守恒定律可知气体质量不变,则混合气体的平均相对分子质量减小,即MB>ME,故D项错误。答案:C
,解得a=0.06,即二氧化氮的转化率为6%,故A项错误;由图可知,t2时刻移动了活塞,压强迅速增大,说明迅速移动活塞使针筒容积减小,并保持活塞位置不变后,体系因体积减小而压强增大,平衡向生成四氧化二氮的方向移动,则E点到H点的过程中,二氧化氮的物质的量先减小后增大,故B项错误;对于有气体参加的反应,压强越大反应速率越大,由图可知,H点压强大于E点压强,则反应速率vH>vE,故C项正确;由图可知,B点到E点的过程为压强减小的过程,减小压强平衡向生成二氧化氮的方向移动,气体的物质的量增大,由质量守恒定律可知气体质量不变,则混合气体的平均相对分子质量减小,即MB>ME,故D项错误。答案:C
相关试卷
这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡课堂检测,共8页。
这是一份高中化学第二章 化学反应速率与化学平衡第二节 化学平衡课后复习题,共6页。
这是一份化学选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡第2课时习题,共13页。试卷主要包含了下列说法不正确的是,恒温下,反应,在一定条件下,反应,在密闭容器中进行如下反应等内容,欢迎下载使用。










