

所属成套资源:2022年高中化学必修二课时练习(含答案)
2022年高中化学必修二课时练习:化学反应的速率及影响因素 Word版含答案
展开这是一份2022年高中化学必修二课时练习:化学反应的速率及影响因素 Word版含答案,共5页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
化学反应的速率及影响因素
一、选择题
1.下列关于化学反应速率的说法中,不正确的是
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示
C.在同一个反应中,各物质的反应速率之比等于化学方程式中的计量数之比
D.化学反应速率的常用单位有mol/(L·s)和mol/(L·min)
2.在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是 ( )A.0.1mol.L-1.min-1 B.0.2mol.L-1.min-1 C.0.3mol.L-1.min-1 D.0.6mol.L-1.min-1
3.在一密闭容器中充入一定量的H2和N2,经测定反应开始后3s末的υ(H2)=O.3mol/(L·s),则3s末NH3的浓度为( ) A.0.45mol/L B.0.6mol/L C.O.9mol/L D.1.2mol/L
4.反应2SO2+O2 ![]() 2SO3,经过一段时间后,SO3的浓度增加了0.4 mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s),则这段时间为 ( )A.0.1s B.2.5s C.5s D.10s
2SO3,经过一段时间后,SO3的浓度增加了0.4 mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s),则这段时间为 ( )A.0.1s B.2.5s C.5s D.10s
5.已知某反应的各物质浓度数据如下:
aA(g) + bB(g) = 2C(g)
起始浓度(mol·L-1) 3.0 1.0 0
2 s末浓度(mol·L-1) 1.8 0.6 0.8
据此可推算出上述反应化学方程式中,各物质的化学计量数之比是( )
A.9∶3∶4 B.3∶1∶2 C.2∶1∶3 D.3∶2∶1
6. 5.6g铁粉投入到足量的100mL 2mol/L的稀硫酸中,2 min时铁粉刚好溶解,下列表示这个反应的速率正确的是( ) A.v(Fe) = 0.5 mol/(L.min) B.v(H2SO4)= 1 mol/(L.min)
![]() C.v(H2) = 0.5 mol/(L.min) D.v(FeSO4)= 0.5 mol/(L.min)
C.v(H2) = 0.5 mol/(L.min) D.v(FeSO4)= 0.5 mol/(L.min)
7.合成氨反应:3H2+N2 2NH3,其反应速率可以分别用v(H2)、v(N2)、v(NH3)(用
mol·L-1·s-1表示),则正确的关系是( )
A.v(H2)=v(N2)=v(NH3) B.v(N2)=2v(NH3) C.v(H2)=![]() (NH3) D. v(N2)=3v(H2)
(NH3) D. v(N2)=3v(H2)
8.下列四个数据都表示合成氨的反应速率,其中代表同一反应中的速率的是 ( )
①V(N2)=0.3mol/(L·min)②V(NH3)=0.9mol/(L·min)③V(H2)=0.6mol/(L·min)④V(H2)=0.0225mol/(L·s)
A.①② B.①③ C.③④ D.②④
9.把下列四种x溶液,分别加入四个盛有10mL 2mol·L-1盐酸的烧杯中,均加水稀释到50mL,此时x和盐酸缓慢进行反应。其中反应速率最大的是 ( )
A.20ml 3mol·L-1的x溶液 B.20ml 2mol·L-1的x溶液
C.10ml 4mol·L-1的x溶液 D.10mL 2mol·L-1的x溶液
10.决定化学反应速率的主要因素是 ( )
A.参加反应的物质本身的性质 B.催化剂 C.温度、压强以及反应物的接触面 D.反应物的浓度
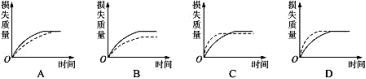
11.将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将B g(A>B)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( )
12.为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A—D四个实验,你认为结论不正确的是( )
A.将相同大小、形状的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大
B.在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快
C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解
D.两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同
13.100 mL 2 mol·L-1的硫酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量的6 mol·L-1的硫酸 B.适当加热 C.加入适量蒸馏水 D.加入适量的氯化钠溶液
14.下列实验中,反应速率加快是由催化剂引起的是( )
A.在炭粉中加入KClO3,点燃时燃烧更为剧烈 B.H2O2中加入少量MnO2,即可迅速放出气体
C.将炭块粉碎成粉末状,可使燃烧更加充分 D.电解水时,加少量硫酸可使电解速率加快
15.欲使煤在煤炉中充分燃烧,下列措施可行的是( )
A.向炉内喷吹空气 B.把大块煤碾成小块 C.使用MnO2作催化剂 D.提高炉内体系的温度
16.对于反应:A+B=C ,下列条件的改变一定能使化学反应速率加快的是 ( )
A.增加A的物质的量 B.升高体系的温度 C.增加体系的压强 D.减少c的物质的量
17.下列措施对增大反应速率明显有效的是( )
A.Al在氧气中燃烧生成A1203,将Al片改成Al粉 B.Fe与稀硫酸反应制取H2时,该用浓硫酸
C.在K2S04与BaCl2两溶液反应时,增大压强 D.Na与水反应时增大水的用量
18.(双选)NO和CO都是汽车尾气里的有毒气体,它们能缓慢地反应生成N2和CO2,对此反应下列说法不正确的是( )
A.降低压强能加快反应速率 B.使用适当的催化剂能加快反应速率
C.改变压强对反应速率无影响 D.温度能加快反应速率
19.硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是( )
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/mol·L-1 | V/mL | c/ mol·L-1 | V/mL | ||
A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
20.在温度不变的条件下,在恒容的容器中进行下列反应:N2O4(g) ![]() 2NO2(g),若N2O4的浓度由0.1 mol·L-1降到0.07 mol·L-1需要15 s,那么N2O4的浓度由0.07 mol·L-1降到0.05 mol·L-1所需的反应时间( ) A.等于5 s B.等于10 s C.大于10 s D.小于10 s
2NO2(g),若N2O4的浓度由0.1 mol·L-1降到0.07 mol·L-1需要15 s,那么N2O4的浓度由0.07 mol·L-1降到0.05 mol·L-1所需的反应时间( ) A.等于5 s B.等于10 s C.大于10 s D.小于10 s
二、非选择题
21.对于反应:2SO2+O2 ![]() 2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填在横线上(填写“增大”“减小”“不变”)①降低温度 ②增大O2的浓度 ③使用V2O5作催化剂 ④压缩体积 。
2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填在横线上(填写“增大”“减小”“不变”)①降低温度 ②增大O2的浓度 ③使用V2O5作催化剂 ④压缩体积 。
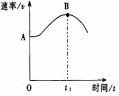 22.将镁带2.4g投入盛放在敞口容器100ml 1.5mol/L的盐酸里,产生H2的速率与时间的关系可由右图表示。
22.将镁带2.4g投入盛放在敞口容器100ml 1.5mol/L的盐酸里,产生H2的速率与时间的关系可由右图表示。
(1)写出离子反应方程式
(2)在下列因素中①H+的浓度 ②镁带的表面积 ③溶液的温度④Cl-的浓度,能影响该反应速率的因素有__________(填序号);
(3)解释图中AB段形成的原因 ;
(4)解释图中t1时刻后速率变小的原因 。
(2)5min时,N2O5占混合气体体积分数是 。
第二章 第三节 第一课时 化学反应的速率及影响因素
一、选择题
1.B 2.B 3.B 4.C 5.B 6.D 7.C 8.D 9.A 10.A 11.C 12.A 13.B 14.B 15.B 16.B 17.A 18.AC 19.D 20.C
二、非选择题
21.减小 增大 增大 增大
22.(1)Mg+2H+═Mg2++H2↑ (2)①②③ (3)反应放热,温度升高,反应速率增大
(4)反应物的浓度逐渐减小
- (1)0.16mol/(L·min);0.04mol/(L·min) (2)61.5%
相关试卷
这是一份高中化学苏教版 (2019)必修 第二册第一单元 化学反应速率与反应限度同步训练题,共9页。
这是一份高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡同步测试题,共4页。试卷主要包含了重铬酸钾溶液中存在如下平衡,在一密闭容器中发生反应等内容,欢迎下载使用。
这是一份鲁科版 (2019)必修 第二册第2章 化学键 化学反应规律第3节 化学反应的快慢和限度课后复习题,共1页。












