


所属成套资源:2022年高中化学必修二课时练习(含答案)
2022年高中化学必修二课时练习:化学反应与能量B Word版含答案
展开
这是一份2022年高中化学必修二课时练习:化学反应与能量B Word版含答案,共7页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
化学反应与能量B一、选择题1. 下列反应中不需加热的吸热反应是( )A.锌粒与稀硫酸的反应 B.灼热的木炭与CO2反应C.甲烷在氧气中的燃烧反应 D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应2. 下列设备工作时,将化学能转化为热能的是( )ABCD![]()


![]() 硅太阳能电池锂离子电池太阳能集热器燃气灶3. 下列说法正确的是( )A.化学反应的发生是否需要加热取决于反应物的总能量和生成物总能量的相对大小B.金属原子在化学反应中只能失去电子,因而只能形成离子键 C.只由共价键形成的分子一定是共价化合物D.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同4. 下列对能量转化的认识中,不正确的是( )A.电解水生成氢气和氧气时,电能主要转化为化学能 B.风力发电时,风能主要转化为电能C.煤燃烧时,化学能主要转化为热能 D.白炽灯工作时,电能全部转化为光能5. 化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是( )
硅太阳能电池锂离子电池太阳能集热器燃气灶3. 下列说法正确的是( )A.化学反应的发生是否需要加热取决于反应物的总能量和生成物总能量的相对大小B.金属原子在化学反应中只能失去电子,因而只能形成离子键 C.只由共价键形成的分子一定是共价化合物D.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同4. 下列对能量转化的认识中,不正确的是( )A.电解水生成氢气和氧气时,电能主要转化为化学能 B.风力发电时,风能主要转化为电能C.煤燃烧时,化学能主要转化为热能 D.白炽灯工作时,电能全部转化为光能5. 化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是( )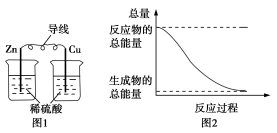 A.化学反应中能量变化的主要原因是化学键的断裂与生成B.中和反应中,反应物的总能量比生成物的总能量低C.图1所示的装置能将化学能转变为电能D.图2所示的反应为吸热反应6.化学反应A2+B2===2AB的能量变化如图所示,则下列说法中正确的是( )
A.化学反应中能量变化的主要原因是化学键的断裂与生成B.中和反应中,反应物的总能量比生成物的总能量低C.图1所示的装置能将化学能转变为电能D.图2所示的反应为吸热反应6.化学反应A2+B2===2AB的能量变化如图所示,则下列说法中正确的是( )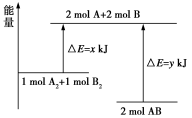 A.该反应过程吸收能量B.断裂1 mol A—A键和1 mol B—B键可放出x kJ能量C.断裂2 mol A—B键需要吸收y kJ能量
A.该反应过程吸收能量B.断裂1 mol A—A键和1 mol B—B键可放出x kJ能量C.断裂2 mol A—B键需要吸收y kJ能量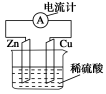 D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量7. 右图为铜锌原电池示意图,按该装置进行实验下列说法正确的是( )A.锌片逐渐溶解B.烧杯中溶液逐渐呈蓝色C.电子由铜片通过导线流向锌片D.该装置能将电能转变为化学能8. 下列反应既是氧化还原反应,又是吸热反应的是 ( )A.铝片与稀硫酸反应 B.Ba(OH)2·8H2O与NH4Cl的反应C.灼热的炭与CO2反应 D.甲烷在O2中燃烧反应 9.日常所用干电池的电极分别为石墨棒(上面有铜帽)和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2),电极反应式可简化为:Zn-2e-===Zn2+,2NH+2e-===2NH3↑+H2↑(NH3与Zn2+能生成一种稳定的物质)。根据上述判断,下列结论正确的是( )①锌为正极,石墨为负极②锌为负极,石墨为正极③工作时,电子由石墨极经过外电路流向锌极④长时间连续使用时,内装糊状物可能流出腐蚀用电器A.①③ B.②③ C.③④ D.②④10.某原电池总反应的离子方程式为:2Fe3++Fe===3Fe2+,能实现该反应的原电池是( )A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液B.正极为C,负极为Fe,电解质溶液为FeSO4溶液C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液D.正极为Ag,负极为Cu,电解质溶液为CuSO4溶液11.在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )A.v(NH3)=0.3 mol/(L·min) B.v(N2)=0.01 mol/(L·s) C.v(N2)=0.2 mol/(L·min) D.v(H2)=0.3 mol/(L·min)12. 在一定温度下,下列叙述是可逆反应A(g)+3B(g)
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量7. 右图为铜锌原电池示意图,按该装置进行实验下列说法正确的是( )A.锌片逐渐溶解B.烧杯中溶液逐渐呈蓝色C.电子由铜片通过导线流向锌片D.该装置能将电能转变为化学能8. 下列反应既是氧化还原反应,又是吸热反应的是 ( )A.铝片与稀硫酸反应 B.Ba(OH)2·8H2O与NH4Cl的反应C.灼热的炭与CO2反应 D.甲烷在O2中燃烧反应 9.日常所用干电池的电极分别为石墨棒(上面有铜帽)和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2),电极反应式可简化为:Zn-2e-===Zn2+,2NH+2e-===2NH3↑+H2↑(NH3与Zn2+能生成一种稳定的物质)。根据上述判断,下列结论正确的是( )①锌为正极,石墨为负极②锌为负极,石墨为正极③工作时,电子由石墨极经过外电路流向锌极④长时间连续使用时,内装糊状物可能流出腐蚀用电器A.①③ B.②③ C.③④ D.②④10.某原电池总反应的离子方程式为:2Fe3++Fe===3Fe2+,能实现该反应的原电池是( )A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液B.正极为C,负极为Fe,电解质溶液为FeSO4溶液C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液D.正极为Ag,负极为Cu,电解质溶液为CuSO4溶液11.在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )A.v(NH3)=0.3 mol/(L·min) B.v(N2)=0.01 mol/(L·s) C.v(N2)=0.2 mol/(L·min) D.v(H2)=0.3 mol/(L·min)12. 在一定温度下,下列叙述是可逆反应A(g)+3B(g)![]() 2C(g)达平衡时的特征的是( )(1)C的生成速率与C的分解速率相等;(2)单位时间内生成a mol A,同时生成3a mol B;(3)A、B、C的浓度不再变化; (4)单位时间内消耗a mol A,同时生成3a mol B;(5)A、B、C的分子数之比为1∶3∶2。A.(1)(2)(5) B.(1)(3)(4) C.(1)(2)(3)(4) D.(1)(3)(5)13.在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)
2C(g)达平衡时的特征的是( )(1)C的生成速率与C的分解速率相等;(2)单位时间内生成a mol A,同时生成3a mol B;(3)A、B、C的浓度不再变化; (4)单位时间内消耗a mol A,同时生成3a mol B;(5)A、B、C的分子数之比为1∶3∶2。A.(1)(2)(5) B.(1)(3)(4) C.(1)(2)(3)(4) D.(1)(3)(5)13.在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)![]() pC(g)+qD(g),当m、n、p、q为任意整数时,达到平衡的标志是( )①体系的压强不再改变 ②体系的温度不再改变 ③各组分的浓度不再改变 ④各组分的质量分数不再改变 ⑤反应速率v(A):v(B):v(C):v(D)=m:n:p:q ⑥单位时间内m mol A发生断键反应,同时p mol C也发生断键反应A.③④⑤⑥ B.①③④⑤ C.②③④⑥ D.①③④⑥14.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
pC(g)+qD(g),当m、n、p、q为任意整数时,达到平衡的标志是( )①体系的压强不再改变 ②体系的温度不再改变 ③各组分的浓度不再改变 ④各组分的质量分数不再改变 ⑤反应速率v(A):v(B):v(C):v(D)=m:n:p:q ⑥单位时间内m mol A发生断键反应,同时p mol C也发生断键反应A.③④⑤⑥ B.①③④⑤ C.②③④⑥ D.①③④⑥14.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )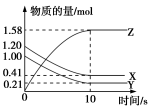 A.反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1B.10 s后,该反应停止进行C.反应的化学方程式为2X(g)+Y(g)
A.反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1B.10 s后,该反应停止进行C.反应的化学方程式为2X(g)+Y(g)![]() 2Z(g) D.反应开始到10 s时,平均反应速率:v(X)=v(Y)=0.039 5 mol·L-1·s-115.反应4A(g)+3B(g)===2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1。对此反应速率的表示,正确的是( )①用A表示的反应速率是0.4 mol·L-1·min-1 ②分别用B、C、D表示的反应速率其比值为3:2:1③在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1④在这2 min内用B表示的反应速率的值是逐渐减小的,用C表示的反应速率的值是逐渐增大的A.①② B.③ C.① D.②④16.根据图中包含的信息分析,下列叙述正确的是( )
2Z(g) D.反应开始到10 s时,平均反应速率:v(X)=v(Y)=0.039 5 mol·L-1·s-115.反应4A(g)+3B(g)===2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1。对此反应速率的表示,正确的是( )①用A表示的反应速率是0.4 mol·L-1·min-1 ②分别用B、C、D表示的反应速率其比值为3:2:1③在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1④在这2 min内用B表示的反应速率的值是逐渐减小的,用C表示的反应速率的值是逐渐增大的A.①② B.③ C.① D.②④16.根据图中包含的信息分析,下列叙述正确的是( )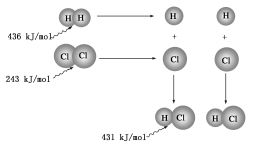 A.氢气与氯气反应生成1 mol氯化氢气体,反应吸收248 kJ的能量B.436 kJ/ mol是指断开1 mol H2中的H—H键需要放出436 kJ的能量C.氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的能量D.431 kJ/ mol是指生成2 mol HCl中的H—Cl键需要放出431 kJ的能量17. 已知反应P+Q===M+N是放热反应,下列关于反应能量的变化的说法中不正确的是( )A.断裂P和Q中化学键吸收的总能量小于形成M和N中化学键释放的总能量B.P和Q的总能量大于M和N的总能量C.P和Q的总能量小于M和N的总能量D.任何化学反应都伴随着能量变化18. 用铁片与稀硫酸反应制氢气时,下列措施不能使反应速率加快的是 ( )A. 加热 B. 不用稀硫酸,改用98%的浓硫酸 C. 滴加少量CuSO4溶液 D. 不用铁片,改用铁粉二、非选择题(本题包括5小题,共46分)19. 下列反应:①氢氧化钠与硫酸,②一氧化碳与氧气,③八水合氢氧化钡与氯化铵,④金属铜与硝酸银。其中(用序号填空):(1)属于放热反应的是__________________________________________________。(2)属于吸热反应的是__________________________________________________。(3)能设计成原电池的反应是____________________________________________。(4)能设计成燃料电池的反应是__________________________________________。20. 反应Fe+H2SO4===FeSO4+H2↑的能量变化趋势,如图所示:
A.氢气与氯气反应生成1 mol氯化氢气体,反应吸收248 kJ的能量B.436 kJ/ mol是指断开1 mol H2中的H—H键需要放出436 kJ的能量C.氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的能量D.431 kJ/ mol是指生成2 mol HCl中的H—Cl键需要放出431 kJ的能量17. 已知反应P+Q===M+N是放热反应,下列关于反应能量的变化的说法中不正确的是( )A.断裂P和Q中化学键吸收的总能量小于形成M和N中化学键释放的总能量B.P和Q的总能量大于M和N的总能量C.P和Q的总能量小于M和N的总能量D.任何化学反应都伴随着能量变化18. 用铁片与稀硫酸反应制氢气时,下列措施不能使反应速率加快的是 ( )A. 加热 B. 不用稀硫酸,改用98%的浓硫酸 C. 滴加少量CuSO4溶液 D. 不用铁片,改用铁粉二、非选择题(本题包括5小题,共46分)19. 下列反应:①氢氧化钠与硫酸,②一氧化碳与氧气,③八水合氢氧化钡与氯化铵,④金属铜与硝酸银。其中(用序号填空):(1)属于放热反应的是__________________________________________________。(2)属于吸热反应的是__________________________________________________。(3)能设计成原电池的反应是____________________________________________。(4)能设计成燃料电池的反应是__________________________________________。20. 反应Fe+H2SO4===FeSO4+H2↑的能量变化趋势,如图所示: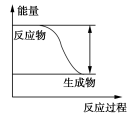 (1)该反应为________反应(填“吸热”或“放热”)。(2)若要使该反应的反应速率加快,下列措施可行的是________(填字母)。A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为________极(填“正”或“负”)。铜片上产生的现象为_________________________,该极上发生的电极反应为_______________________,外电路中电子由________极(填“正”或“负”,下同)向________极移动。21. Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:序号硫酸的体积/mL锌的质量/g锌的形状温度/℃完全溶于酸的时间/s生成硫酸锌的质量/g150.02.0薄片25100m1250.02.0颗粒2570m2350.02.0颗粒3535m3450.02.0粉末25455.0550.06.0粉末3530m5650.08.0粉末25t616.1750.010.0粉末25t716.1(1)化学反应速率本质上是由________决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3表明________对反应速率有影响,该因素对反应速率的具体影响是:其它条件相同时,________反应速率越快。(2)我们最好选取实验________(填3个实验序号)研究锌的形状对反应速率的影响。我们发现在其它条件相同时,反应物间的________反应速率越快。
(1)该反应为________反应(填“吸热”或“放热”)。(2)若要使该反应的反应速率加快,下列措施可行的是________(填字母)。A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为________极(填“正”或“负”)。铜片上产生的现象为_________________________,该极上发生的电极反应为_______________________,外电路中电子由________极(填“正”或“负”,下同)向________极移动。21. Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:序号硫酸的体积/mL锌的质量/g锌的形状温度/℃完全溶于酸的时间/s生成硫酸锌的质量/g150.02.0薄片25100m1250.02.0颗粒2570m2350.02.0颗粒3535m3450.02.0粉末25455.0550.06.0粉末3530m5650.08.0粉末25t616.1750.010.0粉末25t716.1(1)化学反应速率本质上是由________决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3表明________对反应速率有影响,该因素对反应速率的具体影响是:其它条件相同时,________反应速率越快。(2)我们最好选取实验________(填3个实验序号)研究锌的形状对反应速率的影响。我们发现在其它条件相同时,反应物间的________反应速率越快。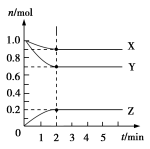 (3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______________________________。(4)利用表中数据,可以求得:硫酸的物质的量浓度是________mol/L。Ⅱ.某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:(5)反应开始至2 min,Y的平均反应速率________。(6)分析有关数据,写出X、Y、Z的反应方程式________________。22. 在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______________________________。(4)利用表中数据,可以求得:硫酸的物质的量浓度是________mol/L。Ⅱ.某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:(5)反应开始至2 min,Y的平均反应速率________。(6)分析有关数据,写出X、Y、Z的反应方程式________________。22. 在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为4 mol,B为6 mol,5 min末时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。计算:(1)5 min末A的物质的量浓度为________。(2)前5 min内用B表示的化学反应速率v(B)为________。(3)化学方程式中n值为________。(4)此反应在四种不同情况下的反应速率分别为:①v(A)=5 mol·L-1·min-1 ②v(B)=6 mol·L-1·min-1 ③v(C)=4.5 mol·L-1·min-1 ④v(D)=8 mol·L-1·min-1其中反应速率最快的是________(填编号)。23. 某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:方案Ⅰ:有人提出将形状和大小均相等的铁片和铜片,分别同时放入100 mL 2.0 mol/L稀硫酸中,观察产生气泡的快慢,据此可以确定它们的金属活动性。该原理的离子方程式为:________________________;若反应进行到2 min时共收集到标准状况下的气体1120 mL,则用硫酸表示的该反应的反应速率为(溶液体积变化忽略不计):________________________。方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出你设计的原电池装置图。注明电解质溶液名称和正负极材料,标出电子流动方向,并写出电极反应式。
3C(g)+nD(g),开始时A为4 mol,B为6 mol,5 min末时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。计算:(1)5 min末A的物质的量浓度为________。(2)前5 min内用B表示的化学反应速率v(B)为________。(3)化学方程式中n值为________。(4)此反应在四种不同情况下的反应速率分别为:①v(A)=5 mol·L-1·min-1 ②v(B)=6 mol·L-1·min-1 ③v(C)=4.5 mol·L-1·min-1 ④v(D)=8 mol·L-1·min-1其中反应速率最快的是________(填编号)。23. 某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:方案Ⅰ:有人提出将形状和大小均相等的铁片和铜片,分别同时放入100 mL 2.0 mol/L稀硫酸中,观察产生气泡的快慢,据此可以确定它们的金属活动性。该原理的离子方程式为:________________________;若反应进行到2 min时共收集到标准状况下的气体1120 mL,则用硫酸表示的该反应的反应速率为(溶液体积变化忽略不计):________________________。方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出你设计的原电池装置图。注明电解质溶液名称和正负极材料,标出电子流动方向,并写出电极反应式。 正极反应式:_________________________________________________________。负极反应式:_________________________________________________________。方案Ⅲ:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不能雷同):________________________________________________________________________________________________________________________________________________,用离子方程式表示其反应原理:__________________________________________。24. 由铜片、锌片和200 mL稀H2SO4组成的原电池中,若锌片只发生电化学反应,则当铜片上共放出3.36 L(标准状况)气体时,H2SO4恰好完全消耗。求:(1)反应中消耗的锌的质量是多少?(Zn:65) (2)有多少个电子通过了导线? (3)原稀H2SO4的物质的量浓度是多少?
正极反应式:_________________________________________________________。负极反应式:_________________________________________________________。方案Ⅲ:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不能雷同):________________________________________________________________________________________________________________________________________________,用离子方程式表示其反应原理:__________________________________________。24. 由铜片、锌片和200 mL稀H2SO4组成的原电池中,若锌片只发生电化学反应,则当铜片上共放出3.36 L(标准状况)气体时,H2SO4恰好完全消耗。求:(1)反应中消耗的锌的质量是多少?(Zn:65) (2)有多少个电子通过了导线? (3)原稀H2SO4的物质的量浓度是多少?
第二章 章末检测试卷B一、选择题1.D 2.D 3.D 4.D 5.A 6.C 7.A 8.C 9.D 10.A 11.B 12.B 13.C 14.D 15.A 16.C 17.C 18.B 二、非选择题19.(1)①②④ (2)③ (3)②④ (4)②20.(1)放热 (2)A、C (3)正 产生无色气泡 2H++2e-===H2↑ 负 正21.Ⅰ.(1)反应物本身的性质 温度 温度越高 (2)1、2和4 接触面积越大 (3)锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率 (4)2.0 Ⅱ.(5)0.03 mol/(L·min) (6)X(g)+3Y(g)![]() 2Z(g)22.(1)1.5 mol·L-1 (2)0.2 mol·L-1·min-1(3)2 (4) ①23.(1)Ⅰ:Fe+2H+===Fe2++H2↑ 0.25 mol/(L·min) Ⅱ:
2Z(g)22.(1)1.5 mol·L-1 (2)0.2 mol·L-1·min-1(3)2 (4) ①23.(1)Ⅰ:Fe+2H+===Fe2++H2↑ 0.25 mol/(L·min) Ⅱ:  2H++2e-===H2↑ Fe-2e-===Fe2+ Ⅲ:将铁片置于CuSO4溶液中,一段时间后观察Fe表面有红色的金属铜析出,即可以证明金属铁的活泼性强于金属铜的 Fe+Cu2+===Fe2++Cu24.(1)9.75g (2)1.806×1023 (3)0.75 mol/L
2H++2e-===H2↑ Fe-2e-===Fe2+ Ⅲ:将铁片置于CuSO4溶液中,一段时间后观察Fe表面有红色的金属铜析出,即可以证明金属铁的活泼性强于金属铜的 Fe+Cu2+===Fe2++Cu24.(1)9.75g (2)1.806×1023 (3)0.75 mol/L
相关试卷
这是一份2022年高中化学必修二质量检测试题(含答案):化学反应与能量B卷,共5页。试卷主要包含了单项选择题,双项选择题,填空题等内容,欢迎下载使用。
这是一份2022年高中化学必修二课时练习:物质结构 元素周期律B Word版含答案,共8页。试卷主要包含了选择题,填空题等内容,欢迎下载使用。
这是一份2022年高中化学必修二课时练习:离子键 Word版含答案,共4页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。









