


所属成套资源:2022年高中化学必修2暑假同步巩固练习(含解析)
2022年高中化学必修2同步巩固练习(含解析):1-2-1元素周期律
展开
这是一份2022年高中化学必修2同步巩固练习(含解析):1-2-1元素周期律,共7页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
第1章 第2节 第1课时一、选择题1.有X、Y两种原子,X原子的M电子层比Y原子的M电子层少3个电子,Y原子的L电子层的电子数恰好为X原子L电子层电子数的2倍,X和Y分别是( )A.碳和铝 B.硅和钠 C.硼和氮 D.氯和碳【答案】 A2.核外电子层排布的规律之一是“倒数第三层电子数不超过32”,对此规律以下理解正确的是( )①K层为倒数第三层时,电子数不超过2个 ②L层为倒数第三层时,电子数不超过8个 ③M层为倒数第三层时,电子数不超过18个 ④N层为倒数第三层时,电子数不超过32个A.只有④ B.①②C.①④ D.①②③④【答案】 D3.若短周期元素中两种元素可以形成原子个数比为2∶3的化合物,则这两种元素的原子序数之差不可能是( )A.1 B.3 C.5 D.6【解析】 由题意可知两元素形成的化合物为X2Y3,则X元素可能是第ⅢA族的B元素和Al元素,Y元素可能是第ⅥA族的O元素和S元素,形成的化合物如Al2O3和Al2S3,则B、C项符合,再如N2O3,A项符合;只有D项不符合。故符合题意的为D项。【答案】 D4.下列叙述中正确的是( )A.两种粒子,若核外电子排布完全相同,则其化学性质一定相同B.凡1个原子形成的离子,一定具有稀有气体元素原子的核外电子排布C.两种原子,如果核外电子排布相同,则一定属于同种元素D.存在两种这样的阴、阳离子,其电子数和质子数均相同【答案】 C5.下列粒子中,具有还原性的是( )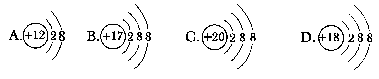 【答案】 B6.在下列所表示的微粒中,氧化性最强的是( )
【答案】 B6.在下列所表示的微粒中,氧化性最强的是( )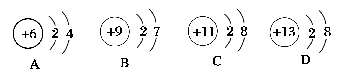 【解析】 四个选项的示意图表示的分别是碳原子、氟原子、钠离子、铝离子。“氧化性最强”,即得电子的能力最大。钠原子、铝原子都易失去电子,形成具有最外层为8个电子的稳定结构,则钠离子和铝离子都很难得到电子。氟原子比碳原子核电荷数大、最外层电子数多、原子半径小、原子核对核外电子的吸引力大,由此氟原子比碳原子氧化性强。【答案】 B7.下面所画的原子或离子的结构示意图,一定错误的是( )
【解析】 四个选项的示意图表示的分别是碳原子、氟原子、钠离子、铝离子。“氧化性最强”,即得电子的能力最大。钠原子、铝原子都易失去电子,形成具有最外层为8个电子的稳定结构,则钠离子和铝离子都很难得到电子。氟原子比碳原子核电荷数大、最外层电子数多、原子半径小、原子核对核外电子的吸引力大,由此氟原子比碳原子氧化性强。【答案】 B7.下面所画的原子或离子的结构示意图,一定错误的是( )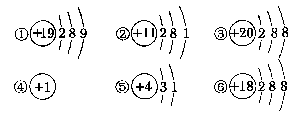 A.②③④ B.②⑤⑥ C.①⑤ D.①④⑤【答案】 C8.核电荷数1~20的元素中,下列叙述正确的是( )A.最外层只有1个电子的元素一定是金属元素B.最外层只有2个电子的元素一定是金属元素C.原子核外各电子层电子数相等的元素一定是金属元素D.核电荷数为17的元素原子容易获得1个电子【答案】 D【点拨】 A特例为H,B特例为He,均为非金属元素;C中H元素为非金属元素;D正确,17号为Cl,最外层为7个电子,易得到1个电子而达稳定结构。原子的最外层电子数和电子层数直接决定原子得失电子的难易,原子最外层电子数越少,电子层数越多,就越容易失去电子,单质的还原性就越强;原子最外层电子数越多,电子层数越少,就越容易得到电子,单质的氧化性就越强。9.与OH-具有相同的质子数和电子数的微粒是( )A.F- B.Cl- C.NH D.NH【答案】 A、D【点拨】 OH-的质子数为9,电子数为10,与OH-具有相同的质子数和电子数的微粒是F-和NH;Cl-的质子数为17,电子数为18,而NH带正电,与OH-的电性不同可首先排除。10.X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有1个电子,则X和Y形成的化合物的化学式可表示为( )A.XY B.XY2 C.XY3 D.X2Y3【答案】 A【点拨】 短周期中,最外层电子数是次外层电子数一半的元素有Li和Si,若X是Li,则它的前一周期中最外层只有1个电子的是H,两者能组成化合物LiH;若X是Si,则它的前一周期最外层只有1个电子是Li,Li和Si不能形成选项所示的化合物。二、非选择题11.核电荷数小于18的两种元素A、B,A原子最外层电子数为a,次外层电子数为b;B原子M层电子数为(a-b),L层电子数为(a+b)。则A是__________元素,B是__________元素。【答案】 氧 硅【点拨】 由于B原子核外M层有电子,L层必然饱和,即(a+b)=8;而A原子次外层电子数为b,而b<8,故b=2,则a=6。12.(1)画出下列元素的原子结构示意图。①核电荷数为13的元素:________________________________________________________________________________________________________________________________________________。②某元素原子的最外层电子数等于次外层电子数:________________________________________________________________________________________________________________________________________________。③L层电子数是M层电子数2倍的元素:________________________________________________________________________________________________________________________________________________。④某同位素原子核内没有中子的元素:________________________________________________________________________________________________________________________________________________。(2)写出1~8号元素中符合下列条件的原子(离子)的微粒符号和结构示意图。①某元素原子L层上的电子数为K层的3倍:________________________________________________________________________。②某元素原子L层上的电子数为K层的一半:________________________________________________________________________。③得到2个电子后,电子总数与氩原子的电子总数相同的离子:________________________________________________________________________。④某元素原子的最外层电子数等于次外层电子数的2倍:________________________________________________________________________。【答案】
A.②③④ B.②⑤⑥ C.①⑤ D.①④⑤【答案】 C8.核电荷数1~20的元素中,下列叙述正确的是( )A.最外层只有1个电子的元素一定是金属元素B.最外层只有2个电子的元素一定是金属元素C.原子核外各电子层电子数相等的元素一定是金属元素D.核电荷数为17的元素原子容易获得1个电子【答案】 D【点拨】 A特例为H,B特例为He,均为非金属元素;C中H元素为非金属元素;D正确,17号为Cl,最外层为7个电子,易得到1个电子而达稳定结构。原子的最外层电子数和电子层数直接决定原子得失电子的难易,原子最外层电子数越少,电子层数越多,就越容易失去电子,单质的还原性就越强;原子最外层电子数越多,电子层数越少,就越容易得到电子,单质的氧化性就越强。9.与OH-具有相同的质子数和电子数的微粒是( )A.F- B.Cl- C.NH D.NH【答案】 A、D【点拨】 OH-的质子数为9,电子数为10,与OH-具有相同的质子数和电子数的微粒是F-和NH;Cl-的质子数为17,电子数为18,而NH带正电,与OH-的电性不同可首先排除。10.X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有1个电子,则X和Y形成的化合物的化学式可表示为( )A.XY B.XY2 C.XY3 D.X2Y3【答案】 A【点拨】 短周期中,最外层电子数是次外层电子数一半的元素有Li和Si,若X是Li,则它的前一周期中最外层只有1个电子的是H,两者能组成化合物LiH;若X是Si,则它的前一周期最外层只有1个电子是Li,Li和Si不能形成选项所示的化合物。二、非选择题11.核电荷数小于18的两种元素A、B,A原子最外层电子数为a,次外层电子数为b;B原子M层电子数为(a-b),L层电子数为(a+b)。则A是__________元素,B是__________元素。【答案】 氧 硅【点拨】 由于B原子核外M层有电子,L层必然饱和,即(a+b)=8;而A原子次外层电子数为b,而b<8,故b=2,则a=6。12.(1)画出下列元素的原子结构示意图。①核电荷数为13的元素:________________________________________________________________________________________________________________________________________________。②某元素原子的最外层电子数等于次外层电子数:________________________________________________________________________________________________________________________________________________。③L层电子数是M层电子数2倍的元素:________________________________________________________________________________________________________________________________________________。④某同位素原子核内没有中子的元素:________________________________________________________________________________________________________________________________________________。(2)写出1~8号元素中符合下列条件的原子(离子)的微粒符号和结构示意图。①某元素原子L层上的电子数为K层的3倍:________________________________________________________________________。②某元素原子L层上的电子数为K层的一半:________________________________________________________________________。③得到2个电子后,电子总数与氩原子的电子总数相同的离子:________________________________________________________________________。④某元素原子的最外层电子数等于次外层电子数的2倍:________________________________________________________________________。【答案】 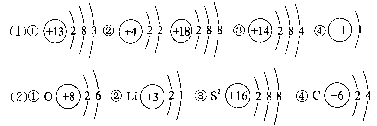 13.A、B两元素的离子具有相同的电子数,两元素的单质都能与水剧烈反应,在反应中,A单质作还原剂,B单质作氧化剂。(1)画出A原子的结构示意图________________________________________________________________________________________________________________________________________________,画出B离子的结构示意图________________________________________________________________________________________________________________________________________________。(2)A单质与水反应的化学方程式________________________________________________________________________________________________________________________________________________。B单质与水反应的化学方程式________________________________________________________________________________________________________________________________________________。【答案】
13.A、B两元素的离子具有相同的电子数,两元素的单质都能与水剧烈反应,在反应中,A单质作还原剂,B单质作氧化剂。(1)画出A原子的结构示意图________________________________________________________________________________________________________________________________________________,画出B离子的结构示意图________________________________________________________________________________________________________________________________________________。(2)A单质与水反应的化学方程式________________________________________________________________________________________________________________________________________________。B单质与水反应的化学方程式________________________________________________________________________________________________________________________________________________。【答案】 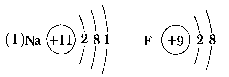 (2)2Na+2H2O===2NaOH+H2↑2F2+2H2O===4HF+O214.有V、W 、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20。其中X、Z是金属元素;V和Z元素原子的最外电子层都只有一个电子,且V元素的单质是最轻的气体;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半。由此推知(填元素符号)V是______________,W是__________、X是__________,Y是__________,Z是____________。【答案】 V:H W:O X:Al Y:S Z:K15.有X、Y、Z三种元素,已知X元素的-2价离子、Y元素的+1价离子的核外电子排布均与氖原子相同;Z元素最高价氧化物的分子组成为Z2O3,4.5gZ元素所形成的单质与足量盐酸反应,生成标准状况下的氢气5.6L。Z元素原子的原子核中质子数比中子数少1个。(1)X、Y、Z各是什么元素?X____________,Y____________,Z____________;(2)写出X与Y、X与Z分别形成化合物的化学式____________,____________,____________;(3)画出粒子X2-、Y+及Z的结构示意图________________________________________________________________________,________________________________________________________________________、________________________________________________________________________。【答案】 (1)O Na Al (2)Na2O Na2O2 Al2O3
(2)2Na+2H2O===2NaOH+H2↑2F2+2H2O===4HF+O214.有V、W 、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20。其中X、Z是金属元素;V和Z元素原子的最外电子层都只有一个电子,且V元素的单质是最轻的气体;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半。由此推知(填元素符号)V是______________,W是__________、X是__________,Y是__________,Z是____________。【答案】 V:H W:O X:Al Y:S Z:K15.有X、Y、Z三种元素,已知X元素的-2价离子、Y元素的+1价离子的核外电子排布均与氖原子相同;Z元素最高价氧化物的分子组成为Z2O3,4.5gZ元素所形成的单质与足量盐酸反应,生成标准状况下的氢气5.6L。Z元素原子的原子核中质子数比中子数少1个。(1)X、Y、Z各是什么元素?X____________,Y____________,Z____________;(2)写出X与Y、X与Z分别形成化合物的化学式____________,____________,____________;(3)画出粒子X2-、Y+及Z的结构示意图________________________________________________________________________,________________________________________________________________________、________________________________________________________________________。【答案】 (1)O Na Al (2)Na2O Na2O2 Al2O3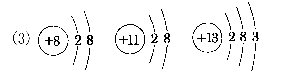 16.某粒子的结构示意图为
16.某粒子的结构示意图为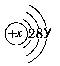 (1)x表示____________,该粒子有____________个电子层,y与粒子的____________关系非常密切。(2)当x-y=10时,该粒子为____________。(3)当y=8时,该粒子带有2个单位负电荷,该粒子的符合是____________。(4)当y=1和y=7的两中性原子化合时,形成的化合物属于____________化合物。【答案】 (1)质子数或核电荷数 3 化学性质 (2)原子 (3)S2- (4)离子17.下面是四种粒子的结构示意图,据此完成以下填空:
(1)x表示____________,该粒子有____________个电子层,y与粒子的____________关系非常密切。(2)当x-y=10时,该粒子为____________。(3)当y=8时,该粒子带有2个单位负电荷,该粒子的符合是____________。(4)当y=1和y=7的两中性原子化合时,形成的化合物属于____________化合物。【答案】 (1)质子数或核电荷数 3 化学性质 (2)原子 (3)S2- (4)离子17.下面是四种粒子的结构示意图,据此完成以下填空: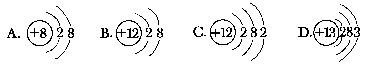 (1)属于阳离子结构的粒子是____________。(填字母序号)(2)B粒子的半径____________C粒子的半径。(填“大于”“小于”或“等于”)(3)某元素R形成的氧化物为R2O3,则R的原子结构示意图可能是____________.(填字母序号)【答案】 (1)B (2)小于 (3)D【点拨】 A中质子数-电子数=-2,为阴离子;B中质子数-电子数=2,为阳离子;C、D为原子。B、C为同一元素的阳离子和原子,其中B少一个电子层,原子半径B<C。在R2O3中,R显+3价,即R原子与O原子结合时失去3个电子,故R可能是D。18.结构示意图为
(1)属于阳离子结构的粒子是____________。(填字母序号)(2)B粒子的半径____________C粒子的半径。(填“大于”“小于”或“等于”)(3)某元素R形成的氧化物为R2O3,则R的原子结构示意图可能是____________.(填字母序号)【答案】 (1)B (2)小于 (3)D【点拨】 A中质子数-电子数=-2,为阴离子;B中质子数-电子数=2,为阳离子;C、D为原子。B、C为同一元素的阳离子和原子,其中B少一个电子层,原子半径B<C。在R2O3中,R显+3价,即R原子与O原子结合时失去3个电子,故R可能是D。18.结构示意图为 ![]() 的粒子。x值可能为__________、__________、__________、__________、__________、__________、__________,相应的粒子符号分别为________、________、________、__________、__________、__________、__________。【答案】 7 8 9 10 11 12 13 N3- O2- F- Ne Na+ Mg2+ Al3+19.有两种气态单质Am和Bn,已知2.4gAm和2.1gBn所含的原子个数相等,而分子数之比为2∶3。A和B的原子核内质子数都等于中子数,A原子L层电子数是K层的3倍。(1)A、B的元素符号分别为__________;(2)Am中的m值为__________。【解析】 依题意,设A、B相对原子质量分为x、y,所以解得2m=3n。所以n=2时,m=3。由结构推知A为O,由关系式得B为N。【答案】 (1)O、N (2)320.A、B、C、D、E五种元素,已知:①A原子最外层电子数是次外层电子数的2倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同,E原子M层上的电子比K层的多5个。②常温B2是气体,它对氢气的相对密度是16。③C的单质在B2中燃烧,生成淡黄色固体F,F与AB2反应可生成B2。④D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体DB2,D在DB2中的含量为50%。根据以上情况回答:(1)A、B、C、D、E各为什么元素?(写元素符号)(2)画出E的原子结构示意图,C的离子结构示意图。(3)写出F和AB2反应的化学方程式。【解析】 A的核外电子排布为
的粒子。x值可能为__________、__________、__________、__________、__________、__________、__________,相应的粒子符号分别为________、________、________、__________、__________、__________、__________。【答案】 7 8 9 10 11 12 13 N3- O2- F- Ne Na+ Mg2+ Al3+19.有两种气态单质Am和Bn,已知2.4gAm和2.1gBn所含的原子个数相等,而分子数之比为2∶3。A和B的原子核内质子数都等于中子数,A原子L层电子数是K层的3倍。(1)A、B的元素符号分别为__________;(2)Am中的m值为__________。【解析】 依题意,设A、B相对原子质量分为x、y,所以解得2m=3n。所以n=2时,m=3。由结构推知A为O,由关系式得B为N。【答案】 (1)O、N (2)320.A、B、C、D、E五种元素,已知:①A原子最外层电子数是次外层电子数的2倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同,E原子M层上的电子比K层的多5个。②常温B2是气体,它对氢气的相对密度是16。③C的单质在B2中燃烧,生成淡黄色固体F,F与AB2反应可生成B2。④D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体DB2,D在DB2中的含量为50%。根据以上情况回答:(1)A、B、C、D、E各为什么元素?(写元素符号)(2)画出E的原子结构示意图,C的离子结构示意图。(3)写出F和AB2反应的化学方程式。【解析】 A的核外电子排布为![]() ,是碳元素。B的阴离子含10个电子,常温下B2是气体,可能为N2、O2、F2,它的相对分子质量为32,所以B为O。C的阳离子也含10个电子,可能为Na、Mg,在O2中燃烧生成淡黄色固体,该固体为Na2O2,因此C为Na。D与O2反应,发出蓝紫色火焰,生成有刺激性气味的DB2,D为S,S在O2中燃烧,生成SO2,E原子M层上的电子比K层多5个,E为Cl元素,电子排布为
,是碳元素。B的阴离子含10个电子,常温下B2是气体,可能为N2、O2、F2,它的相对分子质量为32,所以B为O。C的阳离子也含10个电子,可能为Na、Mg,在O2中燃烧生成淡黄色固体,该固体为Na2O2,因此C为Na。D与O2反应,发出蓝紫色火焰,生成有刺激性气味的DB2,D为S,S在O2中燃烧,生成SO2,E原子M层上的电子比K层多5个,E为Cl元素,电子排布为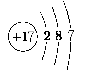 【答案】 C、O、Na、S、Cl
【答案】 C、O、Na、S、Cl
相关试卷
这是一份2022年高中化学必修2同步巩固练习(含解析):模块综合测试2,共11页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份2022年高中化学必修2同步巩固练习(含解析):1-2-3元素周期律,共7页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份2022年高中化学必修2同步巩固练习(含解析):模块综合测试1,共10页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。









