
所属成套资源:新教材2023高中化学新人教版选择性必修2同步测试(22份)
- 新教材2023高中化学第一章原子结构与性质第二节原子结构与元素的性质课时2元素周期律同步测试新人教版选择性必修2 试卷 0 次下载
- 新教材2023高中化学章末质量评估第二章分子结构与性质新人教版选择性必修2 试卷 试卷 0 次下载
- 新教材2023高中化学第二章分子结构与性质第一节共价键同步测试新人教版选择性必修2 试卷 0 次下载
- 新教材2023高中化学第二章分子结构与性质第三节分子结构与物质的性质课时1共价键的极性同步测试新人教版选择性必修2 试卷 0 次下载
- 新教材2023高中化学第二章分子结构与性质第三节分子结构与物质的性质课时2分子间的作用力分子的手性同步测试新人教版选择性必修2 试卷 0 次下载
新教材2023高中化学第二章分子结构与性质章末整合提升新人教版选择性必修2 试卷
展开
这是一份新教材2023高中化学第二章分子结构与性质章末整合提升新人教版选择性必修2,共6页。
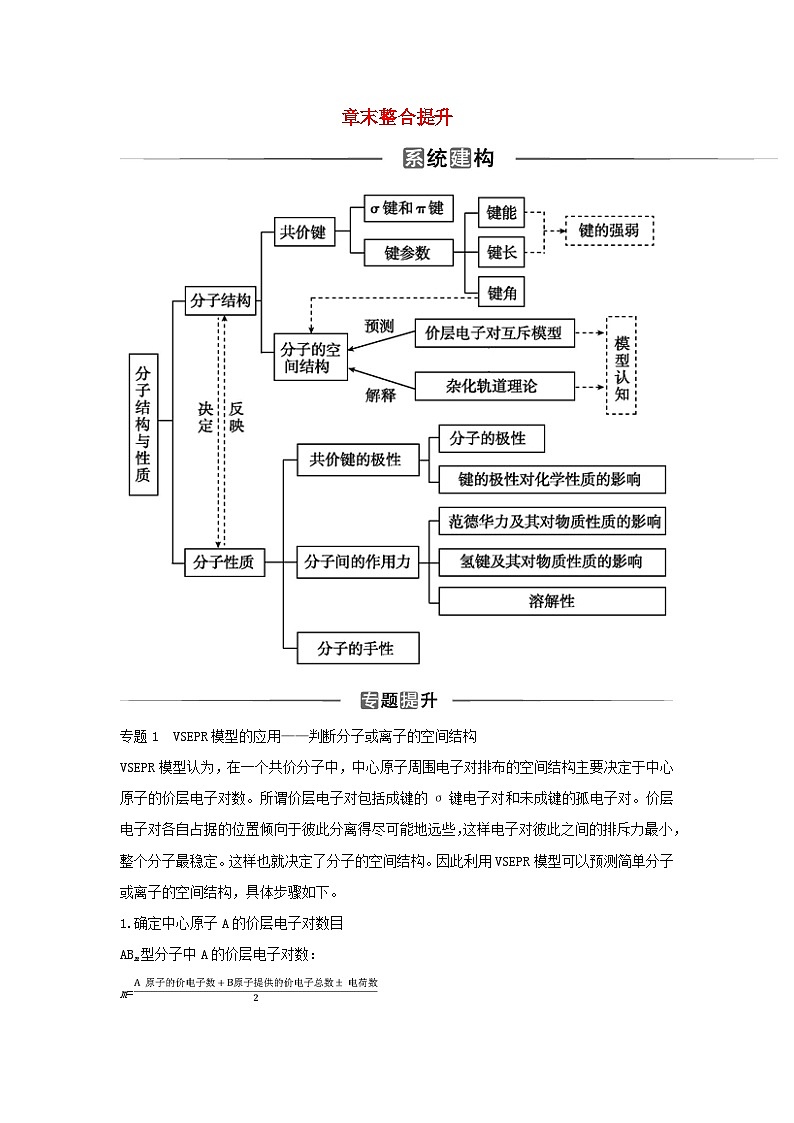
章末整合提升
专题1 VSEPR模型的应用——判断分子或离子的空间结构
VSEPR模型认为,在一个共价分子中,中心原子周围电子对排布的空间结构主要决定于中心原子的价层电子对数。所谓价层电子对包括成键的σ键电子对和未成键的孤电子对。价层电子对各自占据的位置倾向于彼此分离得尽可能地远些,这样电子对彼此之间的排斥力最小,整个分子最稳定。这样也就决定了分子的空间结构。因此利用VSEPR模型可以预测简单分子或离子的空间结构,具体步骤如下。
1.确定中心原子A的价层电子对数目
ABn型分子中A的价层电子对数:
m=
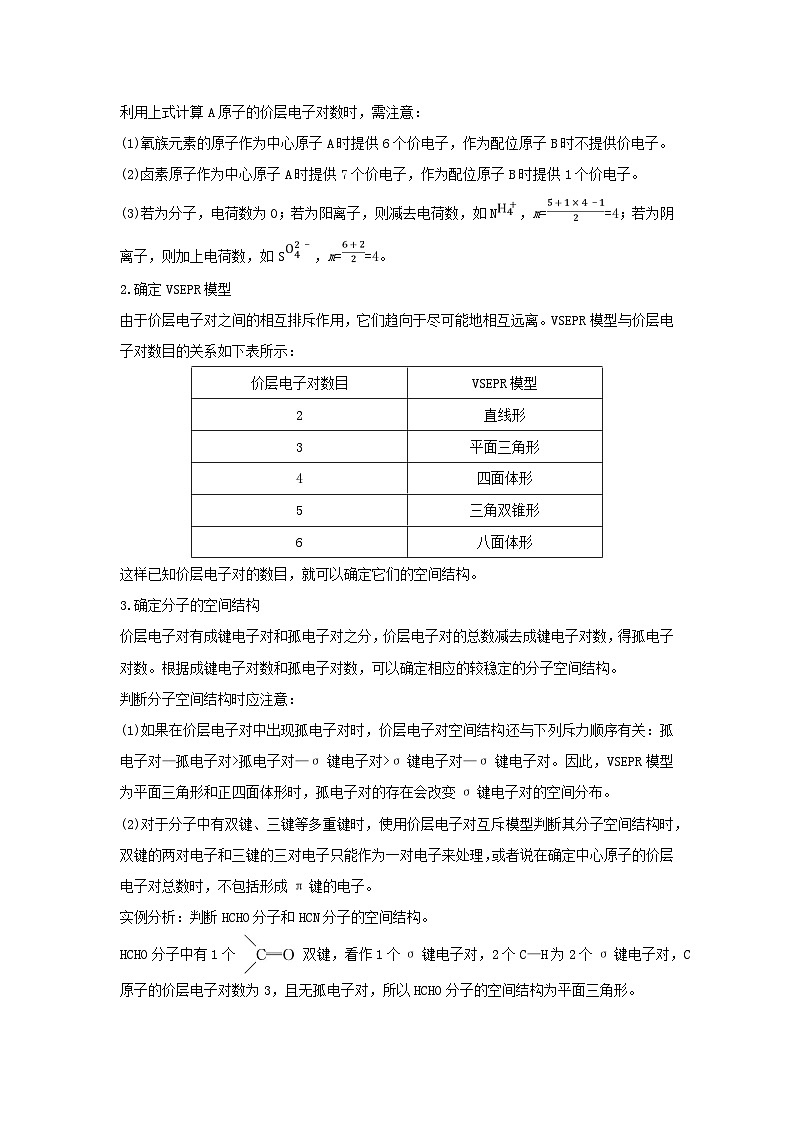
利用上式计算A原子的价层电子对数时,需注意:
(1)氧族元素的原子作为中心原子A时提供6个价电子,作为配位原子B时不提供价电子。
(2)卤素原子作为中心原子A时提供7个价电子,作为配位原子B时提供1个价电子。
(3)若为分子,电荷数为0;若为阳离子,则减去电荷数,如N,m==4;若为阴离子,则加上电荷数,如S,m==4。
2.确定VSEPR模型
由于价层电子对之间的相互排斥作用,它们趋向于尽可能地相互远离。VSEPR模型与价层电子对数目的关系如下表所示:
价层电子对数目
VSEPR模型
2
直线形
3
平面三角形
4
四面体形
5
三角双锥形
6
八面体形
这样已知价层电子对的数目,就可以确定它们的空间结构。
3.确定分子的空间结构
价层电子对有成键电子对和孤电子对之分,价层电子对的总数减去成键电子对数,得孤电子对数。根据成键电子对数和孤电子对数,可以确定相应的较稳定的分子空间结构。
判断分子空间结构时应注意:
(1)如果在价层电子对中出现孤电子对时,价层电子对空间结构还与下列斥力顺序有关:孤电子对—孤电子对>孤电子对—σ键电子对>σ键电子对—σ键电子对。因此,VSEPR模型为平面三角形和正四面体形时,孤电子对的存在会改变σ键电子对的空间分布。
(2)对于分子中有双键、三键等多重键时,使用价层电子对互斥模型判断其分子空间结构时,双键的两对电子和三键的三对电子只能作为一对电子来处理,或者说在确定中心原子的价层电子对总数时,不包括形成π键的电子。
实例分析:判断HCHO分子和HCN分子的空间结构。
HCHO分子中有1个双键,看作1个σ键电子对,2个C—H为2个σ键电子对,C原子的价层电子对数为3,且无孤电子对,所以HCHO分子的空间结构为平面三角形。
HCN分子的结构式为H—C≡N,含有1个C≡N三键,看作1个σ键电子对,1个C—H为1个σ键电子对,故C原子的价层电子对数为2,且无孤电子对,所以HCN分子的空间结构为直线形。
【例1】(1)在BF3分子中,F—B—F的键角是 ,硼原子的杂化轨道类型为 ,BF3与过量NaF作用可生成NaBF4,B的空间结构为 。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。NH3分子的空间结构是 ;N2H4分子中氮原子的杂化轨道类型是 。
(3)H+可与H2O形成H3O+,H3O+中氧原子采用 杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为 。
(4)S的空间结构是 ,其中硫原子的价层电子对互斥模型是 。
【思维提示】(1)BF3的价层电子对数为3,B原子采取sp2杂化,又因为B原子上没有孤电子对,则BF3的空间结构为平面正三角形,F—B—F的键角为120°。而B中B原子价层电子对数为4,B原子采取sp3杂化,且没有孤电子对,则B的空间结构为正四面体形。(2)NH3分子的空间结构为三角锥形,N2H4中氮原子与NH3中氮原子杂化类型相同,均为sp3杂化。(3)H3O+中氧原子采用sp3杂化。(4)S的中心原子S的价层电子对数为4,无孤电子对,分子的空间结构和价层电子对互斥模型均为正四面体形。
答案:(1)120° sp2 正四面体形
(2)三角锥形 sp3
(3)sp3 H2O中氧原子有2个孤电子对,H3O+中氧原子只有1个孤电子对,排斥力较小
(4)正四面体形 正四面体形
专题2 共价分子中原子最外层8电子结构的判断方法
1.由分子的电子式判断
如CS2的电子式(与CO2相似)为,表明CS2分子中所有原子最外层达8电子稳定结构。
2.化合价法
(1)含H原子的分子:分子中的H原子一定不满足原子最外层8电子结构。
(2)不含H原子的分子:分子中不含有H原子,则看某元素化合价绝对值与其原子最外层电子数之和是否等于8,即“|元素化合价|+最外层电子数”之和是否等于8,如CO2分子中的C原子:|+4|+4=8;O原子:|-2|+6=8,都满足最外层8电子结构;再如BF3分子中的B原子:|+3|+3=6≠8,未达到8电子结构。
(3)非金属单质:若为同种元素构成的双原子分子,则看该元素原子的最外层电子数与其在分子中形成的共价键数之和是否为8即可。若为8,则其原子最外层满足8电子结构;反之,则不能满足。如N2、Cl2等均满足8电子结构。
【例2】下列各分子中所有原子都满足最外层为8电子结构的是 ( )
A.BeCl2 B.PCl3 C.PCl5 D.BF3
【思维提示】BeCl2分子中的Be原子最外层只有4个电子;PCl5中的P原子最外层为10个电子,超过8个电子;BF3中B原子最外层有6个电子。
答案:B
专题3 五种方法判断分子的极性
分子极性的判断:看一个分子是不是极性分子,就要看整个分子里的电荷分布是否对称,电荷均匀分布为非极性分子,不均匀分布为极性分子。分子是否有极性,不能仅由键的极性决定,也取决于分子的空间结构。分子的极性可以从以下几方面来判断。
1.看化学键类型
(1)只由非极性共价键构成或不含共价键的分子一定是非极性分子;
(2)只含有极性共价键的分子可能是极性分子也可能是非极性分子;
(3)含有非极性共价键的分子也可能是极性分子;
(4)极性分子一定含有极性共价键,也可能含有非极性共价键。
2.看键角
以极性共价键结合的多原子分子中,有些属于极性分子,有些属于非极性分子,这取决于分子中各键的空间排列,而键角是决定分子空间结构的因素之一。三原子分子CO2、CS2及四原子分子C2H2,虽然都含有极性共价键,但分子中键角均为180°,因电荷分布完全对称,所以是非极性分子。而同样是三原子分子的H2O、H2S、HCN等分子,由于电荷分布不对称,都是极性分子。
3.看分子的对称性
如CH4分子的正四面体形和BF3分子的平面正三角形都是完全对称的空间结构,虽然分子中有极性共价键,但分子空间结构具有对称性,从整体看,键的极性相互抵消,故为非极性分子。而CHCl3、NH3等分子因分子空间结构不对称而为极性分子。
4.看化合价
分子内中心原子的化合价绝对值(或可理解为共价单键数目,一个双键看作两个单键)等于其主族序数(即最外层电子数)时,分子为非极性分子,如BF3、CH4、CO2、PCl5、SiCl4、SO3、BeCl2等均为非极性分子,其他的如NO2、CO、SO2、NH3、NF3等为极性分子。
5.看孤电子对
分子内中心原子的最外层无孤电子对(非共用电子对)时,分子为非极性分子,如CO2、CS2、BeCl2、CCl4、BCl3、PCl5等均为非极性分子。另外,上述分子中除了BeCl2、BCl3、PCl5分子外,其余的分子中所有成键原子的最外层均达8电子稳定结构。而BeCl2分子中的Be原子最外层只有4个电子,BCl3分子中的B原子最外层只有6个电子,PCl5分子中P原子的最外层电子肯定超过8个,但它们都能稳定存在,说明原子通过得失电子或共用电子对而达到稳定结构时不一定都要满足最外层2个电子或8个电子的饱和结构。
【例3】请指出表中分子的空间结构,判断其中哪些属于极性分子,哪些属于非极性分子。
分子
键的类型
空间结构
极性(非极性)分子
N2
CO2
BF3
CCl4
C2H6
—
H2O2
—
NH3
【思维提示】由于N2、CO2、BF3、CCl4、C2H6均为对称结构,所以它们均为非极性分子。H2O2、NH3的空间结构不对称,均为极性分子。
答案:
分子
键的类型
空间结构
极性(非极性)分子
N2
非极性共价键
直线形
非极性分子
CO2
极性共价键
直线形
非极性分子
BF3
极性共价键
平面正
三角形
非极性分子
CCl4
极性共价键
正四面体形
非极性分子
C2H6
极性共价键、
非极性共价键
—
非极性分子
H2O2
极性共价键、
非极性共价键
—
极性分子
NH3
极性共价键
三角锥形
极性分子





