所属成套资源:新教材2023高中化学新人教版选择性必修2同步测试(22份)
- 新教材2023高中化学第二章分子结构与性质第二节分子的空间结构课时2杂化轨道理论简介同步测试新人教版选择性必修2 试卷 0 次下载
- 新教材2023高中化学章末质量评估第三章晶体结构与性质新人教版选择性必修2 试卷 试卷 0 次下载
- 新教材2023高中化学第三章晶体结构与性质第一节物质的聚集状态与晶体的常识课时1物质的聚集状态晶体与非晶体同步测试新人教版选择性必修2 试卷 0 次下载
- 新教材2023高中化学第三章晶体结构与性质第一节物质的聚集状态与晶体的常识课时2晶胞晶体结构的测定同步测试新人教版选择性必修2 试卷 0 次下载
- 新教材2023高中化学第三章晶体结构与性质第三节金属晶体与离子晶体同步测试新人教版选择性必修2 试卷 0 次下载
新教材2023高中化学第三章晶体结构与性质章末整合提升新人教版选择性必修2 试卷
展开
这是一份新教材2023高中化学第三章晶体结构与性质章末整合提升新人教版选择性必修2,共5页。
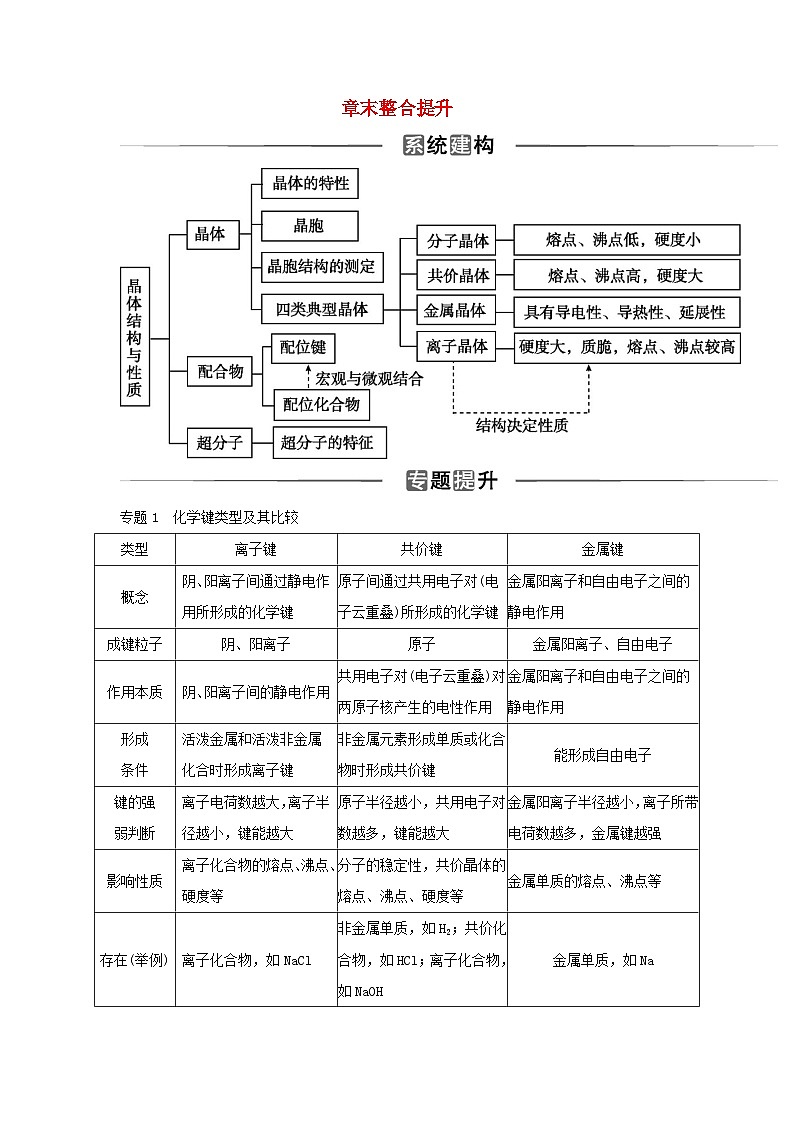
章末整合提升
专题1 化学键类型及其比较
类型
离子键
共价键
金属键
概念
阴、阳离子间通过静电作用所形成的化学键
原子间通过共用电子对(电子云重叠)所形成的化学键
金属阳离子和自由电子之间的静电作用
成键粒子
阴、阳离子
原子
金属阳离子、自由电子
作用本质
阴、阳离子间的静电作用
共用电子对(电子云重叠)对两原子核产生的电性作用
金属阳离子和自由电子之间的静电作用
形成
条件
活泼金属和活泼非金属化合时形成离子键
非金属元素形成单质或化合物时形成共价键
能形成自由电子
键的强
弱判断
离子电荷数越大,离子半径越小,键能越大
原子半径越小,共用电子对数越多,键能越大
金属阳离子半径越小,离子所带电荷数越多,金属键越强
影响性质
离子化合物的熔点、沸点、硬度等
分子的稳定性,共价晶体的熔点、沸点、硬度等
金属单质的熔点、沸点等
存在(举例)
离子化合物,如NaCl
非金属单质,如H2;共价化合物,如HCl;离子化合物,如NaOH
金属单质,如Na
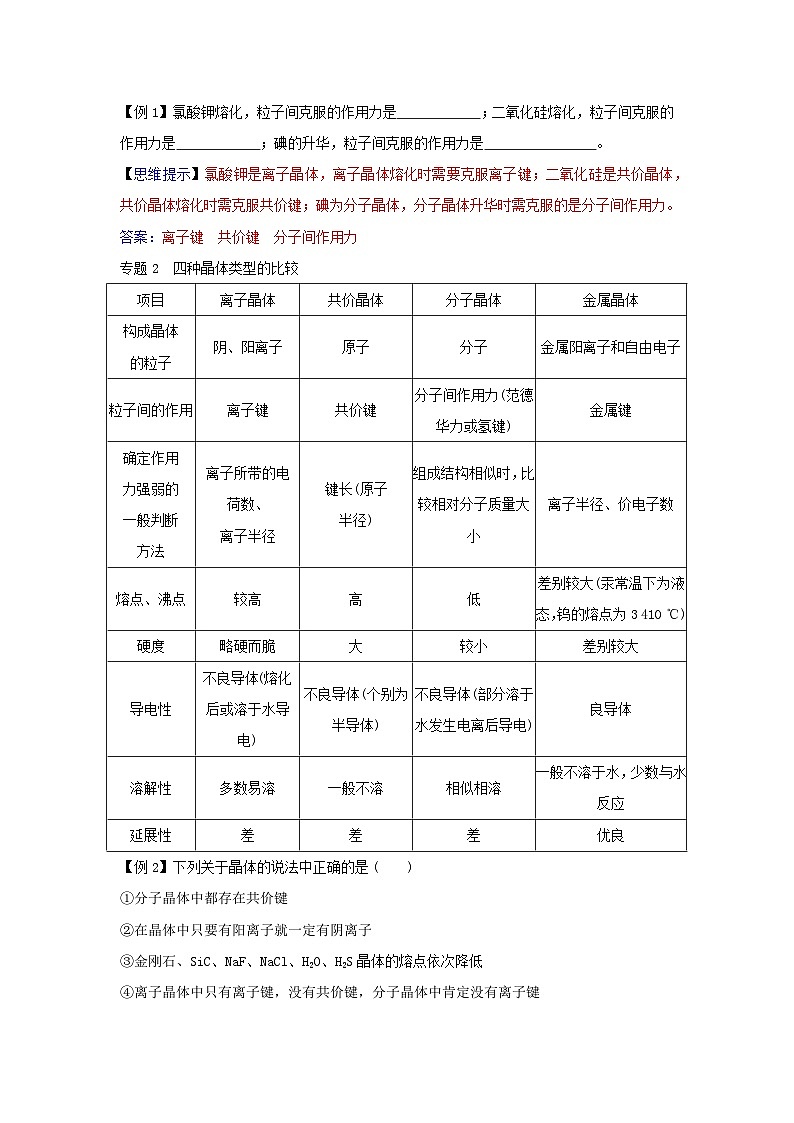
【例1】氯酸钾熔化,粒子间克服的作用力是 ;二氧化硅熔化,粒子间克服的作用力是 ;碘的升华,粒子间克服的作用力是 。
【思维提示】氯酸钾是离子晶体,离子晶体熔化时需要克服离子键;二氧化硅是共价晶体,共价晶体熔化时需克服共价键;碘为分子晶体,分子晶体升华时需克服的是分子间作用力。
答案:离子键 共价键 分子间作用力
专题2 四种晶体类型的比较
项目
离子晶体
共价晶体
分子晶体
金属晶体
构成晶体
的粒子
阴、阳离子
原子
分子
金属阳离子和自由电子
粒子间的作用
离子键
共价键
分子间作用力(范德华力或氢键)
金属键
确定作用
力强弱的
一般判断
方法
离子所带的电荷数、
离子半径
键长(原子
半径)
组成结构相似时,比较相对分子质量大小
离子半径、价电子数
熔点、沸点
较高
高
低
差别较大(汞常温下为液态,钨的熔点为3 410 ℃)
硬度
略硬而脆
大
较小
差别较大
导电性
不良导体(熔化后或溶于水导电)
不良导体(个别为半导体)
不良导体(部分溶于水发生电离后导电)
良导体
溶解性
多数易溶
一般不溶
相似相溶
一般不溶于水,少数与水反应
延展性
差
差
差
优良
【例2】下列关于晶体的说法中正确的是 ( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键,没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥B.①②④C.③⑤⑦D.③⑤⑧
【思维提示】稀有气体的晶体内不含化学键;金属晶体中含阳离子和自由电子,无阴离子;离子晶体内可能有共价键;SiO2晶体中每个硅原子与四个氧原子以共价键相结合;分子的稳定性由共价键的键能决定,与分子间作用力无关。
答案:D
专题3 判断晶体类型的常用方法
1.根据晶体的概念判断
依据构成晶体的粒子和粒子间的作用力判断。
如由阴、阳离子通过离子键形成的晶体属于离子晶体;由分子通过分子间作用力形成的晶体属于分子晶体;由原子通过共价键形成的晶体属于共价晶体;由金属阳离子和自由电子通过金属键形成的晶体属于金属晶体。
2.根据物质的类别判断
按照物质所属的类别也可进行判断。一般来说,金属氧化物(Na2O、MgO、Na2O2等)、强碱和绝大多数盐类属于离子晶体;大多数非金属单质(金刚石、石墨、晶体硅、晶体硼等除外)、所有非金属氢化物、部分非金属氧化物(SiO2等除外)、酸和大多数有机化合物(有机盐除外)属于分子晶体;金属单质属于金属晶体;常见的共价晶体单质有金刚石、晶体硼等,常见的共价晶体化合物有SiC、SiO2等。
3.根据晶体的特征性质判断
根据不同晶体的特征性质(如熔点、沸点、溶解性、导电性、硬度和机械性能等)的不同和相应规律来判断。如熔点、沸点较低且不导电的单质和化合物一般为分子晶体;熔点、沸点较高且在水溶液中或熔融状态下导电的化合物一般为离子晶体;熔点、沸点很高,硬度很大,不导电,不溶于一般溶剂的物质一般为共价晶体;金属单质(在熔融状态和固态时均能导电)为金属晶体。
【例3】(1)分析下列物质的物理性质,判断其晶体类型:
①碳化铝,黄色晶体,熔点2 200 ℃,熔融态不导电: ;
②溴化铝,无色晶体,熔点98 ℃,熔融态不导电: ;
③五氟化矾,无色晶体,熔点19.5 ℃,易溶于乙醇、氯仿、丙酮中: ;
④溴化钾,无色晶体,熔融时或溶于水中都能导电: 。
(2)三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为 。
【思维提示】(1)晶体的熔点高低、熔融态能否导电及溶解性等性质是判断晶体类型的重要依据。共价晶体和离子晶体的熔点都很高或较高,两者最大的差异是熔融态的导电性不同,共价晶体熔融态不导电,离子晶体熔融时或其水溶液都能导电。共价晶体和分子晶体的区别则主要在于熔点、沸点有很大差异。一般共价晶体和分子晶体熔融态时都不能导电。另外,易溶于一些有机溶剂往往也是分子晶体的特征之一。(2)根据题目中的信息知,FeCl3的熔点、沸点低,易溶于水等,符合分子晶体的特征。
答案:(1)①共价晶体 ②分子晶体 ③分子晶体 ④离子晶体
(2)分子晶体
专题4 晶体熔点、沸点高低的比较
1.不同晶体类型的熔点、沸点高低规律
一般为共价晶体>离子晶体>分子晶体。金属晶体的熔点、沸点有的很高(如钨),有的很低(如汞)。
2.同属于共价晶体
一般构成晶体的原子半径越小,熔点、沸点越高。如熔点:金刚石(C—C)>二氧化硅(Si—O)>碳化硅(Si—C)>晶体硅(Si—Si)。
3.同属于离子晶体
离子所带电荷越多,离子半径越小,则离子键越强,熔点、沸点越高。如熔点:MgO>NaCl>CsCl。
4.同属于金属晶体
金属原子的价电子数越多,半径越小,金属键越强,熔点、沸点越高。如熔点:Al>Mg>Na。
5.同属于分子晶体
分子间作用力越强,熔点、沸点越高。
(1)组成和结构相似的分子晶体,一般相对分子质量越大,分子间作用力越强,熔点、沸点越高。如熔点:I2>Br2>Cl2>F2。
(2)相对分子质量相同或相近的物质,分子的极性越大,熔点、沸点越高。如沸点:CO>N2。
(3)同分异构体之间:
①一般是支链越多,熔点、沸点越低。如沸点:正戊烷>异戊烷>新戊烷。
②结构越对称,熔点、沸点越低。如沸点:邻二甲苯>间二甲苯>对二甲苯。
(4)若分子间有氢键,则分子间作用力比结构相似的同类晶体大,故熔点、沸点较高。如沸点:HF>HI>HBr>HCl。
(5)状态不同的物质在相同条件下,熔点、沸点:固体>液体>气体。如熔点、沸点:S>Hg>O2。
【例4】(1)下列物质性质的变化规律与共价键的键能大小有关的是
(填字母)。
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
(2)现有四种晶体:①NaCl晶体;②HCl晶体;③冰;④金刚石。晶体的熔点大小顺序为 (填序号)。
【思维提示】(1)F2、Cl2、Br2、I2均为分子晶体,它们熔点、沸点的高低与分子间作用力的大小有关;物质的稳定性与化学键的键能大小有关,HF、HCl、HBr、HI均为共价化合物,共价键的键能越大,分子的热稳定性越高;金刚石和晶体硅均为共价晶体,原子间共价键的键能越大,该共价晶体的硬度、熔点、沸点就越大,金刚石中的C—C的键能大于晶体硅中的Si—Si的键能;NaF、NaCl、NaBr、NaI均为离子化合物,其晶体是离子晶体,离子晶体熔点的高低与离子键的键能大小有关。(2)金刚石为共价晶体,熔点最高,NaCl为离子晶体,熔点比冰和HCl的熔点高;H2O分子之间形成氢键,熔点比HCl的熔点高。
答案:(1)BC
(2)④>①>③>②





