


所属成套资源:新教材2023高中化学新人教版选择性必修2同步测试(22份)
高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体同步训练题
展开
这是一份高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体同步训练题,共8页。
第二节分子晶体与共价晶体课时1 分子晶体【基础巩固】1.下列物质固态时一定是分子晶体的是 ( )A.酸性氧化物 B.碱性氧化物C.含氧酸 D.非金属单质解析:利用举特例法解题。A项,SiO2为酸性氧化物,不属于分子晶体;B项,Na2O、CaO等碱性氧化物不属于分子晶体;D项,金刚石、晶体硅等非金属单质不属于分子晶体。答案:C2.下列各组晶体都属于由化合物组成的分子晶体的是 ( )A.H2O、O3、CCl4 B.CCl4、(NH4)2S、H2O2C.SO2、SiO2、CS2 D.P2O5、CO2、H3PO4解析:A项,O3为单质;B项,(NH4)2S不属于分子晶体;C项,SiO2不属于分子晶体。答案:D 3.下列有关物质结构和性质的叙述中错误的是 ( )A.水是一种非常稳定的化合物,这是由于水中存在氢键B.由极性共价键形成的分子可能是非极性分子C.水和冰中都含有氢键D.分子晶体中一定存在范德华力,可能有共价键解析:H2O中O具有很强的得电子能力,因此与H形成的共价键很稳定,不容易被破坏,这与水中存在氢键无关,氢键影响的是物质的物理性质;大多数分子晶体中存在共价键,但稀有气体中不存在共价键。答案:A 4.(2022·广东江门)干冰(固态二氧化碳)在-78 ℃时可直接升华为气体,其晶胞结构如图所示。下列说法错误的是 ( )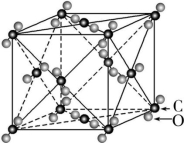 A.干冰晶体是共价晶体B.每个晶胞中含有4个CO2分子C.每个CO2分子周围有12个紧邻的CO2分子D.干冰升华时需克服分子间作用力解析:由题干信息可知,干冰(固态二氧化碳)在-78 ℃时可直接升华为气体,干冰晶体是分子晶体,A项错误;由题干图示晶胞图可知,每个晶胞中含有8×
A.干冰晶体是共价晶体B.每个晶胞中含有4个CO2分子C.每个CO2分子周围有12个紧邻的CO2分子D.干冰升华时需克服分子间作用力解析:由题干信息可知,干冰(固态二氧化碳)在-78 ℃时可直接升华为气体,干冰晶体是分子晶体,A项错误;由题干图示晶胞图可知,每个晶胞中含有8×![]() +6×
+6×![]() =4个CO2分子,B项正确;由题干图示晶胞图可知,以其中面心上的一个CO2为例,其周围有3个相互垂直的平面,每个平面上有4个CO2与之最近且距离相等,则每个CO2分子周围有12个紧邻的CO2分子,C项正确;已知干冰是分子晶体,故干冰升华时需克服分子间作用力,D项正确。答案:A5.HF分子晶体、NH3分子晶体与冰的结构极为相似,在HF分子晶体中,与F原子距离最近的HF分子的个数为 ( )A.3 B.4 C.5 D.12解析:根据HF分子晶体与冰结构相似可知,每个HF分子周围有4个HF分子与之最近,构成正四面体,故B项正确。答案:B6.某化学兴趣小组在学习分子晶体后,查阅了几种氯化物的熔点、沸点,记录如下:物质NaClMgCl2SiCl4CaCl2熔点/℃801712-70782沸点/℃1 4651 418571 600根据这些数据分析,其中属于分子晶体的是 ( )A.NaCl、MgCl2、CaCl2 B.SiCl4C.NaCl、CaCl2 D.全部解析:分子晶体的熔点、沸点较低,表中的SiCl4熔点、沸点较低,应为分子晶体。答案:B7.干冰晶体晶胞结构如图所示,即每8个CO2构成立方体,且在6个面的中心又各占据1个CO2分子,在每个CO2周围距离
=4个CO2分子,B项正确;由题干图示晶胞图可知,以其中面心上的一个CO2为例,其周围有3个相互垂直的平面,每个平面上有4个CO2与之最近且距离相等,则每个CO2分子周围有12个紧邻的CO2分子,C项正确;已知干冰是分子晶体,故干冰升华时需克服分子间作用力,D项正确。答案:A5.HF分子晶体、NH3分子晶体与冰的结构极为相似,在HF分子晶体中,与F原子距离最近的HF分子的个数为 ( )A.3 B.4 C.5 D.12解析:根据HF分子晶体与冰结构相似可知,每个HF分子周围有4个HF分子与之最近,构成正四面体,故B项正确。答案:B6.某化学兴趣小组在学习分子晶体后,查阅了几种氯化物的熔点、沸点,记录如下:物质NaClMgCl2SiCl4CaCl2熔点/℃801712-70782沸点/℃1 4651 418571 600根据这些数据分析,其中属于分子晶体的是 ( )A.NaCl、MgCl2、CaCl2 B.SiCl4C.NaCl、CaCl2 D.全部解析:分子晶体的熔点、沸点较低,表中的SiCl4熔点、沸点较低,应为分子晶体。答案:B7.干冰晶体晶胞结构如图所示,即每8个CO2构成立方体,且在6个面的中心又各占据1个CO2分子,在每个CO2周围距离![]() a(其中a为立方体的棱长)的CO2有 ( )
a(其中a为立方体的棱长)的CO2有 ( )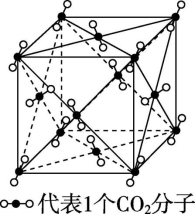 A.4个 B.8个 C.12个 D.6个解析:如题图所示,在每个CO2周围距离
A.4个 B.8个 C.12个 D.6个解析:如题图所示,在每个CO2周围距离![]() a的CO2即为每个面心上的CO2分子,共有12个。答案:C 8.(2022·广东潮州)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如图所示,下列说法错误的是 ( )
a的CO2即为每个面心上的CO2分子,共有12个。答案:C 8.(2022·广东潮州)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如图所示,下列说法错误的是 ( )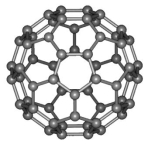 A.分子中碳原子轨道的杂化类型为sp2杂化B.1 mol C60分子中σ键的数目为90 NAC.1个C60分子中含有20个五边形和12个六边形D.C60分子晶胞是分子密堆积解析:由结构可知,富勒烯中的每个碳原子均只与周围三个碳原子相连,每个碳原子都采用sp2杂化,A项正确;1 mol C60分子中σ键的数目为3×60×
A.分子中碳原子轨道的杂化类型为sp2杂化B.1 mol C60分子中σ键的数目为90 NAC.1个C60分子中含有20个五边形和12个六边形D.C60分子晶胞是分子密堆积解析:由结构可知,富勒烯中的每个碳原子均只与周围三个碳原子相连,每个碳原子都采用sp2杂化,A项正确;1 mol C60分子中σ键的数目为3×60×![]() ×NA=90 NA,B项正确;多面体的顶点数、面数和棱边数的关系遵循欧拉定理,顶点数+面数-棱边数=2,设五边形个数为x,六边形个数为y,根据富勒烯结构,富勒烯有60个顶点,面数为(x+y),每个棱被2个面共有,棱数为
×NA=90 NA,B项正确;多面体的顶点数、面数和棱边数的关系遵循欧拉定理,顶点数+面数-棱边数=2,设五边形个数为x,六边形个数为y,根据富勒烯结构,富勒烯有60个顶点,面数为(x+y),每个棱被2个面共有,棱数为![]() ×(3×60),根据欧拉定理有60+(x+y)-
×(3×60),根据欧拉定理有60+(x+y)-![]() ×(3×60)=2,根据键数和顶点,得出
×(3×60)=2,根据键数和顶点,得出![]() ×(5x+6y)=
×(5x+6y)=![]() ×(3×60),推出x=12,y=20,即五边形有12个,六边形有20个, C项错误;C60晶体为面心立方排布,因此晶体中1个C60分子有12个紧邻的C60分子,属于分子密堆积类型,D项正确。答案:C 9.(1)比较下列物质熔点、沸点的高低(均填“>”或“<”)。①CO2 SO2 ②NH3 PH3 ③O3 O2 ④Ne Ar ⑤CH3CH2OH CH3OH ⑥CO N2 (2)设计一个可靠的实验,判断氯化铝是离子化合物还是共价化合物。你设计的实验是 。 解析:(2)若验证一种化合物是共价化合物还是离子化合物,可测其熔融状态下是否导电,若不导电,是共价化合物,若导电,则是离子化合物。答案: (1)①< ②> ③> ④< ⑤> ⑥>(2)在熔融状态下,验证其是否导电,若不导电,是共价化合物10.自从合成了第一种稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。(1)请根据XeF4的结构示意图(图甲)判断这个分子是极性分子还是非极性分子? 。 (2)XeF2晶体是一种无色晶体,图乙为它的晶胞结构图。XeF2晶体属于哪种类型的晶体? 。一个XeF2晶胞中含有 个XeF2分子。
×(3×60),推出x=12,y=20,即五边形有12个,六边形有20个, C项错误;C60晶体为面心立方排布,因此晶体中1个C60分子有12个紧邻的C60分子,属于分子密堆积类型,D项正确。答案:C 9.(1)比较下列物质熔点、沸点的高低(均填“>”或“<”)。①CO2 SO2 ②NH3 PH3 ③O3 O2 ④Ne Ar ⑤CH3CH2OH CH3OH ⑥CO N2 (2)设计一个可靠的实验,判断氯化铝是离子化合物还是共价化合物。你设计的实验是 。 解析:(2)若验证一种化合物是共价化合物还是离子化合物,可测其熔融状态下是否导电,若不导电,是共价化合物,若导电,则是离子化合物。答案: (1)①< ②> ③> ④< ⑤> ⑥>(2)在熔融状态下,验证其是否导电,若不导电,是共价化合物10.自从合成了第一种稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。(1)请根据XeF4的结构示意图(图甲)判断这个分子是极性分子还是非极性分子? 。 (2)XeF2晶体是一种无色晶体,图乙为它的晶胞结构图。XeF2晶体属于哪种类型的晶体? 。一个XeF2晶胞中含有 个XeF2分子。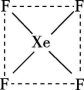 甲
甲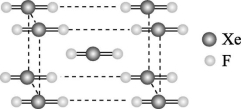 乙解析:由其结构示意图可知,XeF4是非极性分子,XeF2是分子晶体。答案:(1)非极性分子 (2)分子晶体 2【拓展提高】11.(2022·广东肇庆)下列说法正确的有 ( )①分子晶体的构成粒子是分子,都具有分子密堆积的特征 ②冰融化时,分子中H—O发生断裂 ③分子晶体在干燥或熔融时,均能导电 ④分子晶体中,分子间作用力越大,通常熔点越高 ⑤分子晶体中,共价键键能越大,该分子晶体的熔点一定越高 ⑥分子晶体的熔、沸点一般比较低 ⑦分子晶体中,分子间以分子间作用力相结合,分子间作用力越大,分子越稳定A.2项 B.3项 C.4项 D.5项解析:①分子晶体的构成粒子是分子,但只含有分子间作用力的分子晶体具有分子密堆积的特征,含有氢键的分子晶体不是密堆积,故①错误;②冰融化克服氢键,属于物理变化,水分子中H—O没有断裂,故②错误;③分子晶体在干燥或熔融时,均不能导电,故③错误;④分子晶体中,分子间作用力越大,分子的熔、沸点越高,故④正确;⑤分子晶体熔化时破坏分子间作用力,不破坏分子内共价键,即说明分子内共价键键能大小与该分子晶体的熔点高低无关,故⑤错误;⑥分子晶体熔化时破坏分子间作用力,而分子间作用力一般较弱,导致其熔沸点较低,故⑥正确;⑦分子的稳定性与分子间作用力无关,稳定性属于化学性质,分子间作用力影响物理性质,故⑦错误。只有④⑥正确,故答案为A项。答案:A12.AB型化合物形成的晶体结构多种多样。如图所示的几种结构所表示的物质最有可能是分子晶体的是 ( )
乙解析:由其结构示意图可知,XeF4是非极性分子,XeF2是分子晶体。答案:(1)非极性分子 (2)分子晶体 2【拓展提高】11.(2022·广东肇庆)下列说法正确的有 ( )①分子晶体的构成粒子是分子,都具有分子密堆积的特征 ②冰融化时,分子中H—O发生断裂 ③分子晶体在干燥或熔融时,均能导电 ④分子晶体中,分子间作用力越大,通常熔点越高 ⑤分子晶体中,共价键键能越大,该分子晶体的熔点一定越高 ⑥分子晶体的熔、沸点一般比较低 ⑦分子晶体中,分子间以分子间作用力相结合,分子间作用力越大,分子越稳定A.2项 B.3项 C.4项 D.5项解析:①分子晶体的构成粒子是分子,但只含有分子间作用力的分子晶体具有分子密堆积的特征,含有氢键的分子晶体不是密堆积,故①错误;②冰融化克服氢键,属于物理变化,水分子中H—O没有断裂,故②错误;③分子晶体在干燥或熔融时,均不能导电,故③错误;④分子晶体中,分子间作用力越大,分子的熔、沸点越高,故④正确;⑤分子晶体熔化时破坏分子间作用力,不破坏分子内共价键,即说明分子内共价键键能大小与该分子晶体的熔点高低无关,故⑤错误;⑥分子晶体熔化时破坏分子间作用力,而分子间作用力一般较弱,导致其熔沸点较低,故⑥正确;⑦分子的稳定性与分子间作用力无关,稳定性属于化学性质,分子间作用力影响物理性质,故⑦错误。只有④⑥正确,故答案为A项。答案:A12.AB型化合物形成的晶体结构多种多样。如图所示的几种结构所表示的物质最有可能是分子晶体的是 ( )![]()
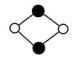
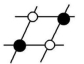 ① ② ③
① ② ③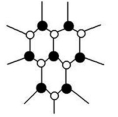
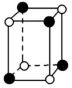
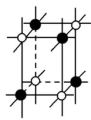 ④ ⑤ ⑥A.①③ B.②⑤C.⑤⑥ D.③④⑤⑥解析:从题图中可以看出②⑤都不能再以化学键与其他原子结合,所以最有可能是分子晶体。答案:B13.(2022·广东东莞)据某科学杂志报道,国外有一研究发现了一种新的球形分子,它的化学式为C60Si60,其分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60,也有Si60结构。下列叙述正确的是 ( )A.该物质有很高的熔点,很大的硬度B.该物质熔融时能导电C.该物质分子中Si60被包裹在C60里面D.该物质形成的晶体属于分子晶体解析:由分子式及题中信息可知,该物质为分子晶体。分子晶体的熔点低,硬度小,A项错误;由题中信息可知,该物质是一种新的球形分子,该物质熔融时克服了分子间作用力,只得到分子,不能导电,B项错误;硅的原子半径比碳的大,所以化合物C60Si60的外层球壳为Si60,内层球壳为C60,C项错误;由题中信息可知,该物质是一种新的球形分子,分子式为C60Si60,所以该物质有分子存在,属于分子晶体,D项正确。答案:D 14.(2022·广东东莞)甲烷晶体的晶胞结构如图所示,下列说法正确的是 ( )
④ ⑤ ⑥A.①③ B.②⑤C.⑤⑥ D.③④⑤⑥解析:从题图中可以看出②⑤都不能再以化学键与其他原子结合,所以最有可能是分子晶体。答案:B13.(2022·广东东莞)据某科学杂志报道,国外有一研究发现了一种新的球形分子,它的化学式为C60Si60,其分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60,也有Si60结构。下列叙述正确的是 ( )A.该物质有很高的熔点,很大的硬度B.该物质熔融时能导电C.该物质分子中Si60被包裹在C60里面D.该物质形成的晶体属于分子晶体解析:由分子式及题中信息可知,该物质为分子晶体。分子晶体的熔点低,硬度小,A项错误;由题中信息可知,该物质是一种新的球形分子,该物质熔融时克服了分子间作用力,只得到分子,不能导电,B项错误;硅的原子半径比碳的大,所以化合物C60Si60的外层球壳为Si60,内层球壳为C60,C项错误;由题中信息可知,该物质是一种新的球形分子,分子式为C60Si60,所以该物质有分子存在,属于分子晶体,D项正确。答案:D 14.(2022·广东东莞)甲烷晶体的晶胞结构如图所示,下列说法正确的是 ( )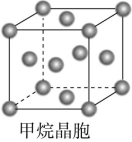 A.甲烷晶胞中的球只代表1个C原子B.晶体中1个CH4分子周围有12个紧邻的CH4分子C.甲烷晶体熔化时需克服共价键D.1个CH4晶胞中含有6个CH4分子解析:题图所示的甲烷晶胞中的球代表的是1个甲烷分子,并不是1个C原子,A项错误;由甲烷的晶胞结构图分析可知,与位于晶胞顶点的甲烷分子距离最近且相等的甲烷分子有3个,而这3个甲烷分子在晶胞的面心上,因此被2个晶胞所共用,顶点上的甲烷分子为8个晶胞共用,故晶体中与1个甲烷分子紧邻的甲烷分子数目为3×8×
A.甲烷晶胞中的球只代表1个C原子B.晶体中1个CH4分子周围有12个紧邻的CH4分子C.甲烷晶体熔化时需克服共价键D.1个CH4晶胞中含有6个CH4分子解析:题图所示的甲烷晶胞中的球代表的是1个甲烷分子,并不是1个C原子,A项错误;由甲烷的晶胞结构图分析可知,与位于晶胞顶点的甲烷分子距离最近且相等的甲烷分子有3个,而这3个甲烷分子在晶胞的面心上,因此被2个晶胞所共用,顶点上的甲烷分子为8个晶胞共用,故晶体中与1个甲烷分子紧邻的甲烷分子数目为3×8×![]() =12,B项正确;甲烷晶体是分子晶体,熔化时需克服范德华力,C项错误;甲烷晶胞属于面心立方晶胞,该晶胞中甲烷分子的数目为8×
=12,B项正确;甲烷晶体是分子晶体,熔化时需克服范德华力,C项错误;甲烷晶胞属于面心立方晶胞,该晶胞中甲烷分子的数目为8×![]() +6×
+6×![]() =4,D项错误。答案:B【挑战创新】15.科研人员曾应用计算机模拟出结构类似C60的物质N60。已知:①N60分子中每个氮原子均以N—N结合三个N原子而形成8电子稳定结构;②N—N的键能为167 kJ·mol-1。请回答下列问题。(1)N60分子构成的晶体为 晶体,其熔点、沸点比N2晶体的熔点、沸点 (填“高”或“低”),原因是 。 (2)1 mol N60分解成N2时吸收或放出的热量是 kJ(已知N≡N的键能为942 kJ·mol-1),表明稳定性:N60 (填“>”“<”或“=”)N2。 (3)由(2)列举N60的用途(举一种): 。 解析:(1)N60、N2形成的晶体均为分子晶体,因Mr(N60)>Mr(N2),故N60晶体中分子间的范德华力比N2晶体中分子间的范德华力大,N60晶体的熔点、沸点比N2晶体的熔点、沸点高。(2)因每个氮原子形成三个N—N,每个N—N被2个N原子共用,故1 mol N60中存在N—N:1 mol×60×3×
=4,D项错误。答案:B【挑战创新】15.科研人员曾应用计算机模拟出结构类似C60的物质N60。已知:①N60分子中每个氮原子均以N—N结合三个N原子而形成8电子稳定结构;②N—N的键能为167 kJ·mol-1。请回答下列问题。(1)N60分子构成的晶体为 晶体,其熔点、沸点比N2晶体的熔点、沸点 (填“高”或“低”),原因是 。 (2)1 mol N60分解成N2时吸收或放出的热量是 kJ(已知N≡N的键能为942 kJ·mol-1),表明稳定性:N60 (填“>”“<”或“=”)N2。 (3)由(2)列举N60的用途(举一种): 。 解析:(1)N60、N2形成的晶体均为分子晶体,因Mr(N60)>Mr(N2),故N60晶体中分子间的范德华力比N2晶体中分子间的范德华力大,N60晶体的熔点、沸点比N2晶体的熔点、沸点高。(2)因每个氮原子形成三个N—N,每个N—N被2个N原子共用,故1 mol N60中存在N—N:1 mol×60×3×![]() =90 mol。N60分解为N2的反应为N60
=90 mol。N60分解为N2的反应为N60![]() 30N2,故ΔH=90×167 kJ·mo
30N2,故ΔH=90×167 kJ·mo![]() -30×942 kJ·mo
-30×942 kJ·mo![]() =-13 230 kJ·mo
=-13 230 kJ·mo![]() <0,为放热反应,表明稳定性:N2>N60。(3)由于反应放出大量的热同时生成大量气体,因此N60可用作高能炸药。答案:(1)分子 高 N60、N2均为分子晶体,且N60的相对分子质量大,分子间作用力大,故熔点、沸点高(2)13 230 <(3)作高能炸药(或其他合理答案)16.Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为 1、3、6、6,且都含有18个电子,B、C由两种元素的原子构成,且分子中两种原子的个数比均为1∶2。D是一种有毒的有机化合物。(1)构成A分子的原子的元素符号是 。 (2)从B分子的空间结构判断,该分子属于 (填“极性”或“非极性”)分子。 (3)C分子中包含 个σ键、 个π键。 (4)D的熔点、沸点比C2H6的熔点、沸点高,其主要原因是(需指明D是什么物质): 。 Ⅱ.CO的结构可表示为
<0,为放热反应,表明稳定性:N2>N60。(3)由于反应放出大量的热同时生成大量气体,因此N60可用作高能炸药。答案:(1)分子 高 N60、N2均为分子晶体,且N60的相对分子质量大,分子间作用力大,故熔点、沸点高(2)13 230 <(3)作高能炸药(或其他合理答案)16.Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为 1、3、6、6,且都含有18个电子,B、C由两种元素的原子构成,且分子中两种原子的个数比均为1∶2。D是一种有毒的有机化合物。(1)构成A分子的原子的元素符号是 。 (2)从B分子的空间结构判断,该分子属于 (填“极性”或“非极性”)分子。 (3)C分子中包含 个σ键、 个π键。 (4)D的熔点、沸点比C2H6的熔点、沸点高,其主要原因是(需指明D是什么物质): 。 Ⅱ.CO的结构可表示为![]() ,N2的结构可表示为
,N2的结构可表示为![]() 。(5)下表是在一定条件下测得的CO和N2的键能数据(单位:kJ·mol-1):物质A—BA
。(5)下表是在一定条件下测得的CO和N2的键能数据(单位:kJ·mol-1):物质A—BA![]() B
B![]() CO357.7798.91 071.9N2154.8418.4941.7结合数据说明CO比N2活泼的原因: 。 Ⅲ.(6)Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型)。解析:(1)含有18个电子的单原子分子是氩。(2)B是由两种元素的3个原子构成的含有18个电子的分子,则B是H2S,是极性分子。(3)C是由两种元素的6个原子构成的含有18个电子的分子,原子个数比为1∶2,则C是N2H4,N原子采取sp3杂化,分子内有5个σ键,无π键。(4)D分子含有6个原子,并含有18个电子,且为有毒的有机化合物,应是甲醇。CH3OH分子之间能形成氢键,因此CH3OH的熔点、沸点比C2H6的熔点、沸点高。(5)CO分子中的一个π键的键能为1 071.9 kJ·mol-1-798.9 kJ·mol-1=273 kJ·mol-1,N2分子内的一个π键的键能为941.7 kJ·mol-1-418.4 kJ·mol-1=523.3 kJ·mol-1,键能越大越稳定,CO分子中的π键比N2中的π键更容易断裂,所以CO比N2活泼。(6)Fe(CO)5熔点、沸点低,易溶于非极性溶剂,是分子晶体。答案:Ⅰ.(1)Ar (2)极性 (3)5 0 (4)D是CH3OH,分子之间能形成氢键Ⅱ.(5)CO中断裂1 mol π键需吸收能量273 kJ,N2中断裂1 mol π键需吸收能量523.3 kJ,所以CO分子中的π键比N2分子中的π键更容易发生反应Ⅲ.(6)分子晶体
CO357.7798.91 071.9N2154.8418.4941.7结合数据说明CO比N2活泼的原因: 。 Ⅲ.(6)Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型)。解析:(1)含有18个电子的单原子分子是氩。(2)B是由两种元素的3个原子构成的含有18个电子的分子,则B是H2S,是极性分子。(3)C是由两种元素的6个原子构成的含有18个电子的分子,原子个数比为1∶2,则C是N2H4,N原子采取sp3杂化,分子内有5个σ键,无π键。(4)D分子含有6个原子,并含有18个电子,且为有毒的有机化合物,应是甲醇。CH3OH分子之间能形成氢键,因此CH3OH的熔点、沸点比C2H6的熔点、沸点高。(5)CO分子中的一个π键的键能为1 071.9 kJ·mol-1-798.9 kJ·mol-1=273 kJ·mol-1,N2分子内的一个π键的键能为941.7 kJ·mol-1-418.4 kJ·mol-1=523.3 kJ·mol-1,键能越大越稳定,CO分子中的π键比N2中的π键更容易断裂,所以CO比N2活泼。(6)Fe(CO)5熔点、沸点低,易溶于非极性溶剂,是分子晶体。答案:Ⅰ.(1)Ar (2)极性 (3)5 0 (4)D是CH3OH,分子之间能形成氢键Ⅱ.(5)CO中断裂1 mol π键需吸收能量273 kJ,N2中断裂1 mol π键需吸收能量523.3 kJ,所以CO分子中的π键比N2分子中的π键更容易发生反应Ⅲ.(6)分子晶体
相关试卷
这是一份高中第二节 分子晶体与共价晶体第二课时习题,共12页。
这是一份高中化学第二节 分子晶体与共价晶体第一课时达标测试,共11页。试卷主要包含了下列说法中,错误的是,下列性质适合于分子晶体的是,下列说法中,正确的是,下列有关分子晶体的叙述正确的是等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体第1课时习题,共7页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。











