



所属成套资源:新人教版化学必修第二册课件PPT整套(内含开学摸底考)
人教版 (2019)必修 第二册第二节 氮及其化合物优秀ppt课件
展开
这是一份人教版 (2019)必修 第二册第二节 氮及其化合物优秀ppt课件,共49页。PPT课件主要包含了氮元素的存在,第三部分氨铵盐,思考与练习,抓小偷,第四部分硝酸,第五部分酸雨及防治,自学阅读课本P16等内容,欢迎下载使用。
第一部分 氮气与氮的固定
有句农谚“雷雨发庄稼”。你知道其中的道理吗?
①氮原子的结构原子结构示意图: ________,一般通过___________与其他原子结合。
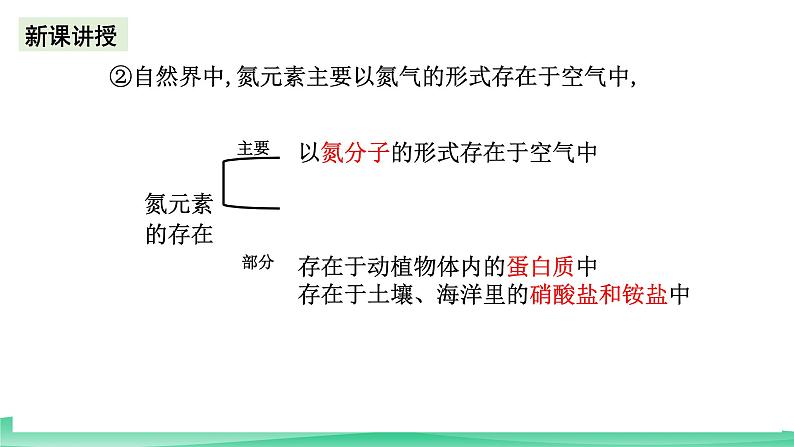
②自然界中,氮元素主要以氮气的形式存在于空气中,
以氮分子的形式存在于空气中
存在于动植物体内的蛋白质中存在于土壤、海洋里的硝酸盐和铵盐中
收集氮气时用排水法不用排空气法
保护气、填充灯泡、焊接金属、低温制冷等
(2)高温、放电等条件下:
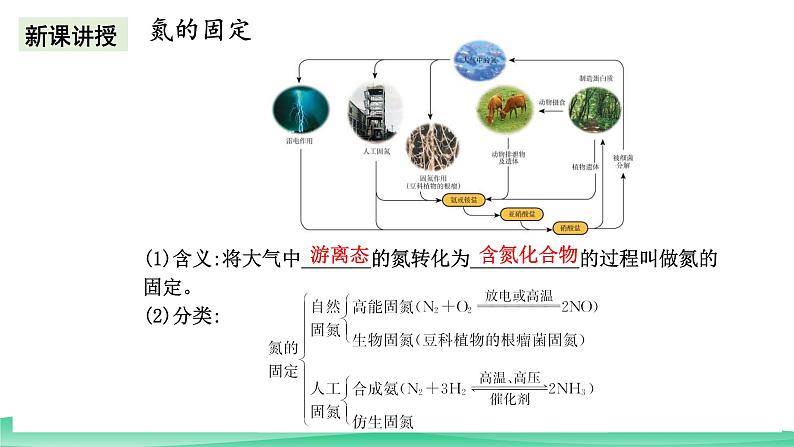
(1)含义:将大气中_______的氮转化为___________的过程叫做氮的固定。(2)分类:
第二部分 一氧化氮和二氧化氮
二、一氧化氮和二氧化氮
(一)一氧化氮(NO)
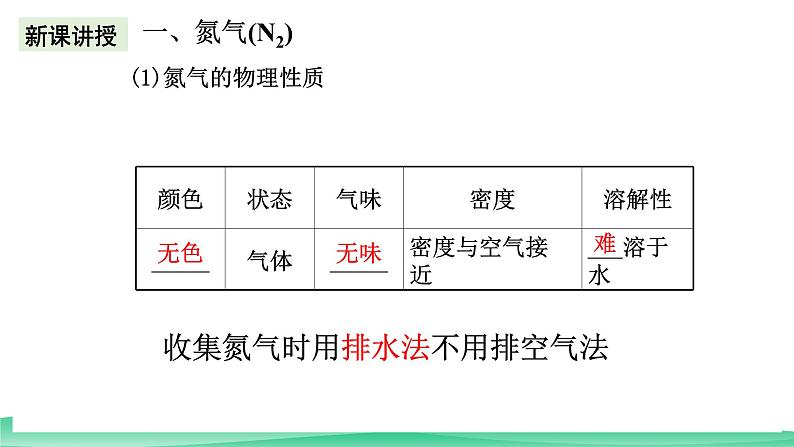
无色、无味、不溶于水的有毒气体,密度比空气略小
常温下:2NO + O2 == 2NO2(红棕色)
二氧化氮溶于水时生成硝酸和一氧化氮。工业上利用这一原理制取硝酸。
如图所示,在一支50 mL的注射器里充入20 mLNO,然后吸入5 mL水,用乳胶管和弹簧夹封住管口,振荡注射器,观察现象。打开弹簧夹,快速吸入10 mL空气后夹上弹簧夹,观察现象。振荡注射器,再观察现象。
(2)结论:在一定条件下,NO与NO2可以相互转化,反应的化学方程式为①NO→NO2: ______________;②NO2→NO: ____________________(工业制取硝酸)。
2NO+O2====2NO2
3NO2+H2O====2HNO3+NO
【思考】(1)NO和NO2分别采用什么方法收集?说明原因。
提示:常温下NO能与O2反应,只能用排水法收集;NO2能与水反应生成NO,故只能用排空气法收集。
(2)NO2转化为NO的变化中,NO2只能作氧化剂吗?
提示:NO2与水反应转化为NO的同时生成HNO3,NO2既作氧化剂又作还原剂。
1.通常情况下,下列各组气体不能共存的是( )A.N2和O2 B.H2和Cl2 C.H2和O2 D.NO和O2
2.下列气体溶于水,没有发生氧化还原反应的是( )A.SO2 B.CO2 C.NO2 D.Cl2
N2 + O2 ====== 2NO
2NO + O2 = 2NO2
3NO2 + H2O = 2HNO3 + NO
学习自主化·目标明确化
1.了解氨的物理性质及用途,理解喷泉实验 的原理2.掌握氨气的化学性质及氨气的实验室制法3.了解铵盐的性质及NH4+的检验
杭州市一制冷车间发生氨气泄漏
2004年4月20日上午10时,杭州市一制冷车间发生氨气泄漏事件,整个厂区是白茫茫的一片,方圆数百米,空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难。厂区内寒气逼人。
市消防中心接到报案后立即制定方案,出动上百名消防队员,十余量消防车……
1、为什么在氨气泄漏时工厂里会寒气逼人?
2、如何处理弥漫在空气中的大量氨气?
3、被困在其中的人应该怎样做才能少吸入氨气保证安全?
由这段新闻,我们可以推测氨气有什么物理性质呢?
色、有 气味的气体,密度比空气 ,易液化放热,汽化时吸收大量的热,氨常用作 , 溶于水,在常温下,1体积水大约可溶解 体积氨气。
知识系统化·系统条理化
1.该装置能用氨气形成喷泉的原理是什么?
实验【5-6】氨气的喷泉实验
认真观看视频结合课本P13实验步骤,记录实验现象,思考并完成如下问题:
2.用氨气做喷泉实验成功的条件有哪些?
3.该喷泉实验说明氨气的什么性质?
4.你能设计出一个蓝色的喷泉实验吗?
结论: 氨气极易溶于水,氨水呈碱性。
某同学用氨气做喷泉实验,结果实验失败,请你分析实验失败的可能原因?
收集的氨气不纯或较少收集氨气时烧瓶潮湿烧瓶装置气密性不好
如图所示:烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是( )A、a为HCl气体,b为H2OB、 a为CO2气体,b为浓NaOH溶液C、a为Cl2气体,b为饱和NaCl溶液D、a为Cl2气体,b为浓NaOH溶液
★(3)氨的催化氧化——工业制硝酸的基本反应
(1)氨跟水反应——显弱碱性
(2)氨跟酸反应——生成铵盐(铵态氮肥)
所以氨水显________,既能使无色的酚酞溶液变成______,又能使湿润的红色的石蕊试纸______。
②NH3与水反应后有碱性物质生成。
大部分NH3与水结合成 NH3·H2O, NH3·H2O可以小部分电离成NH4+和OH-。
NH3·H2O = NH3 ↑+ H2O
①NH3极易溶于水。(1 :700),
分子:NH3、 H2O 、 NH3·H2O(主要)
离子:NH4+、OH- 、 (H+)
注:氨水主要成分的化学式为NH3·H2O,在计算氨水的 物质的量浓度或质量分数时,把溶质当作NH3来算。
液氨 是氨气加压或降温后形成的液态物质,液氨所含的微粒是NH3。
1. 为什么在氨气泄漏现场会寒气逼人?
2. 消防队员应该如何除去白茫茫的氨气?
3. 附近居民怎样做才能避免受伤?
液氨气化吸收热量
喷水,使氨气转化为氨水
防化兵在水幕的保护下,一点一点接近氨气罐
用湿毛巾捂住鼻孔呼吸,尽快逃离现场
写出上述反应的离子方程式
(氨的催化氧化,工业制硝酸的基础)
-3 0 +2 -2
化合价升高,失5e-×4,氧化反应
化合价降低,得2e-×10,还原反应
氨催化氧化(接触氧化)是工业制硝酸的基础,请写出用氨制取硝酸的化学方程式。
2NO + O2 = 2NO2
3NO2 + H2O = 2HNO3 + NO
有一位农民看到自己买的一袋碳酸氢铵化肥受了潮,就在太阳底下晒,等他下午去取时,发现少了许多,是谁偷了他的氮肥?
学习情境化·情境趣味化
不是所有的铵盐受热都会放出氨气,如硝酸铵受热分解为硝酸、氮气和水
“三解”:溶解、热解和碱解
加热到300℃左右时: 5NH4NO3=2HNO3+4N2↑+9H2O
NH4NO3 + NaOH = NaNO3 +H2O +NH3 ↑
(NH4)2SO4+2NaOH = Na2SO4+2H2O+2NH3 ↑
运用:*在实验室中,常利用铵盐和强碱反应产生氨这一性质来检验铵根离子的存在和制取氨
反应实质:NH4++ OH-=NH3↑+H2O
实验室用加热NH4Cl和Ca(OH)2固体混合物的方法制取氨气,装置如图所示:
1.NH4Cl受热分解也能产生NH3,实验室能否用直接加热NH4Cl的方法制取氨气?
2.收集装置中棉花的作用?
3.氨气是一种碱性气体,可用那些试剂干燥氨气?
5.氨气是一种污染性气体,实验室制取或使用时要有尾气处理装置,你认为应如何吸收氨气?
4.收集:向下排空气法 (棉花:防止空气对流,提高集气的速度和纯度)
5.检验:①用湿润的红色石蕊试纸(变蓝) ②蘸有浓盐酸的玻璃棒靠近瓶口(白烟)
3.干燥:生石灰、碱石灰等碱性干燥剂
1min速记 氨的实验室制法
6.尾气处理:稀硫酸溶液、用水吸收
7.实验室制取氨气常用方法
①加热NH4Cl和Ca(OH)2固体②加热浓氨水法③浓氨水加生石灰法
实验室中还可以用哪些方法快速制氨气:
思考:有什么现象?为什么有此现象?
1. 吸收水分,减少溶剂。2. 增加OH-的浓度。3. 放出热量,升高温度。
学习系统化·成果共享化
1.下列有关氨气的性质的叙述中正确的是( ) A.氨气不能在空气中燃烧,是因为O2不能将NH3氧化 B.氨气是非电解质,NH3·H2O是电解质 C.氨气和酸相遇都能产生酸雾 D.氨气呈碱性,能使石蕊试纸变蓝
2. 下列不属于铵盐的通性的是( ) A.易溶于水 B.含有NH4+ C.易分解放出氨气 D.能和碱反应生成氨气
3. 下列有关氨及其铵盐的叙述中不正确的是( ) A.铵态氮肥不能和碱性物质混合使用 B.氨气极易溶于水,因此氨水为强碱溶液 C.可用NaOH溶液和红色石蕊试纸检验溶液中的NH4+ D.氨气具有还原性,一定条件下可与有氧化性的O2反应
①浓HNO3是 色、易 ,有 气味的液体.
②能与水任意比互溶。
③纯HNO3的沸点低,密度大于水,
常用浓硝酸质量分数为68%~69%。
质量分数为98%以上的硝酸为“发烟硝酸”。
这实际上是挥发出来HNO3分子遇空气中水分子结合成的小液滴,实 际上还是雾.
思考: 到底是烟还是雾?
为什么工业硝酸是黄色的呢?
一般而言,硝酸越浓,越不稳定。
密封于棕色瓶中,并放在阴暗处!
为什么有的浓硝酸会显淡黄色?
① 与金属反应(除Au和 Pt外)
注意:Fe 和Al遇到冷的浓硝酸被钝化,被氧化成一层致密的氧化膜,与浓硫酸一样。
氧化性:浓硝酸>稀硝酸
Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+2H2O
3Cu + 8HNO3(稀) = 3 Cu(NO3)2 + 2NO↑+4H2O
硝酸的浓度不同,与金属反应的产物也不同
C +4HNO3 (浓)=2H2O +4NO2 ↑+CO2↑
结论:硝酸跟非金属反应,生成NO2、 H2O和相应的含氧酸
③硝酸还能氧化FeO、 Fe(NO3)2(Fe2+)、 HBr(Br-)、 HI(I-) 、H2S (S2-)、 SO2等具有还原性的化合物发生氧化还原反应,因此,不能用硝酸与有关的盐反应制取HI、 SO2、 H2S、 HBr等气体
小结:硝酸与金属反应时,主要是HNO3中+5价的氮得到电子,被还原成较低价氮的物质,稀硝酸的还原产物一般是NO,浓硝酸的还原产物一般是NO2,而不像盐酸与金属反应那样生成H2。
相关课件
这是一份5.2氮及其化合物——2022-2023学年高中化学学业水平复习课件(人教版2019必修二),共33页。PPT课件主要包含了原子结构,既不容易得到3个电子,也不容易失去5个电子,动植物体内的蛋白质中,氮气与氮的固定,自然固氮,人工固氮,高能固氮,生物固氮,豆科植物的根瘤菌固氮等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第二册第二节 氮及其化合物图文课件ppt,共31页。PPT课件主要包含了核心素养,氨的分子结构,有刺激性气味,化学性质,想想看,氨气溶于水溶液显碱性,⑴氨与水的反应,氨水的成份,特别注意,氨水的密度等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第二册第二节 氮及其化合物课文配套课件ppt,共29页。PPT课件主要包含了硝酸的制备,①与金属反应,铁粉少量,铁粉过量,②与非金属反应,NO3-的检验,硝酸的用途,“空中死神”酸雨,酸雨及防治,酸雨的形成原因等内容,欢迎下载使用。











