




高中化学人教版 (2019)必修 第二册实验活动7 化学反应速率的影响因素获奖课件ppt
展开【动手做实验】【实验目的】1.体验浓度、温度和催化剂对化学反应速率的影响。2.理解改变反应条件可以调控化学反应的速率。
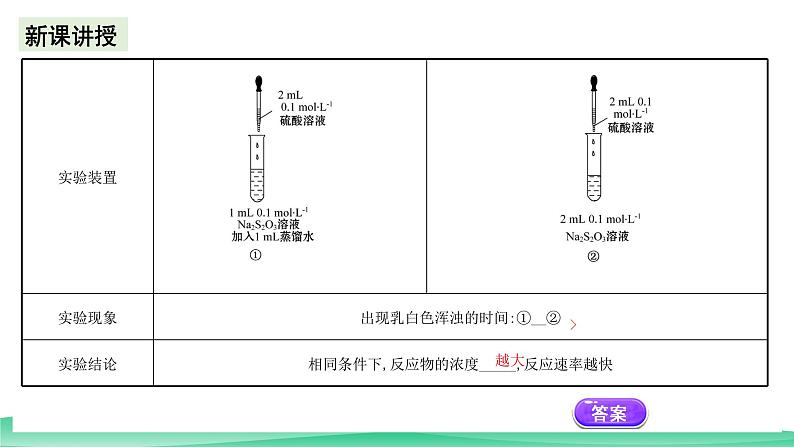
【实验原理】1.硫代硫酸钠与硫酸的反应硫代硫酸钠与硫酸反应会生成不溶于水的硫:Na2S2O3+H2SO4====Na2SO4+SO2↑+S↓+H2O,反应生成的硫使溶液出现乳白色浑浊,比较浑浊现象出现所需时间的长短,可以判断该反应进行的快慢。在不同浓度和温度条件下分别进行上述反应,并比较其反应快慢,可以看出反应物浓度和温度对该反应速率的影响。2.过氧化氢分解会产生氧气,在有或无催化剂存在下进行对比实验,通过观察氧气产生的快慢可以看出催化剂对该反应速率的影响。
【实验器材及试剂】仪器:烧杯、试管、量筒、试管架、胶头滴管、温度计、药匙、秒表。试剂:0.1 ml·L-1 Na2S2O3溶液、0.1 ml·L-1 H2SO4溶液、10%H2O2溶液、1 ml·L-1 FeCl3溶液、MnO2粉末、蒸馏水。
【实验过程和结论】1.实验过程(1)实验探究浓度对化学反应速率的影响
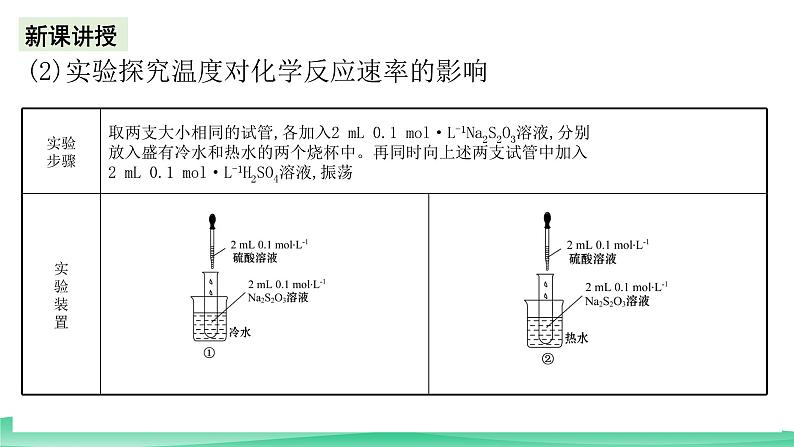
(2)实验探究温度对化学反应速率的影响
(3)实验探究催化剂对化学反应速率的影响
2.对比实验注意事项(1)由于采用了对比实验,操作时应注意反应物的用量尽可能相同,试管规格也要相同。(2)尽量保证两支试管中的试剂同时发生反应,这样比较溶液出现浑浊的先后才科学合理。(3)要有规律地设计不同的反应体系的温度,也要注意物质的相应性质,不能选择会引起反应发生变化的体系温度。
【思考讨论】在通常情况下,铁与冷水或热水都不反应,但红热的铁与水蒸气则可发生反应,生成Fe3O4和H2,试从反应条件的角度思考并解释这一事实。提示:3Fe+4H2O(g) Fe3O4+4H2,升高到一定温度可以加快该反应的速率,观察到较为明显的实验现象。
【素养再提升】 【典例示范】角度1 影响化学反应速率的因素【典例1】把下列四种X溶液分别加入四个盛有10 mL 2 ml·L-1盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )A.10 ℃ 20 mL 3 ml·L-1的X溶液B.20 ℃ 30 mL 2 ml·L-1的X溶液C.20 ℃ 10 mL 4 ml·L-1的X溶液D.10 ℃ 10 mL 2 ml·L-1的X溶液
【解析】选B。在化学反应中,当其他条件不变时,浓度越大,反应速率越快;温度越高,反应速率越快。本题中要综合考虑浓度和温度的影响。先比较浓度的大小,这里的浓度应该是混合以后的浓度,由于混合后各烧杯中盐酸的浓度相等,因此只要比较X的浓度即可,X浓度越大,反应速率越快。因为反应后溶液的体积均为50 mL,所以X的物质的量越大,浓度就越大。通过观察可知,混合后A、B选项中X的浓度相等,且比C、D两项的大,但B中温度更高,因此B的反应速率最大。
角度2 “控制变量法”在解题中的应用【典例2】某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:(1)硫酸铜溶液可以加快氢气生成速率的原因是_______________________。 (2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。
请完成此实验设计,其中:V1=________,V6=________,V9=________。
【解析】(1)由于Zn与CuSO4溶液反应生成的Cu及稀硫酸形成了Cu-Zn原电池,大大加快了生成氢气的反应速率。(2)因为要研究硫酸铜的量对反应速率的影响,故应保持硫酸的浓度在各组实验中相同,则硫酸溶液的体积均取30 mL,根据F中增加的水与硫酸铜溶液的体积之和为20 mL,可以求得各组实验中加入水的体积分别为V7=20 mL,V8=19.5 mL,V9=17.5 mL,V10=15 mL,实验E中加入的硫酸铜溶液的体积V6=10 mL。答案:(1)CuSO4溶液与Zn反应生成的Cu与Zn形成Cu-Zn原电池,加快了氢气生成的速率 (2)30 10 17.5
【素养提升】1.臭氧可用于净化空气、漂白饮用水、杀菌、处理工业废物和作为漂白剂。O3在水中易分解,在一定条件下,O3的浓度减少一半时所需的时间(t)如下表所示。已知:O3的起始浓度为0.021 6 ml·L-1。
(1)在30 ℃、pH=4.0条件下,O3的分解速率为____________ml·L-1·min-1。 (2)pH增大能加速O3分解,表明对O3分解起催化作用的是________________。 (3)根据表中数据,推测O3在下列条件下分解速率依次增大的顺序为________(填字母)。 a.40 ℃、pH=3.0 b.10 ℃、pH=4.0 c.30 ℃、pH=7.0
【解析】(1)v= =1.00×10-4ml·L-1·min-1;(2)pH增大,则OH-浓度增大,pH增大能加速O3分解,表示对O3分解起催化作用的是OH-;(3)由表中数据可知,40 ℃、pH=3.0时,所需时间在31~158 min之间;10 ℃、pH=4.0时,所需时间>231 min;30 ℃、pH=7.0时,所需时间<15 min,则分解速率依次增大的顺序为b、a、c。答案:(1)1.00×10-4 (2)OH- (3)bac
2.H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30%H2O2溶液、0.1 ml·L-1Fe2(SO4)3溶液、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。
(1)设计实验方案:在不同H2O2浓度下,测定____________________(要求所测得的数据能直接体现反应速率大小)。 (2)设计实验装置,完成如图所示的装置示意图。(3)参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
【解析】(1)该实验是探究H2O2浓度对H2O2分解反应速率的影响,所以应测定不同浓度双氧水分解时产生氧气的速率,即可以测定相同时间内生成氧气的体积。(2)根据题目给出的限选仪器可以选用导管、水槽、量筒组成气体收集装置。(3)探究时一定要注意变量的控制,即只改变一个变量,才能说明该变量对反应的影响。表格中给出了硫酸铁的量,且体积均相等。而探究的是不同浓度的双氧水分解的速率,所以必须要有不同浓度的双氧水,但题给试剂中只有30%的双氧水,因此还需要蒸馏水,要保证硫酸铁的浓度相同,必须保证两组实验中双氧水和蒸馏水的总体积相同,且两组实验中双氧水和蒸馏水的体积不同两个条件。同时还要记录两组实验中收集相同体积氧气所需时间或相同时间内收集氧气的体积大小。
答案:(1)生成相同体积的氧气所需要的时间(或相同时间内,生成氧气的体积)(2)
人教版 (2019)必修 第二册实验活动7 化学反应速率的影响因素教课内容ppt课件: 这是一份人教版 (2019)必修 第二册实验活动7 化学反应速率的影响因素教课内容ppt课件,共24页。PPT课件主要包含了导入一,实验原理,实验现象与结论,无催化剂时反应较慢,气泡冒出速率增大,有气泡冒出较慢,问题和讨论,课堂练习等内容,欢迎下载使用。
化学人教版 (2019)第六章 化学反应与能量实验活动7 化学反应速率的影响因素教学ppt课件: 这是一份化学人教版 (2019)第六章 化学反应与能量实验活动7 化学反应速率的影响因素教学ppt课件,共9页。PPT课件主要包含了2温度,3催化剂等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册实验活动7 化学反应速率的影响因素优秀课件ppt: 这是一份高中化学人教版 (2019)必修 第二册实验活动7 化学反应速率的影响因素优秀课件ppt,共26页。PPT课件主要包含了反应较慢,课堂小结等内容,欢迎下载使用。













