






所属成套资源:人教版化学选择性必修2课件PPT+教案
高中化学人教版 (2019)选择性必修2第二节 分子的空间结构优质课件ppt
展开
这是一份高中化学人教版 (2019)选择性必修2第二节 分子的空间结构优质课件ppt,文件包含人教版化学选修二222《分子的空间结构》第二课时课件pptx、222分子的空间结构第二课时教案doc等2份课件配套教学资源,其中PPT共23页, 欢迎下载使用。
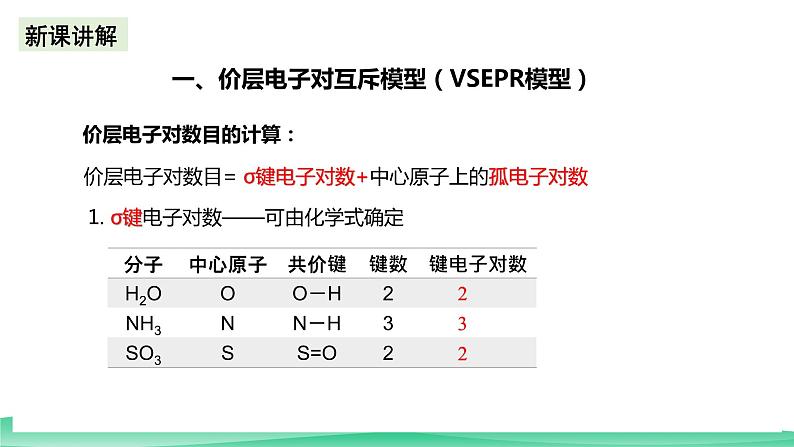
《分子的空间结构》第二课时 教学设计课题《分子的空间结构》单元2学科化学年级高二教材分析本章内容比较系统地介绍了分子的结构与性质,内容比较丰富。首先,在第一章有关电子云和原子轨道等概念的基础上,介绍了共价键的主要类型δ键和π键,以及键参数——键能、键长、键角;接着,在共价键概念的基础上,介绍了分子的立体结构,并根据价层电子对互斥理论和杂化轨道理论对简单共价分子结构的多样性和复杂性进行了解释;最后,介绍了极性分子和非极性分子、分子间作用力、氢键等概念,以及它们对物质性质的影响,并从分子结构的角度说明了“相似相溶“规则、无机含氧酸分子的酸性等。本节教学内容是人教版高中化学选择性必修第二册第二章《分子结构与性质》第二节《分子的空间结构》第二课时。这一课时的教学内容主要是价层电子对互斥理论。 本节安排了“价层电子对互斥理论”这部分内容。学生通过学习这部分知识,认识微观结构对分子立体构型的影响,了解共价分子结构的多样性和复杂性。通过对价层电子对互斥模型的探究,建立解决复杂分子结构判断的思维模型。学生能够在分子水平上,从分子结构的视角认识物质的性质,进一步形成有关物质结构的基本观念;学生的学习兴趣能得到有效保持,学生的科学素养能得到进一步提高。教学目标与核心素养宏观辨识与微观探析:通过对典型分子空间结构的学习,认识微观结构对分子空间结构的影响,了解共价分子结构的多样性和复杂性。证据推理与模型认知:通过对价层电子对互斥模型的探究,建立解决复杂分子结构判断的思维模型。重点难点价层电子对互斥理论 教学过程教学环节教师活动学生活动设计意图导入新课【思考】1.CO2和H2O都是三原子分子,为什么CO2 呈直线形而H2O呈V形? 2. CH2O和NH3都是四原子分子,为什么CH2O呈平面三角形而NH3呈三角锥形? 思考问题通过问题,引发学生思考,提高学生学习积极性。讲授新课第二节 分子的空间结构 第二课时 价层电子对互斥理论一、价层电子对互斥理论价层电子对互斥模型认为,分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。VSEPR的“价层电子对”:是指分子中的中心原子与结合原子间的σ键电子对和中心原子上的孤电子对。多重键只计其中的σ键电子对,不计π电子对。价层电子对数目的计算:价层电子对数目= σ键电子对数+中心原子上的孤电子对数1. σ键电子对数——可由化学式确定 2.中心原子上的孤电子对数 中心原子孤电子对数=
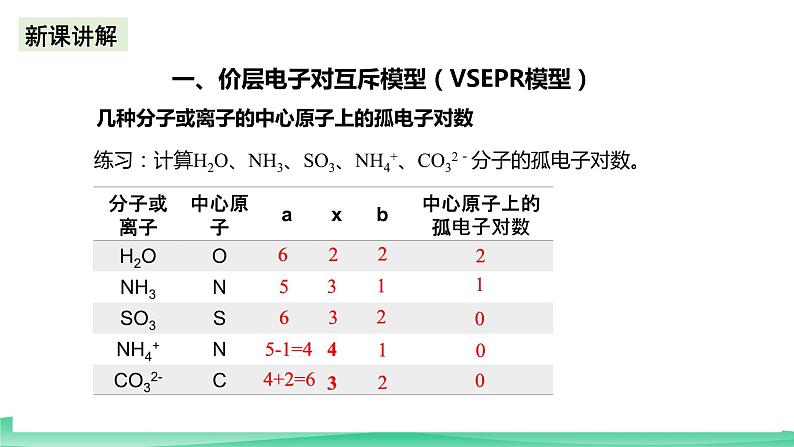
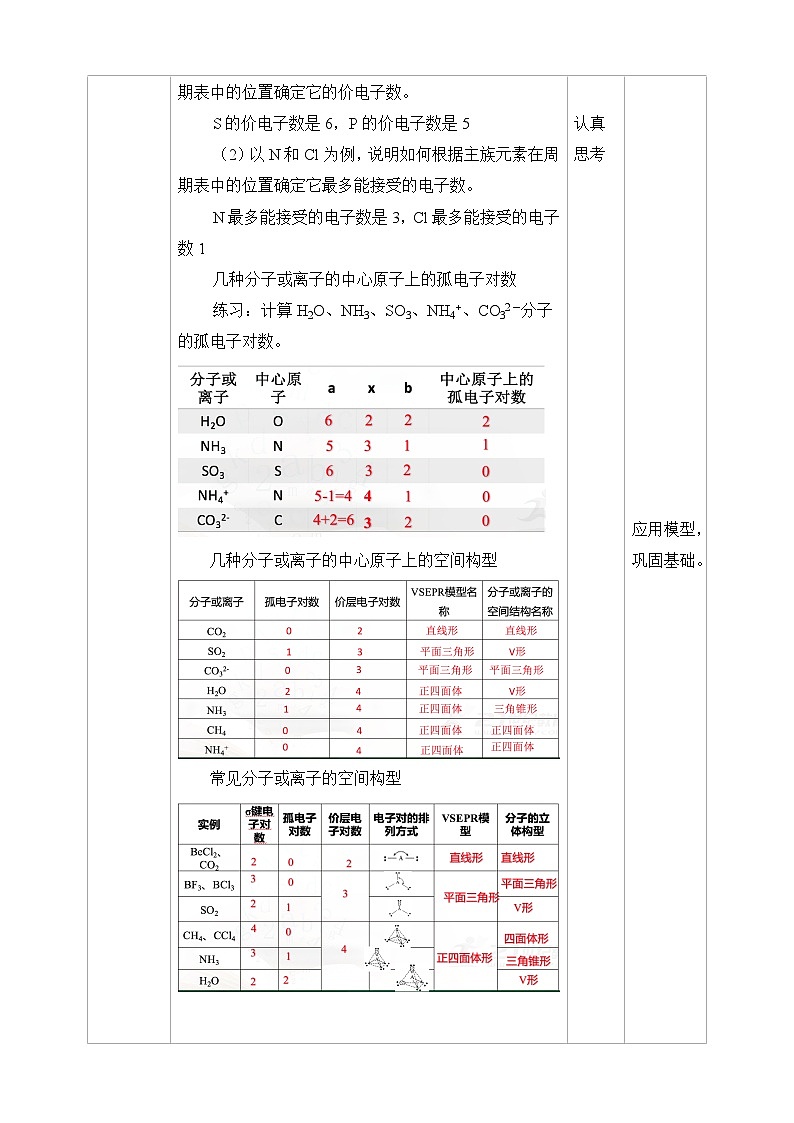
2.中心原子上的孤电子对数 中心原子孤电子对数=![]() a——表示中心原子的价电子数对主族元素:a= 最外层电子数;对于阳离子:a=价电子数-电荷数;对于阴离子:a=价电子数+电荷数。x为与中心原子结合的 原子数 。b为与中心原子结合的原子最多能接受的电子数,H为1,其他原子= 8﹣该原子的价电子数。【思考与讨论】(1)以S和P为例,说明如何根据主族元素在周期表中的位置确定它的价电子数。S的价电子数是6,P的价电子数是5(2)以N和Cl为例,说明如何根据主族元素在周期表中的位置确定它最多能接受的电子数。N最多能接受的电子数是3,Cl最多能接受的电子数1几种分子或离子的中心原子上的孤电子对数练习:计算H2O、NH3、SO3、NH4+、CO32-分子的孤电子对数。
a——表示中心原子的价电子数对主族元素:a= 最外层电子数;对于阳离子:a=价电子数-电荷数;对于阴离子:a=价电子数+电荷数。x为与中心原子结合的 原子数 。b为与中心原子结合的原子最多能接受的电子数,H为1,其他原子= 8﹣该原子的价电子数。【思考与讨论】(1)以S和P为例,说明如何根据主族元素在周期表中的位置确定它的价电子数。S的价电子数是6,P的价电子数是5(2)以N和Cl为例,说明如何根据主族元素在周期表中的位置确定它最多能接受的电子数。N最多能接受的电子数是3,Cl最多能接受的电子数1几种分子或离子的中心原子上的孤电子对数练习:计算H2O、NH3、SO3、NH4+、CO32-分子的孤电子对数。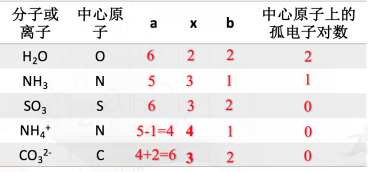 几种分子或离子的中心原子上的空间构型
几种分子或离子的中心原子上的空间构型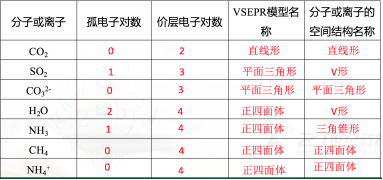 常见分子或离子的空间构型
常见分子或离子的空间构型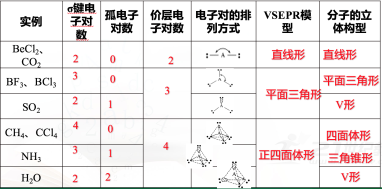
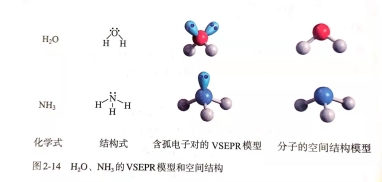 根据价层电子对互斥模型对几种分子或离子的空间结构的推测
根据价层电子对互斥模型对几种分子或离子的空间结构的推测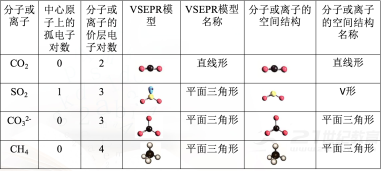 根据价层电子对互斥模型判断分子的空间构型对于ABn型分子,利用VSEPR模型预测分子空间结构的思路:
根据价层电子对互斥模型判断分子的空间构型对于ABn型分子,利用VSEPR模型预测分子空间结构的思路: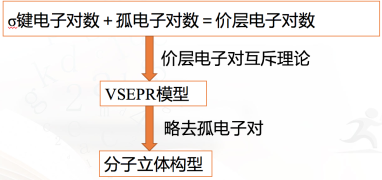 【思考与讨论】 1. H2O、NH3的键角分别是105°、107°,请解释原因。H2O、NH3的价层电子对均为4,H2O、NH3的的孤电子对分别为2、1,分子中电子对之间的斥力大小顺序:孤电子对-孤电子对>孤电子对-成键电子对 >成键电子-成键电子,故 H2O、NH3的键角分别是105°、107°。 价层电子对之间的斥力:①电子对之间的夹角越小,斥力越大。②分子中电子对之间的斥力大小顺序:孤电子对-孤电子对>孤电子对-成键电子对>成键电子-成键电子。③由于三键、双键比单键包含的电子多,所以斥力大小顺序:三键>双键>单键 。 2. 确定BF3、NH4+、 SO32- VSEPR模型和它们的空间结构,并与同学讨论。BF3的价层电子对均为3, NH4+的价层电子对为4,两者孤电子对数为0,因此, VSEPR模型和它们的空间结构相同, BF3为平面三角形, NH4+为正四面体。SO32-的价层电子对为4,孤电子对数为1, VSEPR模型为四面体形,空间结构为三角锥形。 【课堂练习】1.以下分子或离子的结构为正四面体形且键与键夹角为109°28′的是( )①CH4 ②GeCl4 ③CH3Cl ④P4 ⑤SO42-A.①②④ B.①②③④⑤C.①② D.①②⑤答案: D2.下列各组分子的立体构型名称相同的是( )A.SCl2、BeCl2 B.BF3、NF3C.CF4、SiCl4 D.CO2、SF2答案: C3.硫化羰(分子式为COS)是一种有臭鸡蛋气味的无色气体,可视为由一个硫原子取代了CO2分子中的一个氧原子后形成的,下列有关硫化羰的说法正确的是( )A.硫化羰的结构式为C===O===SB.分子中三个原子位于同一直线上C.中心原子价层电子对数为4D.分子是V形结构答案: B4.六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应。下列有关六氟化硫的推测正确的是( )A.六氟化硫易燃烧生成二氧化硫B.六氟化硫中各原子均达到8电子稳定结构C.六氟化硫分子中的S—F键都是σ键,且键长、键能都相等D.若将六氟化硫分子中的2个F原子换成Cl原子,可以得到3种可能结构
【思考与讨论】 1. H2O、NH3的键角分别是105°、107°,请解释原因。H2O、NH3的价层电子对均为4,H2O、NH3的的孤电子对分别为2、1,分子中电子对之间的斥力大小顺序:孤电子对-孤电子对>孤电子对-成键电子对 >成键电子-成键电子,故 H2O、NH3的键角分别是105°、107°。 价层电子对之间的斥力:①电子对之间的夹角越小,斥力越大。②分子中电子对之间的斥力大小顺序:孤电子对-孤电子对>孤电子对-成键电子对>成键电子-成键电子。③由于三键、双键比单键包含的电子多,所以斥力大小顺序:三键>双键>单键 。 2. 确定BF3、NH4+、 SO32- VSEPR模型和它们的空间结构,并与同学讨论。BF3的价层电子对均为3, NH4+的价层电子对为4,两者孤电子对数为0,因此, VSEPR模型和它们的空间结构相同, BF3为平面三角形, NH4+为正四面体。SO32-的价层电子对为4,孤电子对数为1, VSEPR模型为四面体形,空间结构为三角锥形。 【课堂练习】1.以下分子或离子的结构为正四面体形且键与键夹角为109°28′的是( )①CH4 ②GeCl4 ③CH3Cl ④P4 ⑤SO42-A.①②④ B.①②③④⑤C.①② D.①②⑤答案: D2.下列各组分子的立体构型名称相同的是( )A.SCl2、BeCl2 B.BF3、NF3C.CF4、SiCl4 D.CO2、SF2答案: C3.硫化羰(分子式为COS)是一种有臭鸡蛋气味的无色气体,可视为由一个硫原子取代了CO2分子中的一个氧原子后形成的,下列有关硫化羰的说法正确的是( )A.硫化羰的结构式为C===O===SB.分子中三个原子位于同一直线上C.中心原子价层电子对数为4D.分子是V形结构答案: B4.六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应。下列有关六氟化硫的推测正确的是( )A.六氟化硫易燃烧生成二氧化硫B.六氟化硫中各原子均达到8电子稳定结构C.六氟化硫分子中的S—F键都是σ键,且键长、键能都相等D.若将六氟化硫分子中的2个F原子换成Cl原子,可以得到3种可能结构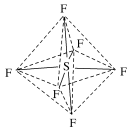 答案: C5.X、Y、Z、W、R是元素周期表前四周期元素中的五种常见元素,其原子序数依次增大。X的基态原子的最外层电子排布式为nsnnpn+1。Y、Z同主族且ZY2是导致酸雨的主要物质之一。R位于ds区且原子最外层只有一个电子。W原子次外层电子数为最外层电子数的7倍。回答下列问题:(1)W位于元素周期表第________周期________族,其基态原子的核外电子排布式为________。(2)Y的气态氢化物稳定性比Z的气态氢化物的稳定性________(填“强”或“弱”)。Y的第一电离能比X的________(填“大”或“小”)。(3)X的最常见的气体氢化物分子的VSEPR模型为________,分子的空间构型是________。(4)原子总数相同、价电子总数相同的分子或离子称为等电子体。分别写出一种与XO互为等电子体的单质和化合物的化学式________、________。答案:(1)四 Ⅷ [Ar]3d64s2 (2)强 小(3)四面体形 三角锥形 (4)O3 SO2 认真思考 认真思考 主动探究 检测反馈 通过对价层电子对互斥模型的探究,建立解决复杂分子结构判断的思维模型。 思考讨论,应用模型。 应用模型,巩固基础。 思考交流,认识价层电子对之间的斥力。 课堂小结 一、价层电子对互斥模型(VSEPR模型)
答案: C5.X、Y、Z、W、R是元素周期表前四周期元素中的五种常见元素,其原子序数依次增大。X的基态原子的最外层电子排布式为nsnnpn+1。Y、Z同主族且ZY2是导致酸雨的主要物质之一。R位于ds区且原子最外层只有一个电子。W原子次外层电子数为最外层电子数的7倍。回答下列问题:(1)W位于元素周期表第________周期________族,其基态原子的核外电子排布式为________。(2)Y的气态氢化物稳定性比Z的气态氢化物的稳定性________(填“强”或“弱”)。Y的第一电离能比X的________(填“大”或“小”)。(3)X的最常见的气体氢化物分子的VSEPR模型为________,分子的空间构型是________。(4)原子总数相同、价电子总数相同的分子或离子称为等电子体。分别写出一种与XO互为等电子体的单质和化合物的化学式________、________。答案:(1)四 Ⅷ [Ar]3d64s2 (2)强 小(3)四面体形 三角锥形 (4)O3 SO2 认真思考 认真思考 主动探究 检测反馈 通过对价层电子对互斥模型的探究,建立解决复杂分子结构判断的思维模型。 思考讨论,应用模型。 应用模型,巩固基础。 思考交流,认识价层电子对之间的斥力。 课堂小结 一、价层电子对互斥模型(VSEPR模型)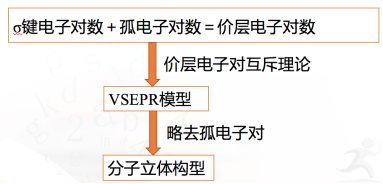 板书 一、价层电子对互斥模型(VSEPR模型)
板书 一、价层电子对互斥模型(VSEPR模型)
相关课件
这是一份高中化学沪科技版(2020)选择性必修2共价键的形成与性质教学演示课件ppt,文件包含21共价分子的空间结构教学课件pptx、21共价分子的空间结构分层作业原卷版docx、21共价分子的空间结构分层作业解析版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质优秀ppt课件,文件包含人教版化学选修二232《分子结构与物质的性质》第二课时课件pptx、232《分子结构与物质的性质》教案doc等2份课件配套教学资源,其中PPT共24页, 欢迎下载使用。
这是一份化学选择性必修2第二节 分子的空间结构公开课ppt课件,文件包含人教版化学选修二223《分子的空间结构》第三课时课件pptx、222分子的空间结构第三课时教案doc等2份课件配套教学资源,其中PPT共29页, 欢迎下载使用。










