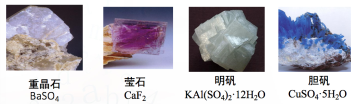
高中化学人教版 (2019)选择性必修2第三章 晶体结构与性质第三节 金属晶体与离子晶体获奖ppt课件
展开《金属晶体与离子晶体》第二课时 教学设计
课题 | 《金属晶体与离子晶体》 | 单元 | 3 | 学科 | 化学 | 年级 | 高二 |
教材 分析 | 本章内容比较系统地介绍了晶体结构与性质,内容比较丰富。第三章作为选修性必修2结尾章,与前两章一起构成“原子、分子、晶体的结构与性质”三位一体的物质结构与性质模块的基本内容。本节教学内容是人教版高中化学选择性必修第二册第三章《晶体结构与性质》第三节《金属晶体与离子晶体》第二课时。 本节安排了“离子晶体”这部分内容。学生通过学习这部分知识,能辨识常见的离子晶体,能从微观角度理解离子键对离子晶体性质的影响,能从宏观角度解释离子晶体性质的差异。通过对离子晶体模型的认识,理解离子晶体的结构特点,预测其性质。 | ||||||
教学目标与核心素养 | 宏观辨识与微观探析:能辨识常见的离子晶体,能从微观角度理解离子键对离子晶体性质的影响,能从宏观角度解释离子晶体性质的差异。
证据推理与模型认知:通过对离子晶体模型的认识,理解离子晶体的结构特点,预测其性质。
| ||||||
重点 难点 | 离子晶体 | ||||||
教学过程 |
教学环节 | 教师活动 | 学生活动 | 设计意图 |
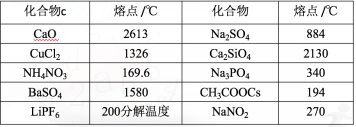
导入新课 | 思考:下列晶体构成微粒有什么共同点? 微粒之间存在哪种相同的作用力?
| 思考 | 通过思考,引发学生兴趣,提高学生学习积极性。 |
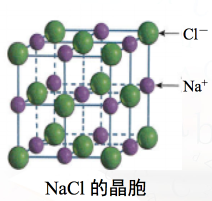
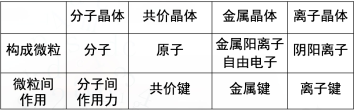
讲授新课 | 第三节 金属晶体与离子晶体 第二课时 离子晶体 一、离子晶体 1.定义 由阳离子与阴离子相互作用而形成的晶体,叫离子晶体。 2.构成微粒 阴阳离子。 3.微粒间作用 离子键——阴阳离子之间的静电作用。 4. NaCl 离子晶体及晶胞结构特点
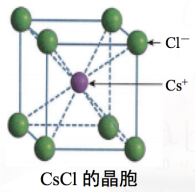
Cl-数 = 8×1/8 + 6×1/2 = 4 Na+数 = 12×1/4 + 1 = 4 思考:CsCl 离子晶体的晶胞特点会怎样呢?
Cl-数 = 8×1/8=1 Cs+数 = 1
在NaCl和CsCl两种离子晶体中,离子间存在着较强的离子键,使离子晶体的硬度较大,难于压缩;而且,要使它们由固态变成液态或气态,需要较多的能量破坏这些较强的离子键。因此, NaCl和CsCl具有较高的熔点和沸点。如NaCl的熔点为801 5. 常见离子晶体的结构 CaCO3 (NH4)2SO4 CuSO4·5H2O Cu(NH3)4SO4·H2O 观察以上离子晶体中都含有哪些微观粒子? 晶体内部存在哪些类型的化学键?
6. 离子晶体的性质
NaCl、CsCl 的熔、沸点比 HCl 的明显高很多,结合晶体类型,你能推测其原因吗? 离子键强度较大,破坏它需要较多的能量 NaCl 和 CsCl 的晶体硬度较大,难以压缩,熔点和沸点较高 思考 P 88 我们知道,金属的熔点差异很大,如钨的熔点为 3410 ℃。而常温下,汞却是液体。离子晶体的熔点是不是也差异很大呢?请从理化手册或互联网查找下列离子晶体的熔点数据,得出结论。
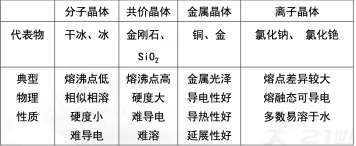
结论:离子晶体的熔点差距也较大。 典型晶体类型小结
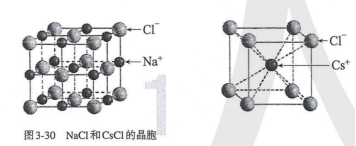
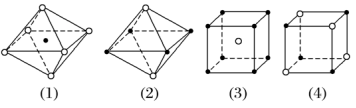
【课堂练习】 1.判断正误(对的在括号内打“√”,错的在括号内打“×”。) (1)离子晶体中一定含有金属元素( ) (2)由金属元素和非金属元素组成的晶体一定是离子晶体( ) (3)有些离子晶体中除含离子键外还存在共价键( ) (4)离子晶体的熔点一定低于共价晶体的熔点( ) (5)离子晶体受热熔化,破坏化学键,吸收能量,属于化学变化( ) (6)某些离子晶体受热失去结晶水,属于物理变化( ) 答案:(1)×(2)×(3)√(4)×(5)×(6)× 2.自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。下列一定能说明CaF2是离子晶体的实验是( ) A.CaF2难溶于水,其水溶液的导电性极弱 B.CaF2的熔、沸点较高,硬度较大 C.CaF2固体不导电,但在熔融状态下可以导电 D.CaF2在有机溶剂(如苯)中的溶解度极小 解析:选C。离子晶体中含有离子键,离子键在熔融状态下被破坏,电离出自由移动的阴、阳离子,所以离子晶体在熔融状态下能够导电,这是判断某晶体是否为离子晶体的依据。 3.如图所示是从NaCl或CsCl的晶胞结构中分割出来的部分结构图,其中属于从NaCl晶胞中分割出来的结构图是( )
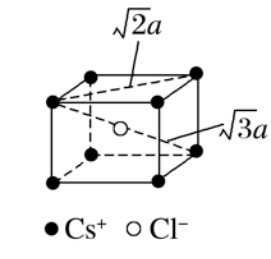
A.图(1)和(3) B.图(2)和(3) C.图(1)和(4) D.只有图(4) 解析:选C。NaCl晶体中,每个Na+周围最邻近的Cl-有6个,构成正八面体,同理,每个Cl-周围最邻近的6个Na+也构成正八面体,由此可知图(1)和(4)是从NaCl晶体中分割出来的结构图,C项正确。 4. 下列物质中属于含有中心分子的离子晶体的是( ) A.CaCO3 B.Na2O2 C.(NH4)2SO4 D.Cu(NH3)4SO4·H2O 答案:C。 5.下列有关离子晶体的叙述中,不正确的是( ) A.1 mol氯化钠晶体中有NA个NaCl分子 B.氯化钠晶体中,每个Na+周围距离最近且相等的Cl-共有6个 C.醋酸钠属于离子晶体,含非极性键 D.平均每个NaCl晶胞中有4个Na+、4个Cl- 答案 A 解析 NaCl为面心立方结构,每个晶胞中Na+的个数为12×+1=4,Cl-的个数为8×+6×=4,则1 mol氯化钠晶体中有4NA个Na+、4NA个Cl-,不存在分子,A项错误、D项正确;由NaCl的晶胞结构可知,Na+在棱心和体心时,顶点和面心为Cl-,则每个Na+周围距离最近且相等的Cl-共有6个,B项正确;醋酸钠中存在碳碳非极性键,C项正确。 6.下列物质的晶体一定属于离子晶体的是( ) A.在水中能电离出离子的物质 B.在水中能电离出SO的化合物 C.在水中能电离出Na+的化合物 D.熔化时化学键无变化的化合物 答案 C 7.根据CsCl的晶胞结构分析,CsCl晶体中两距离最近的Cs+间距离为a,则每个Cs+周围与其距离为a的Cs+数目为________;每个Cs+周围距离相等且次近的Cs+数目为________,距离为________;每个Cs+周围距离相等且第三近的Cs+数目为________,距离为________;每个Cs+周围紧邻且等距的Cl-数目为________。
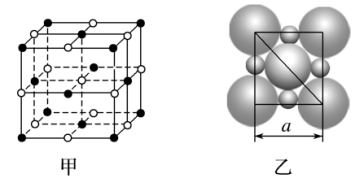
答案 6 12 a 8 a 8 解析 以题图的一个Cs+为基准,与其最近的Cs+分别位于其上、下、前、后、左、右六个方位,有6个;与其次近的Cs+的距离为a,在1个晶胞中有3个,而1个Cs+为8个晶胞共有,故有8×3×=12个;与其第三近的Cs+的距离为a,每个晶胞中有1个,故有8个;与其紧邻且等距的Cl-有8个。 8.在离子晶体中,阴、阳离子按一定的规律进行排列,如图甲是NaCl的晶胞结构。在离子晶体中,阴、阳离子具有或近似具有球形对称结构,它们可以看作是不等径的刚性圆球,并彼此相切,如图乙。已知a为常数。
(1)在NaCl晶体中,每个Na+同时吸引________个Cl-;而Na+与Cl-的数目之比为________。 (2)Na+半径与Cl-半径之比为________(已知 (3)若a=5.6×10-8 cm,NaCl晶体的密度为________(已知5.63=175.6,NaCl的摩尔质量为58.5 g·mol-1)。 答案 (1)6 1∶1 (2)0.414∶1 (3)2.2 g·cm-3 解析 (1)观察晶胞的结构可知,每个Na+同时吸引6个Cl-;在每个晶胞中含Na+的个数为4,含Cl-的个数也为4,即Na+与Cl-的数目之比为1∶1。 (2)由图乙可知,因为r(Cl-)>r(Na+),则r(Cl-)= (3)由NaCl晶体结构分析,每个晶胞中含有4个“NaCl”,则ρV=
|
思考
认真思考
|
能辨识常见的离子晶体,能从微观角度理解离子键对离子晶体性质的影响,能从宏观角度解释离子晶体性质的差异。
通过对离子晶体模型的认识,理解离子晶体的结构特点,预测其性质。
检测反馈 |
课堂小结 | 一、离子晶体
|
|
|
板书 | 一、离子晶体
|
|
|
高中化学人教版 (2019)选择性必修2第三节 金属晶体与离子晶体完整版ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第三节 金属晶体与离子晶体完整版ppt课件,文件包含人教版化学选修二331《金属晶体与离子晶体》第一课时课件pptx、331金属晶体教案docx等2份课件配套教学资源,其中PPT共26页, 欢迎下载使用。
高中第三节 金属晶体与离子晶体精品习题ppt课件: 这是一份高中第三节 金属晶体与离子晶体精品习题ppt课件,共22页。PPT课件主要包含了离子键,离子晶体,离子晶体的性质,氯化钠晶体,CsCl晶体,归纳小结等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第三节 金属晶体与离子晶体优秀课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第三节 金属晶体与离子晶体优秀课件ppt,文件包含332金属晶体与离子晶体第2课时离子晶体习题精练高二化学同步习题精练人教版2019选择性必修2含解析卷docx、332金属晶体与离子晶体第2课时离子晶体课件精讲高二化学同步课件精讲人教版2019选择性必修2pptx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。