










所属成套资源:人教版化学选择性必修2课件PPT+教案
人教版 (2019)选择性必修2第四节 配合物与超分子获奖课件ppt
展开
这是一份人教版 (2019)选择性必修2第四节 配合物与超分子获奖课件ppt,文件包含人教版化学选修二341《配合物与超分子》第一课时课件pptx、341配合物与超分子教案docx等2份课件配套教学资源,其中PPT共26页, 欢迎下载使用。
《配合物与超分子》第一课时 教学设计课题《配合物与超分子》单元3学科化学年级高二教材分析本章内容比较系统地介绍了晶体结构与性质,内容比较丰富。第三章作为选修性必修2结尾章,与前两章一起构成“原子、分子、晶体的结构与性质”三位一体的物质结构与性质模块的基本内容。本节教学内容是人教版高中化学选择性必修第二册第三章《晶体结构与性质》第四节《配合物与超分子》第一课时。 本节安排了“配合物与超分子”这部分内容。学生通过学习这部分知识,能从微观角度理解配位键的形成条件和表示方法,能判断常见的配合物。能利用配合物的性质去推测配合物的组成,从而形成“结构决定性质”的认知模型。了解超分子的结构特点与性质。 教学目标与核心素养宏观辨识与微观探析:能从微观角度理解配位键的形成条件和表示方法,能判断常见的配合物。 证据推理与模型认知:能利用配合物的性质去推测配合物的组成,从而形成“结构决定性质”的认知模型。 重点难点配合物与超分子 教学过程教学环节教师活动学生活动设计意图导入新课思考:无水CuSO4是白色的,为什么CuSO4·5H2O晶体却是蓝色的? 思考通过思考,引发学生兴趣,提高学生学习积极性。讲授新课第四节 配合物与超分子 一、配合物实验3-2向盛有下表中固体样品的试管中,分别加入足量的水,观察实验现象并填写下表
思考通过思考,引发学生兴趣,提高学生学习积极性。讲授新课第四节 配合物与超分子 一、配合物实验3-2向盛有下表中固体样品的试管中,分别加入足量的水,观察实验现象并填写下表 [Cu(H2O)4]2+叫做四水合铜离子Cu2+与H2O是如何结合成[Cu(H2O)4]2+的呢?
[Cu(H2O)4]2+叫做四水合铜离子Cu2+与H2O是如何结合成[Cu(H2O)4]2+的呢? 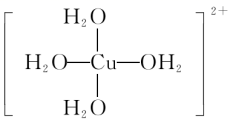
 在四水合铜离子中,铜离子与水分子之间的化学键是由水分子提供孤电子对给予铜离子,铜离子接受水分子的孤电子对形成的。1.配位键成键原子或离子一方提供空轨道,另一方提供孤电子对而形成的,这类“电子对给予-接受”键被称为配位键。形成条件:①一方能提供孤电子对:如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等。②另一方能提供空轨道:如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等过渡金属的原子或离子。配位键是一种特殊的共价键,同样具有饱和性和方向性。一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。2.配位化合物通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。配位化合物一定含有配位键但含有配位键的化合物不一定是配位化合物例如:CO、NH4+、H3O+、SO42-、P2O5(1)中心原子(离子):提供空轨道的金属离子或原子。一般是过渡金属,必须有空轨道。(2)配位体:含有孤电子对的分子或离子 NH3 H2O CO Cl- SCN- CN-(3)配位原子:配位体中具有孤电子对的原子N O P S,一般是ⅤA Ⅵ A ⅦA的非金属原子(4)配位数:直接同中心原子配位的原子数目,一般是2、4、6、8(5)配离子的电荷:等于中心离子和配体总电荷的代数和,如:[Fe(SCN)6]3-3.配合物的组成
在四水合铜离子中,铜离子与水分子之间的化学键是由水分子提供孤电子对给予铜离子,铜离子接受水分子的孤电子对形成的。1.配位键成键原子或离子一方提供空轨道,另一方提供孤电子对而形成的,这类“电子对给予-接受”键被称为配位键。形成条件:①一方能提供孤电子对:如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等。②另一方能提供空轨道:如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等过渡金属的原子或离子。配位键是一种特殊的共价键,同样具有饱和性和方向性。一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。2.配位化合物通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。配位化合物一定含有配位键但含有配位键的化合物不一定是配位化合物例如:CO、NH4+、H3O+、SO42-、P2O5(1)中心原子(离子):提供空轨道的金属离子或原子。一般是过渡金属,必须有空轨道。(2)配位体:含有孤电子对的分子或离子 NH3 H2O CO Cl- SCN- CN-(3)配位原子:配位体中具有孤电子对的原子N O P S,一般是ⅤA Ⅵ A ⅦA的非金属原子(4)配位数:直接同中心原子配位的原子数目,一般是2、4、6、8(5)配离子的电荷:等于中心离子和配体总电荷的代数和,如:[Fe(SCN)6]3-3.配合物的组成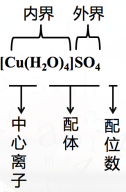 对于配合物,外界在水溶液中易电离,但内界却难电离。实验3-3实验操作①向盛有4mL 0.1mol/L CuSO4溶液的试管里滴加几滴1 mol/L 氨水②继续添加氨水并振荡试管③再向试管中加入极性较小的溶剂(如加入8 mL 95%乙醇),并用玻璃棒摩擦试管壁实验现象①形成难溶物②难溶物溶解,得到深蓝色的透明溶液③析出深蓝色晶体实验原理① Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+② Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 ③深蓝色晶体为[Cu(NH3)4]SO4·H2O,说明该配合物在乙醇中的溶解度小于在水中的溶解度
对于配合物,外界在水溶液中易电离,但内界却难电离。实验3-3实验操作①向盛有4mL 0.1mol/L CuSO4溶液的试管里滴加几滴1 mol/L 氨水②继续添加氨水并振荡试管③再向试管中加入极性较小的溶剂(如加入8 mL 95%乙醇),并用玻璃棒摩擦试管壁实验现象①形成难溶物②难溶物溶解,得到深蓝色的透明溶液③析出深蓝色晶体实验原理① Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+② Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 ③深蓝色晶体为[Cu(NH3)4]SO4·H2O,说明该配合物在乙醇中的溶解度小于在水中的溶解度 实验证明,无论在得到的深蓝色透明溶液中,还是在析出的深蓝色的晶体中,深蓝色都是由于存在 [Cu(NH3)4]2+,它是Cu2+的另一种常见配离子,中心离子仍然是Cu2+,而配体是NH3,配位数为4。实验3-4实验操作
实验证明,无论在得到的深蓝色透明溶液中,还是在析出的深蓝色的晶体中,深蓝色都是由于存在 [Cu(NH3)4]2+,它是Cu2+的另一种常见配离子,中心离子仍然是Cu2+,而配体是NH3,配位数为4。实验3-4实验操作![]() 向盛有少量0.1 mol/L FeCl3溶液(或任何含Fe3+的溶液)的试管中滴加1滴0.1 mol/L硫氰化钾(KSCN)溶液。实验现象溶液变为红色实验原理Fe3++nSCN- = [Fe(SCN)n]3-n配位数可为1—6n = 1-6,随SCN-的浓度而异 利用硫氰化铁配离子等颜色,可用于鉴别溶液中存在Fe3+;又由于硫氰化铁配离子的颜色极似血液,常被用于电影特技和魔术实验3-5实验操作 向盛有少量0.1moI/ L NaCl溶液的试管里滴几滴0.1 mol/L AgNO3溶液,产生难溶于水的白色的AgCl沉淀,再滴入1molL氨水,振荡,观察实验现象。实验现象先产生白色沉淀,滴加氨水后白色沉淀溶解实验原理Ag++Cl-===AgCl↓AgCl+2NH3=== [Ag(NH3)2]Cl4.配合物的性质配合物具有一定的稳定性,配位键越强,配合物越稳定。许多过渡金属元素的离子对多种配体具有很强对结合力,因而,过渡金属配合物远比主族金属配合物多。5.配合物的应用(1) 在生命体中的应用 叶绿素:Mg2+的配合物血红素:Fe2+的配合物酶:含锌的配合物、含锌酶有80多种维生素B12:钴配合物(2)在医药中的应用抗癌药物(3) 配合物与生物固氮固氮酶(4)在生产生活中的应用王水溶金:H[AuCl4]电解氧化铝的助熔剂 Na3[AlF6]热水瓶胆镀银 [Ag(NH3)2]+二、超分子1.定义由两种或两种以上的分子通过分子间相互作用形成的分子聚集体称为超分子超分子定义中的分子是广义的,包括离子。2.超分子实例
向盛有少量0.1 mol/L FeCl3溶液(或任何含Fe3+的溶液)的试管中滴加1滴0.1 mol/L硫氰化钾(KSCN)溶液。实验现象溶液变为红色实验原理Fe3++nSCN- = [Fe(SCN)n]3-n配位数可为1—6n = 1-6,随SCN-的浓度而异 利用硫氰化铁配离子等颜色,可用于鉴别溶液中存在Fe3+;又由于硫氰化铁配离子的颜色极似血液,常被用于电影特技和魔术实验3-5实验操作 向盛有少量0.1moI/ L NaCl溶液的试管里滴几滴0.1 mol/L AgNO3溶液,产生难溶于水的白色的AgCl沉淀,再滴入1molL氨水,振荡,观察实验现象。实验现象先产生白色沉淀,滴加氨水后白色沉淀溶解实验原理Ag++Cl-===AgCl↓AgCl+2NH3=== [Ag(NH3)2]Cl4.配合物的性质配合物具有一定的稳定性,配位键越强,配合物越稳定。许多过渡金属元素的离子对多种配体具有很强对结合力,因而,过渡金属配合物远比主族金属配合物多。5.配合物的应用(1) 在生命体中的应用 叶绿素:Mg2+的配合物血红素:Fe2+的配合物酶:含锌的配合物、含锌酶有80多种维生素B12:钴配合物(2)在医药中的应用抗癌药物(3) 配合物与生物固氮固氮酶(4)在生产生活中的应用王水溶金:H[AuCl4]电解氧化铝的助熔剂 Na3[AlF6]热水瓶胆镀银 [Ag(NH3)2]+二、超分子1.定义由两种或两种以上的分子通过分子间相互作用形成的分子聚集体称为超分子超分子定义中的分子是广义的,包括离子。2.超分子实例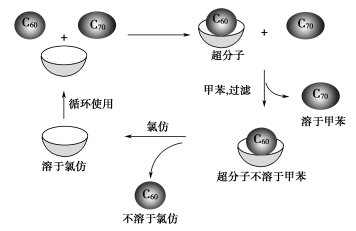
 (2)冠醚识别碱金属离子(如K+)。 冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子;冠醚识别碱金属离子。不同大小的冠醚可以识别不同大小的碱金属离子。冠醚冠醚空腔直径/pm适合的粒子(直径/pm)12-冠-415-冠-518-冠-621-冠-7120~150170~220260~320340~430Li+(152)Na+(204)K+(276)Rb+(304)Cs+(334)3.超分子的重要特征分子识别、自组装【课堂练习】1.判断正误(对的在括号内打“√”,错的在括号内打“×”。)(1)配位键实质上是一种特殊的共价键( )(2)提供孤电子对的微粒既可以是分子,也可以是离子( )(3)有配位键的化合物就是配位化合物( )(4)配位化合物都很稳定( )(5)在配合物[Co(NH3)5Cl]Cl2中的Cl-均可与AgNO3反应生成AgCl沉淀( )(6)Ni(CO)4是配合物,它是由中心原子与配体构成的( )答案:(1)√(2)√(3)×(4)×(5)× (6)√ 2.下列不能形成配位键的组合是( )A.Ag+、NH3 B.H2O、H+C.Co3+、CO D.Ag+、H+解析:选D. 配位键的形成条件必须是一方能提供孤电子对,另一方能提供空轨道,A、B、C三项中,Ag+、H+、Co3+能提供空轨道,NH3、H2O、CO能提供孤电子对,所以能形成配位键,而D项Ag+与H+都只能提供空轨道,而无法提供孤电子对,所以不能形成配位键。 3.若X、Y两种粒子之间可形成配位键,则下列说法正确的是( )A.X、Y只能是分子B.X、Y只能是离子C.若X提供空轨道,则Y至少要提供一对孤电子对D.一定是X提供空轨道,Y提供孤电子对解析:选C。形成配位键的两种微粒可以均是分子或者均是离子,还可以一种是分子、一种是离子,但必须是一种微粒提供空轨道、另一种微粒提供孤电子对,A、B项错误,C项正确。 4. 0.01 mol氯化铬(CrCl3·6H2O)在水溶液中用过量的AgNO3处理,产生0.01 mol AgCl沉淀,此氯化铬最可能是( )A.[Cr(H2O)6]Cl3B.[Cr(H2O)5Cl]Cl2·H2OC.[Cr(H2O)4Cl2]Cl·2H2OD.[Cr(H2O)3Cl3]·3H2O答案:C。解析 0.01 mol氯化铬(CrCl3·6H2O)在水溶液中用过量的AgNO3处理,产生0.01 mol AgCl沉淀,说明1 mol氯化铬(CrCl3·6H2O)中有1 mol氯离子在外界,其余在内界,而正三价铬为六配位,则此氯化铬最可能是[Cr(H2O)4Cl2]Cl·2H2O,C正确。 5. 化合物NH3与BF3可以通过配位键形成NH3·BF3。(1)配位键的形成条件是____________________________________。(2)在NH3·BF3中,________原子提供孤电子对,________原子接受电子。 解析 (1)微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有能够接受孤电子对的空轨道的原子或离子。(2)在NH3·BF3中,B原子是提供空轨道的原子、N原子提供孤对电子,B、N原子之间形成配位键。 思考 认真思考 能从微观角度理解配位键的形成条件和表示方法,能判断常见的配合物。 能利用配合物的性质去推测配合物的组成,从而形成“结构决定性质”的认知模型。 了解超分子的结构特点与性质。 检测反馈课堂小结 一、配合物与超分子
(2)冠醚识别碱金属离子(如K+)。 冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子;冠醚识别碱金属离子。不同大小的冠醚可以识别不同大小的碱金属离子。冠醚冠醚空腔直径/pm适合的粒子(直径/pm)12-冠-415-冠-518-冠-621-冠-7120~150170~220260~320340~430Li+(152)Na+(204)K+(276)Rb+(304)Cs+(334)3.超分子的重要特征分子识别、自组装【课堂练习】1.判断正误(对的在括号内打“√”,错的在括号内打“×”。)(1)配位键实质上是一种特殊的共价键( )(2)提供孤电子对的微粒既可以是分子,也可以是离子( )(3)有配位键的化合物就是配位化合物( )(4)配位化合物都很稳定( )(5)在配合物[Co(NH3)5Cl]Cl2中的Cl-均可与AgNO3反应生成AgCl沉淀( )(6)Ni(CO)4是配合物,它是由中心原子与配体构成的( )答案:(1)√(2)√(3)×(4)×(5)× (6)√ 2.下列不能形成配位键的组合是( )A.Ag+、NH3 B.H2O、H+C.Co3+、CO D.Ag+、H+解析:选D. 配位键的形成条件必须是一方能提供孤电子对,另一方能提供空轨道,A、B、C三项中,Ag+、H+、Co3+能提供空轨道,NH3、H2O、CO能提供孤电子对,所以能形成配位键,而D项Ag+与H+都只能提供空轨道,而无法提供孤电子对,所以不能形成配位键。 3.若X、Y两种粒子之间可形成配位键,则下列说法正确的是( )A.X、Y只能是分子B.X、Y只能是离子C.若X提供空轨道,则Y至少要提供一对孤电子对D.一定是X提供空轨道,Y提供孤电子对解析:选C。形成配位键的两种微粒可以均是分子或者均是离子,还可以一种是分子、一种是离子,但必须是一种微粒提供空轨道、另一种微粒提供孤电子对,A、B项错误,C项正确。 4. 0.01 mol氯化铬(CrCl3·6H2O)在水溶液中用过量的AgNO3处理,产生0.01 mol AgCl沉淀,此氯化铬最可能是( )A.[Cr(H2O)6]Cl3B.[Cr(H2O)5Cl]Cl2·H2OC.[Cr(H2O)4Cl2]Cl·2H2OD.[Cr(H2O)3Cl3]·3H2O答案:C。解析 0.01 mol氯化铬(CrCl3·6H2O)在水溶液中用过量的AgNO3处理,产生0.01 mol AgCl沉淀,说明1 mol氯化铬(CrCl3·6H2O)中有1 mol氯离子在外界,其余在内界,而正三价铬为六配位,则此氯化铬最可能是[Cr(H2O)4Cl2]Cl·2H2O,C正确。 5. 化合物NH3与BF3可以通过配位键形成NH3·BF3。(1)配位键的形成条件是____________________________________。(2)在NH3·BF3中,________原子提供孤电子对,________原子接受电子。 解析 (1)微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有能够接受孤电子对的空轨道的原子或离子。(2)在NH3·BF3中,B原子是提供空轨道的原子、N原子提供孤对电子,B、N原子之间形成配位键。 思考 认真思考 能从微观角度理解配位键的形成条件和表示方法,能判断常见的配合物。 能利用配合物的性质去推测配合物的组成,从而形成“结构决定性质”的认知模型。 了解超分子的结构特点与性质。 检测反馈课堂小结 一、配合物与超分子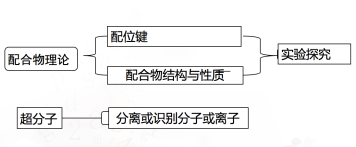 板书 一、配合物与超分子
板书 一、配合物与超分子
相关课件
这是一份人教版 (2019)选择性必修2第四节 配合物与超分子习题课件ppt,文件包含341配合物与超分子第1课时配合物课件精讲-名课堂精选2022-2023学年高二化学同步课件精讲及习题精练人教版2019选择性必修2pptx、实验3-3四氨合铜离子的生成mp4、实验3-4铁离子与硫氰根离子的反应mp4、实验3-5银氨离子的生成mp4等4份课件配套教学资源,其中PPT共29页, 欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修2第三章 晶体结构与性质第四节 配合物与超分子习题ppt课件,文件包含341配合物与超分子第1课时配合物习题精练-2022-2023学年高二化学同步课件精讲及习题精练人教版2019选择性必修2原卷版docx、341配合物与超分子第1课时配合物习题精练-2022-2023学年高二化学同步课件精讲及习题精练人教版2019选择性必修2解析版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修2第四节 配合物与超分子优秀课件ppt,共32页。PPT课件主要包含了空轨道,孤电子对,sp2等内容,欢迎下载使用。










