


高中化学人教版 (2019)必修 第二册第一节 化学反应与能量变化试讲课ppt课件
展开《化学反应与能量变化》第一课时教学设计
课题 | 《化学反应与能量变化》第一课时 | 单元 | 6 | 学科 | 化学 | 年级 | 高一 |
教材 分析 | 本节教学内容是人教版高中化学必修第二册第六章《化学反应与能量》第一节《化学反应与能量变化》的第一课时。本章教材给学生建立一个重要的思想,化学反应中不仅有物质的变化同时伴随有能量变化,让学生能从物质和能量两个角度认识物质世界的变化规律,然后展开对化学变化相关理论的学习,如:化学反应的快慢,以及从能否进行到底的角度认识化学反应,化学平衡状态、勒夏特列原理这些基本理论。搞清楚反应是吸热反应还是放热反应,是判断温度对化学平衡移动的影响的前提。 本节教材,对于构建学生完整的化学反应体系有重要作用,又是对后边化学平衡移动的学习作铺垫。化学热力学可以解决化学反应中能量变化的问题,同时可以解决化学反应进行的方向和进行的限度问题。学生首先利用键能计算几个化学反应中的能量变化,在单一物质体系的转化中感受“化学键”的局限,仅有它是不够的。让学生在本节内容的学习中树立起化学反应的能量转化观以及定量研究能量转化的思想,从理论和定量层面更深入地让学生体会和感受到运用化学变化实现能量转化的重大意义。 本节安排了“吸热和放热反应”,“反应热(焓变)”“反应热的有关计算”“世界能源”这四部分内容。学生通过学习这部分知识,掌握化学反应与能量的关系以及计算方法,会根据键能计算化学反应的焓变,能根据图像判断化学反应是吸热还是放热反应。 | ||||||
教学目标与核心素养 | 宏观辨识与微观探析:通过放热和吸热反应的实验,然学生直观的感觉化学反应中的能量变化,进一步激发学生学习化学的兴趣和求知欲望,启发学生分析产生有关现象的因果关系和本质联系,从而使学生了解学习和研究化学问题的一般方法和思维过程 证据推理与模型认知:通过揭示问题、讨论释疑、动手实验,学习对比、推断等多种科学探究方法,学会由事物的表象分析事物的本质和变化,提高学生的实验能力、观察能力和对实验现象的分析、推理及归纳总结能力。 科学探究与创新意识:从现象和结构出发,设计探究方案,探究硫的转化过程中的化学反应原理,在探究中互利合作,培养团队精神。 科学精神与社会责任:激发学生透过现象探究本质的兴趣,尊重科学,认真学习科学的学习方法;通过参与探究过程,培养自身严谨的科学态度和辩证分析能力。 | ||||||
重点 难点 | 通过键能计算反应热;根据反应物和生成物能量图像判断反应是放热反应还是还是吸热反应。 | ||||||
教学过程 |
教学环节 | 教师活动 | 学生活动 | 设计意图 | |||||||||||||||
导入新课 | 火的发现和使用使人类告别了茹毛饮血的时代,从野蛮走向文明。我们利用的正是燃烧过程中释放的能量,化学反应不仅仅是物质的变化,还伴随有能量的变化。化学能可以转化为光能、热能、电能等,当能量以热的形式表现时,化学反应就分为吸热反应和放热反应。那么化学中都有哪些放热和吸热反应? |
|
| |||||||||||||||
讲授新课 | 第一节化学反应与能量变化 一、吸热和放热反应 1.实验 【实验6-1】 在一支试管中加入2mL 2mol/L盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化。 实验现象:在实验6-1中,镁条不断溶解,有气泡产生,同时观察到温度计温度升高,说明反应放出了热量。 反应方程式:Mg+2HCl==MgCl2+H2↑ 【实验6-2】将20gBa(OH)2.8H2O晶体研细后与10gNH4Cl晶体仪器放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,闻到气味后迅速用玻璃片盖上烧杯,用手触摸烧杯壁下部,试着用手拿起烧杯,观察现象。 实验现象:在实验6-2中,用手触摸烧杯壁下部,烧杯壁冰冷,拿起烧杯,木片上的水滴结冰,和烧杯底部粘结在一起,说明反应吸收了热量。 反应方程式: Ba(OH)2.8H2O+2NH4Cl==NH3↑+BaCl2+10H2O 2.放热反应和吸热反应 化学上把释放热量的化学反应称为放热反应,如镁条、铝片和盐酸的反应,木炭、氢气、甲烷等在氧气中的燃烧,氢气与氯气的化合等都是放热反应。 把吸收热量的化学反应称为吸热反应,如氢氧化钡和氯化铵的反应,盐酸和碳酸氢钠的反应,灼热的炭与二氧化碳的反应等都是吸热反应。
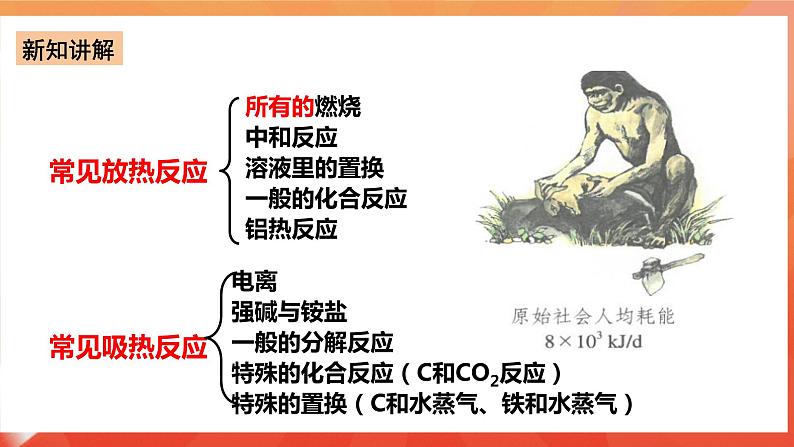
中和反应 常见放热反应 溶液里的置换反应 一般的化合反应 铝热反应
强碱与铵盐 常见的吸热反应 一般的分解反应 特殊的化合反应(C和CO2反应) 特殊的置换(C和水蒸气、铁和水蒸气) 二、反应热(焓变) 1.化学反应过程中所释放或吸收的能量,都可以用热量(或换算成相应的热量)来表述,叫做反应热,在恒压条件下又称为焓变。 PS:①符号:△H;单位: kJ/mol 或 kJ·mol-1; ②反应热描述的是化学反应前后的热量变化; ③反应热描述的是一定温度下的热量变化; ④任何化学反应都有反应热,表现为吸热反应或者放热反应; ⑤反应体系的能量降低(即放热反应),则∆H为“-”; 反应体系的能量升高(即 吸热反应),则∆H为“+”;
①我们已经认识了反应热,那么如何在化学方程式中正确反映其热量的变化?---------------热化学方程式 表示参加反应物质的量和反应热的关系的化学方程式,叫做热化学方程式。 与化学方程式相比,热化学方程式有哪些不同? 正确书写热化学方程式应注意哪几点? ②热化学方程式 能表示参加反应物质的量和反应热的关系的化学方程式
H2(g)+I2(g)======2HI(g) △H=-14.9kJ/mol
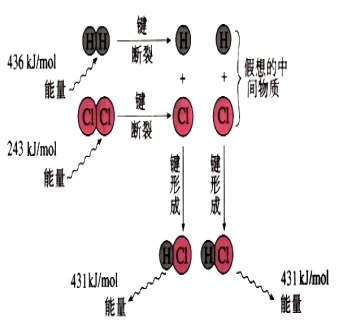
⑴热化学方程式包含物质变化和能量变化两个部分,二者缺一不可。 普通化学方程式只包含物质变化一个部分。 ⑵热化学方程式需注明反应时的温度和压强。对于 25℃ 101kPa时进行的反应可不注明。 普通化学方程式不需注明温度和压强。 ⑶热化学方程式需注明各物质的状态。 普通化学方程式不需注明物质的状态。 ⑷热化学方程式中化学计量数表示参加反应的各物质的物质的量,可为整数或分数,其△H与系数对应成比例。 普通化学方程式中化学计量数宏观上表示各物质的物质的量,微观上表示原子分子数目,只能为整数,不能为分数。 3.书写热化学方程式的注意事项 ①化学方程的右边必须写上△H,并用“空格”隔开, △H:吸热用“+”,放热用:“-”,单位是kJ/mol或J/mol; ②需注明反应的温度和压强,如不注明条件,即指: 25℃ 1.01×105Pa; ③物质后需注明物质状态(s固体、l液体、g气体、aq溶液中); ④热化学方程式中各物质化学式前面的化学计量数仅表示物质的量并不能表示物质的分子数或原子数,因此化学计量数可以是整数也可以是分数; ⑤根据焓的性质,若化学方程式中各物质的系数加倍,则△H的数值也加倍;若反应逆向进行,则△H改变符号,但绝对值不变; ⑥ 热化学方程式一般不要写反应条件。 三、反应热的有关计算 1.由键能计算反应热 键能(通常指共价键)断开1mol共价键所吸收的能量或形成1mol共价键所放出的能量。 旧键断裂需要吸收能量,新键形成会放出能量。 下面以H2和Cl2反应生成HCl为例:
旧键断裂 ----- 吸收能量 436+243= 679kJ/mol 新键形成 —---- 放出能量 431+431=862 kJ/mol 反应放出热量:862kJ/mol-679kJ/mol=183kJ/mol 所以:一个化学反应是放热还是吸热取决于,所有断键吸收的总能量与所有形成新键放出的总能量的相对大小、与反应条件无关。 ∆H=E(反应物键能总和)-E(生成物键能总和) 2.反应物和生成物的能量 当反应物的能量高于生成物的能量,反应放出热量,为放热反应;当反应物的能量低于生成物的能量,反应吸收热量,为吸热反应。 3、反应热( ΔH)的计算方法 (1)由焓变计算:ΔH=E(吸收的能量)-E(放出的能量) (2)由键能计算: ΔH=E(反应物键能之和)-E(生成物的键能之和) (3)由物质能量计算:ΔH=E(生成物的总能量)-E(反应物的总能量) 思考: 物质具有的能量与其稳定性之间存在什么关系? 物质具有的能量越低越稳定。一般原子间的化学键越牢固,键能越大,物质越稳定。 吸热反应和放热反应的对比
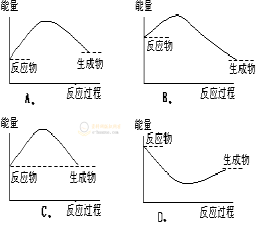
四、世界能源 1.从古到今,人类的能源主要来自于物质的燃烧。进入近现代社会,煤、石油、天然气等化石 燃料成为主要的能源,但是化石燃料存在的主要问题:一是不可再生并且储量有限;二是在燃烧和使用过程中产生了粉尘、SO2、NOx、CO等大气污染物。所以人类必须节约能源并寻找合适的新能源。 2.节能一方面是减少能源使用,另一方面则要提高能源的利用率。 目前,人类比较理想的新能源,主要包括太阳能、风能、地热能、海洋能和氢能等。 思考与讨论: 煤、汽油和柴油等作为燃料大量使用会造成空气污染,但不适用它们又会严重影响现代社会的生产和生活。对此,请从社会不同人群的角度,提出你的想法和建议,并与同学讨论。 答案提示:让学生从工厂、工人、司机、生活等角度自由发挥。 信息搜索 (1)利用互联网(如国家统计局网站)搜索近10年我国每年的能源消费总量和能源矿产储量的数据及变化趋势,体会节能的重要性和必要性。 (2) 通过查阅书刊或互联网搜索,了解煤和石油产品的燃烧排放物对环境和气候的影响,以及人类正在采取的应对措施。 随堂练习: 1.(课本41页第一题)化学反应的本质是有新物质生成,物质的变化是化学反应的基本特征之一,化学反应的另一基本特征是__________,通常表现为_____的释放或吸收。 答案:化学键的断裂和形成;能量。 2、(课本41页第3题)下列说法错误的是( ) A、化学反应必然伴随发生能量变化 B、化学反应中能量变化的大小与反应物的质量多少无关 C、能量变化必然伴随发生化学变化 D、化学反应中的能量变化主要是由化学键变化引起的 答案为:C 【解析】A、化学反应必然伴随能量变化,故A正确; B、焓变的数值与化学计量数对应,故B正确; C、能量变化不一定伴随化学反应,比如浓硫酸溶于水放热,故C错误; D、化学反应中的能量变化主要是由化学键的断裂和形成引起的,故D正确; 3、(课本41页第4题)在一定条件下,石墨转化为金刚石要吸收能量,在该条件下,下列结论正确的是( ) A、金刚石比石墨稳定 B、等质量的金刚石和石墨完全燃烧释放的热量相同 C、金刚石转化为石墨是吸热反应 D、1molC(金刚石)比1mol(石墨)的总能量高 答案为:D 【解析】A、石墨能量低,能量越低越稳定,A错误; B、金刚石和石墨能量不同,等质量时,放出的热量不同,B错误; C、金刚石转化为石墨要放出热量,C错误; D、石墨转化为金刚石吸收热量,所以金刚石能量高,D正确。 4、已知键能: N≡N: 946KJ/mol,H-H :436KJ/mol, H-N :391KJ/molN2(g) + 3H2(g)==2NH3(g),从理论上计算△H为( ) A.+1800KJ/mol B. + 92KJ/mol C. – 92KJ/mol D. – 46KJ/mol 答案为:C 【解析】 △H=946kJ/mol+3×436kJ/mol-6×391kJ/mol=-92kJ/mol 5.已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是( ) A. A的能量一定高于C B. B的能量一定高于D C. A和B的总能量一定高于C和D的总能量 D. 该反应为放热反应,故不必加热就一定能发生 答案为:C 【解析】该反应放热,说明反应物的能量和高于生成物的能量和 6.下列各图中,表示正反应是吸热反应的图是( )
答案为:A 【解析】放热反应,生成物的能量高于反应物的能量;吸热反应,生成物的能量低于反应物的能量。 |
|
| |||||||||||||||
课堂小结 | 反应热、焓变 从焓变角度看:ΔH=生成物的焓-反应物的焓 从反应热角度看:ΔH=生成物能量-反应物能量 从键能角度看:ΔH=反应物总键能-生成物总键能 放热反应:ΔH<0或 ΔH为“-” 吸热反应:ΔH>0 或ΔH为“+” |
|
| |||||||||||||||
板书 | 一、吸热和放热反应 二、反应热(焓变) 三、反应热的有关计算 四、世界能源 |
|
| |||||||||||||||
高中人教版 (2019)第一节 化学反应与能量变化背景图课件ppt: 这是一份高中人教版 (2019)<a href="/hx/tb_c4000040_t3/?tag_id=26" target="_blank">第一节 化学反应与能量变化背景图课件ppt</a>,共1页。
高中化学人教版 (2019)必修 第二册第一节 化学反应与能量变化精品ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第一节 化学反应与能量变化精品ppt课件,文件包含新人教版必修2化学61《化学反应与能量变化》第二课时课件pptx、61化学反应和能量变化2doc等2份课件配套教学资源,其中PPT共34页, 欢迎下载使用。
化学第六章 化学反应与能量第一节 化学反应与能量变化示范课ppt课件: 这是一份化学第六章 化学反应与能量第一节 化学反应与能量变化示范课ppt课件,共60页。