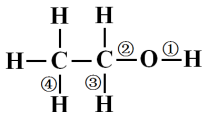





人教版 (2019)必修 第二册第三节 乙醇与乙酸完整版课件ppt
展开《乙醇和乙酸》教学设计
课题 | 《乙醇和乙酸》第一课时 | 单元 | 7 | 学科 | 化学 | 年级 | 高一 |
教材 分析 | 本节教学内容是人教版高中化学必修第二册第七章有机化合物第三节《乙乙醇和乙算》第一课时。高中化学新课程的一种重要理念是学习生活中的化学,学习有用的化学。有机物是人类赖以生存的重要物质基础,它们的开发利用大大的提 乙醇是我们的生活用品,是典型的烃的衍生物,从烃的衍生物的组成、结构和性质出发,让学生知道官能团对有机物性质的重要影响。让学生建立“(组成)结构决定性质,性质决定用途”的学习模式。本节内容安排在烃以后,是从烃到烃的衍生物过渡的重要环节,要注意从烃到烃的衍生物的结构变化,体会到官能团与性质的关系,对于学好本章书其它烃的衍生物的知识有着指导性的作用。另外乙醇在实际生活、工农业生产、科学研究中应用十分广泛,学好本节知识,也具有比较重要的理论意义和现实意义。 本节安排了“乙醇的物理性质”,“乙醇的分子结构”,“乙醇的化学性质”、“乙醇的用途”四部分内容。学生通过学习这部分知识,掌握乙醇的结构以及化学性质。 | ||||||
教学目标与核心素养 | 宏观辨识与微观探析:通过对结构的观察和探究,培养学生严谨细致的科学态度和质疑精神,通过对乙醇结构的学习,知道结构决定性质,根据乙醇的化学性质,认识到乙醇反应的原理。 证据推理与模型认知:通过乌璐性质和分子结构,构建结构决定性质的基本思想,认识乙醇的结构决定了其不同于烃类的性质。 科学探究与创新意识:从现象和结构出发,微观上探究有机物的结构特点,从而加深对乙醇的认识。从乙醇的燃烧、和钠的反应、催化氧化等反应,认识到乙醇独特的化学性质,从而知道官能团在决定物质性质反面具有重要作用。 科学精神与社会责任:激发学生透过现象探究本质的兴趣,尊重科学,认真学习科学的学习方法;通过参与探究过程,培养自身严谨的科学态度和辩证分析能力。为化学的发展尽自己的一份力量。 | ||||||
重点 难点 | 乙醇和钠的反应、乙醇的催化氧化 | ||||||
教学过程 |
教学环节 | 教师活动 | 学生活动 | 设计意图 | |||||||||||||||||||||
导入新课 | 中国有历史悠久的酒文化!你能想到那些关于酒的诗句吗??劝君更尽一杯酒,西出阳关无故人。醉酒当歌,人生几何?葡萄美酒夜光杯,欲饮琵琶马上催。 |
|
| |||||||||||||||||||||
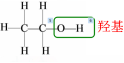
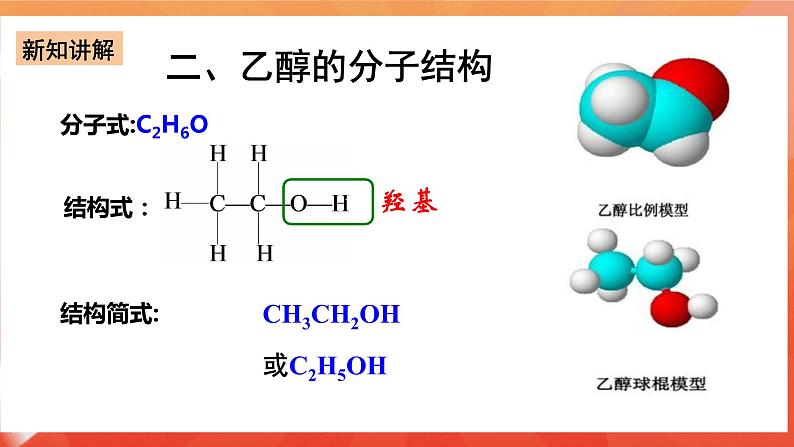
讲授新课 | 第三节乙乙醇和乙酸--第课时 一、乙醇的物理性质 颜色状态:无色透明的液体 气 味:特殊的香味 密 度:比水小,200C时的密度是0.7893g/cm3 挥 发 性:沸点78℃,易挥发 溶 解 性:和水可以以任意比互溶, 能够溶解多种有机物和无机物 工业制备无水乙醇:加生石灰(CaO)蒸馏 二、乙醇的分子结构 分子式:C2H6O
结构简式:CH3CH2OH或C2H5OH 我们把-OH原子团叫做羟基。乙醇可以看成是乙烷分子中的一个氢原子被羟基取代后的产物。我们把烃类物质侧链中的氢原子被羟基取代而成的化合物,叫做醇。 像这样,烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物成为烃的衍生物。比如前面学习的一氯甲烷、二氯甲烷、1,2-二溴乙烷都属于烃的衍生物。烃的衍生物和烃具有不同的性质 三、乙醇的化学性质 (一)1.乙醇与钠反应 【实验7-4】在盛有少量无水乙醇的试管中,加入一小块新切的用滤纸吸干表面煤油的钠,在试管口迅速塞上带尖嘴导管的橡胶塞。用小试管收集气体并检验其纯度,然后点燃(如图7-19),再将干燥的小烧杯罩在火焰上,待烧杯壁上出现液滴后,迅速倒转烧杯,向其中加入少量澄清石灰水,观察现象,并与前面做过的水与钠反应的实验现象进行比较。 实验现象:钠与乙醇反应,沉入乙醇底部,仍为块状,没有声音,放出气泡,反应缓慢;产生的气体可在空气中安静地燃烧,烧壁上有水滴生成,烧杯中加入澄清的石灰水不变浑浊。说明产生的气体是H2。 乙醇与钠反应方程式 2CH3CH2—O—H +2Na →2CH3CH2ONa +H2↑ 注意 ①断O-H键,发生置换反应、取代反应 ②氢原子活泼性:酸>水>醇 ③此反应可检验—OH的存在,用来计算分子中—OH的数目(2个—OH产生1个H2,故物质的量之比为2:1) 2.钠与水、与乙醇反应的现象比较
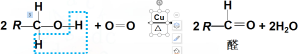
想一想:实验现象说明了什么问题? (1)钠浮在水面上,而沉在乙醇中? (2)乙醇与钠反应的性质是由它的什么决定的? (3)钠与乙醇的反应速率比钠与水的反应速率慢, 说明羟基上的H原子与水分子中H原子的活泼性? [说明] (1).水的密度>钠的密度>乙醇的密度; (2).羟基决定乙醇能和钠反应生成氢气; (3)..羟基中的H原子的活泼性:醇<水. 官能团决定有机物的性质,连接官能团的其它部分对性质也有所影响。 3.官能团 乙醇和乙烷性质的不同,从分子结构分析,是因为取代氢原子的羟基对乙醇性质产生了影响。 像这样决定有机化合物特性的原子或原子团叫做官能团。 常见官能团碳碳双键C=C、碳碳三键C≡C、羟基-OH、羧基-COOH、醛基-CHO、-Cl(卤素原子)等。 有机化学反应主要发生在官能团上,官能团对有机物的性质起决定作用。 (二)乙醇的氧化反应 1.乙醇在空气中燃烧 C2H5OH + 3 O2 现象:产生淡蓝色火焰,同时放出大量热 2.乙醇的催化氧化 【实验7-5】向试管中加入少量乙醇,取一根铜丝,下端绕成螺旋状,在酒精灯上灼烧后插入乙醇,反复几次,注意观察反应现象,小心地吻是观众液体产生的气味。 [实验现象] a.铜丝红色→黑色→红色反复变化 b.在试管口可以闻到刺激性气味 [思考]铜丝在此实验中起什么作用?催化剂 化学反应的方程式为: 2 CH3CH2OH + O2 醇催化氧化的条件:羟基碳原子上必须有氢。 反应历程:2 Cu + O2 CH3CH2OH + CuO CH3CHO结构中的 —CHO基团叫醛基,醛基由一个碳原子、一个氢原子及一个双键氧原子组成。 3.醇催化氧化机理:
醇发生催化氧化时去掉2个H原子。连接-OH官能团的碳原子上必须有H,才能发生催化氧化。 4.乙醇被氧化为乙酸 乙醇被氧化为乙醛。 2 CH3CH2OH + O2 乙醛接着可以被氧化为乙酸。 2 CH3CHO+ O2 也能被强氧化剂直接氧化为乙酸
橙红K2Cr2O7 溶液把乙醇氧化为乙酸,发生颜色变化 2K2Cr2O7(橙红色) + 3CH3CH2OH + 8H2SO4 → 2Cr2(SO4)3 (蓝绿色)+ 3CH3-COOH + 2K2SO4 + 11H2O 交警常用此原理检测司机是否酒后驾车。 5.乙醇发生反应的断键原理 乙醇分子中不同的化学键如图:发生不同化学反应时乙醇的断键位置。
(1)与活泼金属反应键①断裂; (2) CH3CH2OH 燃烧键全部断裂; (3)在Cu或Ag催化下和O2反应键①③断裂。 四、乙醇的用途 乙醇可以用作燃料,还是重要的化工原料和溶剂,用于生产医药、香料、化妆品、涂料等。医疗上用75%(体积分数)的乙醇溶液做消毒剂。 【课堂练习】 1.下列有关乙醇的物理性质的应用中不正确的是( ) A.熟语“酒香不怕巷子深”是由于乙醇容易挥发 B.用乙醇提取中药的有效成分是由于乙醇能够溶解很多种有机物和无机物 C.酒厂可以勾兑各种浓度的酒是由于乙醇能够以任意比溶解于水 D.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去 答案为:D 2、下列物质可使酸性高锰酸钾溶液褪色, 不能使溴水褪色的是( ) A、甲烷 B、乙烯 C、乙醇 D、乙烷 答案为:C 3.比较乙烷和乙醇的结构,下列说法错误的是( ) A.两个分子中碳原子都以单键相连 B.乙醇可以看成是乙烷分子中的一个氢原子被羟基取代后的产物 C.分子里都含有6个相同的氢原子 D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼 答案为:C 4、能用来检验酒精中是否含有水的试剂是( ) A、 CuSO4·5H2O B、CuSO4 C、 浓硫酸 D、金属钠 答案为:B 5.将等质量的铜片放在酒精灯上加热后,分别插入下列溶液中,放置片刻,铜片质量增加的是( ) A.硝酸 B.无水乙醇 C.石灰水 D.盐酸 答案为:C |
|
| |||||||||||||||||||||
课堂小结 | 一、乙醇的物理性质 液体、和水可以以任意比互溶, 能够溶解多种有机物和无机物。 工业制备无水乙醇:加生石灰(CaO)蒸馏 二、乙醇的分子结构 分子式:C2H6O;结构简式:CH3CH2OH或C2H5OH 三、乙醇的化学性质 1、乙醇与活泼金属反应(取代反应) 2、乙醇的氧化反应 ①燃烧 ②催化氧化 四、乙醇的用途 |
|
| |||||||||||||||||||||
板书 | 一、 乙醇的物理性质 二、乙醇的分子结构 三、乙醇的化学性质 1、乙醇与活泼金属反应(取代反应) 2、乙醇的氧化反应 四、乙醇的用途 |
|
|
人教版 (2019)必修 第二册第三节 乙醇与乙酸获奖课件ppt: 这是一份人教版 (2019)必修 第二册第三节 乙醇与乙酸获奖课件ppt,文件包含新人教版必修2化学73《乙醇和乙酸》第二课时课件pptx、73第三节乙醇和乙酸第二课时乙酸教案doc等2份课件配套教学资源,其中PPT共29页, 欢迎下载使用。
7.3乙醇和乙酸——2022-2023学年高中化学学业水平复习课件(人教版2019必修二): 这是一份7.3乙醇和乙酸——2022-2023学年高中化学学业水平复习课件(人教版2019必修二),共33页。PPT课件主要包含了乙醇的结构,HCCOH,乙醇的化学性质,乙醇的用途,乙酸的物理性质,乙酸的结构,乙酸的化学性质,乙酸的用途等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册实验活动9 乙醇、乙酸的主要性质备课课件ppt: 这是一份高中化学人教版 (2019)必修 第二册实验活动9 乙醇、乙酸的主要性质备课课件ppt,共21页。PPT课件主要包含了分子式,C2H4O2,结构简式,结构式,官能团,乙酸的结构,乙酸的物理性质,NaHCO3,澄清石灰水,探究乙酸的弱酸性等内容,欢迎下载使用。