





- 专题02 钠盐和铁盐 化学反应中的能量变化(知识串讲+专项练习)-2023-2024学年高一化学下学期期末考点大串讲(沪科版必修第二册) 试卷 1 次下载
- 专题03 化学反应速率(知识串讲+专项练习)-2023-2024学年高一化学下学期期末考点大串讲(沪科版必修第二册) 试卷 1 次下载
- 专题04 化学平衡(知识串讲+专项练习)-2023-2024学年高一化学下学期期末考点大串讲(沪科版必修第二册) 试卷 1 次下载
- 专题05 饱和烃和不饱和烃(知识串讲+专项练习)-2023-2024学年高一化学下学期期末考点大串讲(沪科版必修第二册) 试卷 1 次下载
- 专题06 乙醇、乙酸、营养物质(知识串讲+专项练习)-2023-2024学年高一化学下学期期末考点大串讲(沪科版必修第二册) 试卷 1 次下载
专题01 金属单质、金属氧化物、氢氧化物(知识串讲+专项练习)-2023-2024学年高一化学下学期期末考点大串讲(沪科版必修第二册)
展开专题01 金属单质、金属氧化物、金属氢氧化物
![]()

![]()
考点1 合金的概念及特性
1.合金的定义:合金是两种或两种以上的金属,或金属与非金属熔合在一起,所组成的具有金属特性的物质。合金属于混合物。
2.金属制成合金后,熔点一般低于成分金属,硬度一般高于成分金属。
【典例1】合金有许多特点,如Na-K合金在通常状况下为液体,而Na和K的单质在通常状况下均为固体。据此,试推测:生铁、纯铁、炭三种物质中,熔点最低的是
A.生铁 B.纯铁 C.炭 D.不能确定
【典例2】下列关于合金的说法,正确的是
①合金至少含两种金属 ②合金中元素以化合物形式存在 ③合金的熔点一般比其成分金属低 ④合金一定是混合物 ⑤铁锈是一种铁合金
A.①② B.②③⑤ C.③④ D.③
考点2 金属与水的反应
1.K、Ca、Na等金属和冷水作用,生成可溶性碱和H2。
2Na+2H2O=2NaOH+H2↑ Ca+2H2O = Ca(OH)2+H2↑
2.Mg和冷水反应缓慢,与沸水迅速反应,Al与冷水很难反应,与沸水能反应,生成不溶性碱和氢气。
Mg+2H2O Mg(OH)2+H2↑ 2Al+6H2O2Al(OH)3 +3H2↑
3.Zn、Fe、Sn、Pb和高温水蒸气反应,生成不溶性氧化物和H2。
3Fe+4H2O(g)Fe3O4+4H2↑ Zn+H2O(g)ZnO+H2↑
4.Cu、Hg、Ag、Pt、Au不与水反应。
【典例3】将金属钠放入盛有下列溶液的小烧杯中,既有气体,又有白色沉淀产生的是
①MgSO4溶液 ②Na2SO4稀溶液 ③饱和澄清石灰水 ④Ca(HCO3)2溶液
⑤CuSO4溶液 ⑥饱和NaOH溶液 ⑦FeCl3溶液
A.①④⑤⑦ B.②④⑤⑥ C.③④⑤⑦ D.①③④⑥
【典例4】如图铁与水反应的实验中,下列做法不正确的是
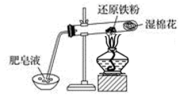
A.试管中的铁粉用绕成团的细铁丝代替
B.将试管底部的湿棉花移到试管口部
C.试管中的反应属于置换反应
D.点燃肥皂泡验证氢气的生成
考点3 金属的冶炼
1.电解法:电解是一种强有力的氧化还原手段,基本上所有的金属都能通过电解法制取,但电解法耗能最多,不经济,因此这个方法一般用在极活泼金属的冶炼。
如,电解法冶炼钠的化学方程式为2NaCl2Na+Cl2↑。
2.热还原法:制取活泼性一般的金属,如金属锌,铁,铜等,工业上一般采用还原剂把金属从它的氧化物还原出来。常用的还原剂有氢气,一氧化碳,焦炭和活泼金属等。
如,用CO还原氧化铁冶炼铁的化学方程式为Fe2O3+3COFe+3CO2。
3.热分解法:制取某些不活泼金属可以使用加热分解的方法,一般加热金属氧化物使其分解成金属单质和氧气。如加热氧化汞生成金属汞的化学方程式为2HgO2Hg+O2↑ 。
4.物理方法:黄金等不活泼金属以单质存在于自然界,可用某些物理方法使其与杂质分离提取。比如沙里淘金可以用在纯度较大的金矿石。如果矿石含金量较少,工业上还会使用一些化学方法,如利用氰化钠溶解含量较少金矿石,在用其它金属把黄金从溶液中置换出来。
【典例5】下列有关金属冶炼的说法中,不正确的是
A.在加热情况下利用氢气还原氧化铝得到金属铝
B.用电解熔融氯化镁的方法冶炼金属镁
C.用热还原法炼铁
D.直接加热氧化汞得到金属汞
【典例6】下列关于物质制备原理错误的是
A.工业制备金属钠:2NaCl2Na+Cl2↑
B.工业生产铁:Fe2O3+3COFe+3CO2
C.湿法炼铜:Fe+CuSO4===Cu+FeSO4
D.工业炼铝:2AlCl32Al+3Cl2↑
考点4 金属氧化物
1.钠的两种氧化物:
(1)Na2O是白色固体,电子式为![]() ,属于碱性氧化物。
,属于碱性氧化物。
(2)Na2O2是淡黄色固体,电子式为![]() ,既含离子键,又含共价键。Na2O2属于过氧化物,不属于碱性氧化物。
,既含离子键,又含共价键。Na2O2属于过氧化物,不属于碱性氧化物。
2.铁的三种氧化物
氧化物 | FeO | Fe2O3 | Fe3O4 |
颜色 | 黑色 | 红棕色 | 黑色 |
俗名 | / | 铁红 | 磁性氧化铁 |
铁的化合价 | +2 | +3 | +2,+3 |
【典例7】下列判断正确的是
A.可用水来确定某Na2O粉末中是否含有Na2O2
B.可用二氧化碳来确定某Na2O粉末中是否含有Na2O2
C.无法利用在空气中加热的方法,除去Na2O2中的Na2O
D.将足量的Na2O和Na2O2分别加到酚酞溶液中,最终溶液均为红色
【典例8】“秦砖汉瓦”是我国传统建筑文化的一个缩影。同是由黏土烧制的砖瓦,有的是黑色的,有的却是红色的,你猜测其中的原因可能
A.土壤中含有铁粉、二氧化锰等
B.黑砖瓦是煅烧过程中附着了炭黑,红砖则是添加了红色耐高温染料
C.土壤中含有的铜元素经过不同工艺煅烧,分别生成了黑色CuO和红色Cu
D.土壤中含有的铁元素经过不同工艺煅烧,分别生成了黑色Fe3O4或FeO和红色Fe2O3
考点5 铁的氢氧化物
氢氧化物 | Fe(OH)2 | Fe(OH)3 |
颜色和溶解性 | 白色固体,难溶于水 | 红褐色固体,难溶于水 |
稳定性 | 在空气中不稳定,易被氧化为Fe(OH)3 | 受热不稳定,易分解。 |
转化 | 方程式:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3。 现象:白色沉淀迅速转化为灰绿色,最后变为红褐色。 | |
【典例9】有关铁的氢氧化物的说法中,错误的是
A.Fe(OH)2是一种黑色固体,不稳定,在空气中易被氧化转变为红褐色固体
B.Fe(OH)2具有还原性,在空气中易被氧化为Fe(OH)3
C.Fe(OH)2、Fe(OH)3都具有不稳定性,受热能分解
D.Fe(OH)3胶体呈红褐色、透明,能产生丁达尔现象
【典例10】某同学在研究制取Fe(OH)2的方法时,设计了一个较好的方案:
①在一支大的硬质试管中加入2 mL ~ 3 mL煤油。②再缓缓加入4 mL ~ 5 mL FeSO4溶液。③往试管中投入绿豆大小的金属钠。
回答下列问题:
(1)写出实验时,发生反应的离子方程式 、 ,煤油的作用是 。
(2)实验结束后,如果用胶头滴管将煤油吸去,可观察到的现象是 。
![]()
一、选择题(共20题,每小题只有一个正确答案)
1.以下有关金属的说法正确的是
A.根据金属的活动性:Al>Fe,则两者与相同浓度盐酸反应时,Al更剧烈
B.活泼金属都可从不活泼金属的盐溶液置换出不活泼金属
C.由于Al、Fe都有+3价,由2Al+6HCl = 2AlCl3+3H2↑,可知:2Fe+6HCl = 2FeCl3+3H2↑
D.活泼金属可与氧气在常温下反应,不活泼金属在加热或高温下也可与O2反应
2.2.3 g金属钠在干燥的空气中与氧气反应,得到3.5 g固体,由此可判断其产物为
A.只有2.3 g金属钠 B.只有Na2O2
C.Na2O和Na2O2 D.无法确定
3.钢铁、铝合金、铜合金三种合金具有广泛的用途,下列说法正确的是
A.碳钢与生铁的主要成分相同,所以性能相同
B.铝合金可用于制造飞机、汽车的部件
C.铜合金具有优良的导电导热性能,但耐腐蚀能力较差
D.铝铁合金具有很高的熔点,能用于制造火箭外层材料。
4.某化学兴趣小组的同学,在学习了钠的性质后,用小刀切割了一小块钠,然后放入盛有空气的集气瓶中,充分燃烧后发现瓶壁上有黑色固体附着,下面是该兴趣小组的几点推测,你认为不合理的是
A.黑色固体是碳
B.钠在燃烧时只发生了一个反应
C.钠在金属活动性顺序中排在镁前面,所以钠能与二氧化碳反应(已知:2Mg+CO22MgO+C)
D.钠保存在煤油中,可能滤纸没有完全吸干煤油,煤油不完全燃烧产生碳
5.类比法是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观事实。下列有关类比推测的说法正确的是
A.已知Fe与S能直接化合生成FeS,推测Cu和S可直接化合生成CuS
B.已知Cu与Cl2能直接化合生成CuCl2,推测Fe与Cl2可直接化合生成FeCl2
C.已知Fe能与氧气、氯气反应,推测Zn能也与氧气、氯气反应
D.已知Al能与O2生成致密氧化膜保护金属,推测Fe也与O2生成氧化膜保护金属
6.等质量的两块金属钠,第一块在足量氧气中加热,第二块在氧气中(常温下)充分反应,则下列说法正确的是
A.第一块钠失去电子多
B.两块钠失去电子一样多
C.第二块钠的生成物质量最大
D.两块钠的生成物质量一样多
7.某合金的组成可表示为Al65Cu23Fe12,下列有关说法中正确的是
A.W的熔点比铝、铁、铜的都高
B.将一定量W投入少量的盐酸中,充分反应后溶液中一定有Fe2+
C.把W放入足量的盐酸中,仍有固体残留
D.把W在浓硝酸中因钝化而看不到明显现象
8.将铁钉投入热的浓硝酸中,一段时间后,下列说法错误的是
A.铁钉表面形成致密的氧化膜 B.溶液可能呈棕黄色
C.铁钉会溶解 D.产生红棕色的气体
9.工业上制备下列金属,采用的化学反应原理正确的是
A.镁:2MgO (熔融)Mg+O2↑ B.钙:CaO+CCa+CO↑
C.锰:3MnO2+4Al3Mn+2Al2O3 D.汞:HgSHg+S
10.对A、B、C三种金属活动性的实验研究过程如下:①取大小相等的三种金属片,分别放入 CuSO4溶液中,一段时间后,A、C表面出现红色物质,B表面没有现象。②A物质的盐溶液不能用C制品的容器盛放。则A、B、C三种金属的活动性顺序是
A.A>C>B B.C>A>B C.C>B>A D.A>B>C
11.将0.3 mol钠、0.1 mol铁分别加入到各盛有500 mL 0.2 mol·L-1稀硫酸的两个烧杯中,下列说法正确的是
A.两个烧杯中金属沉在液面下
B.两个烧杯中都没有金属剩余
C.两个烧杯中都有金属剩余
D.两个烧杯中产生氢气的质量相同
12.某实验小组通过下图所示实验探究Na2O2与水的反应:
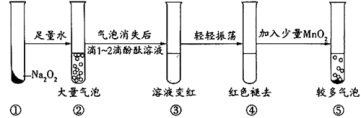
下列说法不正确的是
A.②中的大量气泡主要成分是氧气
B.③中溶液变红,说明有碱性物质生成
C.④中现象可能是由于溶液中含有强氧化性物质造成的
D.⑤中MnO2的主要作用是降低了水中氧气的溶解度
13.等物质的量的Na和Na2O2分别与足量的水反应,生成的气体在同温同压下的体积之比为
A.1∶1 B.1∶2 C.2∶1 D.2∶3
14.下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应方程式相同的是
A.Na和O2 B.NaOH和CO2
C.Na2O2和CO2 D.木炭(C)和O2
15.向Ca(HCO3)2饱和溶液中加入一定量的Na2O2(设溶液体积不变),推断正确的是
A.产生CO2气体 B.产生白色沉淀
C.所得溶液的碱性一定减弱 D.所得溶液中一定不含HCO3-
16.取Na2O、Na2O2、Na2CO3的固体混合物做了以下实验,以下记录不符合事实的是
A.加入水中,产生无色气体
B.加入酚酞溶液中,溶液先变红后褪色
C.在干空气中加热到400℃,质量减少
D.与SO2反应后,检测到有Na2SO4生成
17.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是


A.①②③ B.①②④ C.①②③④ D.②③④
18.将铝条插入NaOH溶液中,开始没有H2生成的原因是
A.铝与NaOH溶液不反应
B.铝条表面钝化生成Al2O3
C.铝条不纯含有杂质Mg
D.NaOH溶液中含有NaAlO2
19.足量的铝粉分别与下列4种溶液充分反应,放出氢气最多的是
A.1 L 1 mol/L H2SO4溶液 B.1 L 4 mol/L HNO3溶液
C.1 L 1 mol/L HCl溶液 D.1 L 1 mol/L NaOH溶液
20.某溶液中有NH4+、Fe2+、Fe3+、Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中离子的物质的量几乎不变的是
A.NH4+ B.Fe2+ C.Fe3+ D.Al3+
三、非选择题
21.现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下。回答下列问题(已知:Na2O2可以与H2O、CO2反应):
(1)装置Ⅳ中盛放的药品是________,其作用是_______________________________。
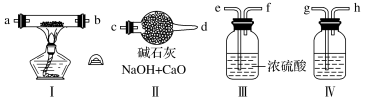
(2)若规定气体的气流方向从左到右,则组合实验装置时各件仪器的正确连接顺序为(按从左到右顺序写明仪器的编号Ⅰ、Ⅱ……)____________,各仪器接口的标号字母顺序是:空气进入________,________接________,________接________,________接________(用字母表示)。
(3)装置Ⅱ的作用_________________________________________。
(4)操作中通空气和加热的顺序为_______________________________。
22.如图,在玻璃管中放入还原铁粉和石棉绒(石棉绒不参与化学反应,是铁粉的载体)的混合物,加热并通入水蒸气,用试管收集产生的经干燥的气体,并靠近酒精灯的火焰。
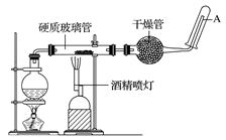
(1)证明反应发生的方法是____________________________________,有关反应的化学方程式是________________________________________________________。
(2)干燥管内可装入的试剂是_________,其作用是__________。干燥管还可用_____(装置)代替。
(3)实验开始时应先点燃__________,实验结束时,应先熄灭__________。
23.某同学在探究铁生锈的条件时,将铁钉浸没在食盐水中,一段时间后,发现试管底部出现了黑色粉末。该同学对此黑色粉末的组成做了如下几种猜想:①Fe;②Fe2O3;③Fe3O4;④FeCl3。请完成下列问题。
(1)你认为该同学的上述猜想中,不做实验就可排除理由是 ,理由是 。你认为黑色粉末还可能是 ,理由是 。
(2)该同学将黑色粉末干燥后,用磁铁靠近,发现粉末能被磁铁吸引,于是得出结论:黑色粉末一定是铁粉。你认为该同学的结论对吗? 理由是 。
24.取1.39 g纯净的绿矾[FeSO4·7H2O]和一枚小铁钉装入试管,加入已除增溶解氧的蒸馏水配成5 mL溶液,再向试管中滴入3 mL苯。取吸净煤油后的钠切下绿豆大小一粒,放入试管内,并立即用一圆形蜡纸片(与试管内径一样大)盖在苯的液面上,待钠粒消失后,立即用胶塞塞住试管(把蜡纸压在塞子下)。
(1)向试管中加入钠粒后看到的现象是
该实验的目的是( )
A.试验钠与水及苯的反应情况 B.试验使绿矾溶液不变质
C.制取保存时间较长的氢氧化亚铁 D.制取较纯净的H2
(2)实验中使用苯的作用是
可以代替苯的试剂是( )
A.四氯化碳 B.酒精 C.汽油 D.液氨
(3)使蒸馏水除去氧的方法是( )
A.向蒸馏水中加脱氧剂镁
B.把蒸馏水煮沸后放在烧杯中冷却
C.向蒸馏水中吹入氮气驱出氧气
D.把蒸馏水加热煮沸后密封冷却
(4)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]称为莫尔盐,其中的亚铁离子较稳定。配制5 mL亚铁离子浓度与上述实验相同的溶液,应称取莫尔盐 g。用莫尔盐代替绿矾进行上述实验,优点是 ,缺点是 。
专题06 乙醇、乙酸、营养物质(知识串讲+专项练习)-2023-2024学年高一化学下学期期末考点大串讲(沪科版必修第二册): 这是一份专题06 乙醇、乙酸、营养物质(知识串讲+专项练习)-2023-2024学年高一化学下学期期末考点大串讲(沪科版必修第二册),文件包含专题06乙醇乙酸营养物质知识串讲+专项练习教师版-高一化学下学期期末考点大串讲沪科版必修第二册docx、专题06乙醇乙酸营养物质知识串讲+专项练习学生版-高一化学下学期期末考点大串讲沪科版必修第二册docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
专题05 饱和烃和不饱和烃(知识串讲+专项练习)-2023-2024学年高一化学下学期期末考点大串讲(沪科版必修第二册): 这是一份专题05 饱和烃和不饱和烃(知识串讲+专项练习)-2023-2024学年高一化学下学期期末考点大串讲(沪科版必修第二册),文件包含专题05饱和烃和不饱和烃知识串讲+专项练习教师版-高一化学下学期期末考点大串讲沪科版必修第二册docx、专题05饱和烃和不饱和烃知识串讲+专项练习学生版-高一化学下学期期末考点大串讲沪科版必修第二册docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。
专题04 化学平衡(知识串讲+专项练习)-2023-2024学年高一化学下学期期末考点大串讲(沪科版必修第二册): 这是一份专题04 化学平衡(知识串讲+专项练习)-2023-2024学年高一化学下学期期末考点大串讲(沪科版必修第二册),文件包含专题04化学平衡知识串讲+专项练习教师版-高一化学下学期期末考点大串讲沪科版必修第二册docx、专题04化学平衡知识串讲+专项练习学生版-高一化学下学期期末考点大串讲沪科版必修第二册docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。













