


【单元练习】人教版化学九年级上册--第三单元 物质构成的奥秘 同步训练(含解析)
展开![]() 第三单元 物质构成的奥秘 同步训练-2022-2023学年九年级上册化学人教版
第三单元 物质构成的奥秘 同步训练-2022-2023学年九年级上册化学人教版
一、单选题
1.Fe、Fe2+、Fe3+三种粒子中肯定不同的是( )
A.相对原子质量
B.质子数
C.电子数
D.中子数
2.下列说法正确的是
A.决定原子化学牲质的是最外层电子数 B.原子是自然界中最小的微粒
C.原子一定都是由质子、中子、电子构成 D.拉瓦锡提出了元素周期表
3.如图是元素周期表的一部分信息,下列说法不正确的是
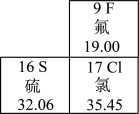
A.氟元素的相对原子质量为19.00
B.硫原子的核电荷数是16
C.三种元素都属于非金属元素
D.三种元素的单质在常温时均为气体
4.物质是由微观粒子构成的。构成下列物质的微粒种类与构成干冰的微粒种类相同的是
A.铜 B.氨气 C.金刚石 D.硫酸铜
5.下列有关分子和原子的说法不正确的是
A.分子不同,性质不同 B.保持汞的化学性质的最小粒子是汞原子
C.分子和原子都在不断运动 D.分子可分,原子不可分
6.为了纪念门捷列夫,人们将在1955年发现的一种新元素命名为“钔”,有关钔的说法错误的是( )
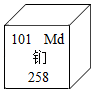
A.属于金属元素 B.元素符号为Md
C.中子数为157 D.相对原子质量为258g
7.下列叙述正确的是
A.保持水化学性质的粒子是氢原子和氧原子
B.分子在不停运动,原子不运动
C.原子的最外层电子数决定元素的种类
D.原子是化学变化中的最小粒子
8.归纳和分类是化学学习中重要的方法,下列归纳和分类正确的是:
A.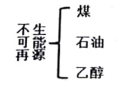 能源类别 B.
能源类别 B.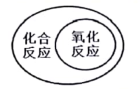 化学反应关系
化学反应关系
C.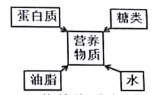 营养物质类别 D.
营养物质类别 D.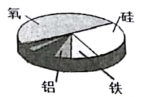 地壳元素含量
地壳元素含量
9.下列说法错误的是
A.原子核由质子、中子构成
B.花香四溢主要是分子之间的间隔
C.保持水化学性质的微粒是水分子
D.化学反应前后原子的种类不会改变
10.春天里那个百花香,能闻到花香的原因是
A.分子在不断运动 B.分子间有间隔
C.分子的质量很小 D.分子由原子构成
11.一种有趣的钟表式元素周期表如图所示,关于时针所对应的元素说法中正确的是( )
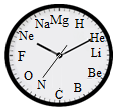
A.12:00 对应的元素为非金属元素
B.10:00 对应的元素易形成化合物
C.9:00 对应元素的离子符号为 F+
D.该钟表的整点时间与该元素的质子数相等
12.决定元素种类的是( )
A.核电荷数 B.中子数 C.相对原子质量 D.核外电子数
13.每一个结论背后,都有鲜活的例子在旁边证明,就像每一次懒惰都有失败来买单。下列概念或说法正确的一项是
A.由同种分子构成的物质叫纯净物 B.质子数相同的原子一定是同种元素的原子
C.最外层电子数为8的微粒一定是稀有气体原子 D.混合物一定由不同种元素组成
14.科学家研制出一种新型催化剂,用于去除装修残留甲醛(化学式为CH2O),该反应过程的微观示意图如图。下列说法正确的是
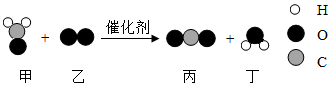
A.物质甲醛由碳原子和水分子构成
B.物质乙中氧元素的化合价为-2价
C.该反应消耗物质甲和生成物质丁的分子个数比为1:1
D.该反应前后原子种类和数目均发生改变
二、填空题
15.将下列物质按照要求进行分类填写序号:①冰水混合物②空气③液氧④稀有气体⑤澄清的石灰水⑥二氧化锰⑦实验室加热高锰酸钾后剩余的固体:
以上物质属于混合物的是:_________;属于原子构成的是:__________。
16.微观和符号之间建立联系是化学学科的特点。
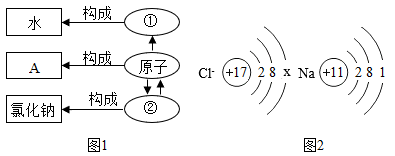
(1)下列微粒模型中可用来表示①处应填的微粒的是______(填标号)。
A. B.
B. C.
C.![]() D.
D.![]()
(2)图1中②表示的是______,写出一种符合要求的A物质名称______。
(3)图2是氯、钠两种元素的微粒结构示意图。
①图2中氯离子的结构示意图中x的数值是______。
②图2中钠原子的质子数为______,反应中易______(填得到或失去)电子。
③请将图中钠元素在元素周期表中的信息补齐______。

17.请选用“质子”“中子”“电子”“原子核”“分子”“原子”“元素”填空。
(1)带正电荷的粒子有:___________;不显电性的粒子有:___________;
(2)能直接构成纯净物的粒子有:___________;
(3)决定相对原子质量大小的粒子是___________;
(4)氦气是由氦___________构成,保持二氧化碳化学性质的最小微粒是二氧化碳___________。
(5)氧气(O2)和臭氧(O3)的___________不同,所以化学性质不同。
(6)水和过氧化氢是由相同___________组成的物质。
(7)Cl-失去一个电子后转化为氯___________。
三、实验题
18.某兴趣小组做如下实验探究分子的运动,请回答实验中的有关问题。
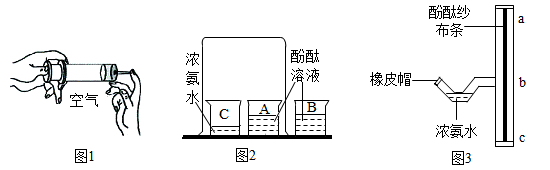
(查阅资料)浓氨水极易挥发,产生刺激性气味的氨气,氨气密度小于空气。
(1)如图1所示,注射器内封闭一段空气,右手堵住注射器口,左手向内推,发现注射器内气体被压缩了,说明______。
(2)如图2所示,烧杯C装入浓氨水, A、B盛放滴有无色酚酞试液的蒸馏水,一段时间后观察到的实验现象是______,这说明分子______。
(3)图3实验中用______(填仪器名称)吸取少许浓氨水,将其滴入T形三通管的细弯管处,然后用橡皮帽封闭管口。一会儿,观察到______(填“ba”或“bc”)段纱布条先变成红色。
(4)图3实验与图2实验对比,改进后的优点是______(写一点即可)。
四、计算题
19.计算:
(1)已知钠的相对原子质量为23,每个钠原子有11个质子,则每个钠原子的核外电子数为__________;每个钠原子核内中子数为____________。
(2)某原子的相对原子质量就是等于该原子的实际质量比去一种碳原子质量的1/12,已知一种碳原子的质量为1.993×10-26kg,一个铁原子的质量为9.288×10-26kg,请你求出铁的相对原子质量为多少.?(精确到0.1)
20.已知碳-12原子的质量为X千克,若某原子的质量为Y千克,则该原子的相对原子质量为______(写出计算表达式)。
五、综合应用题
21.
(1)以下物质中:①氮气 ②水 ③空气 ④食盐水 ⑤五氧化二磷 ⑥铁,其中(以下均填序号)属于混合物的是________________,属于纯净物的是________________。
(2)将一种无色无味的液体A装入试管,用带火星的木条试验,无现象,而向其中加入少量黑色粉末B后,迅速产生气泡,生成了使带火星的木条复燃的气体C,使金属E红热并伸入盛有气体C中,在C瓶底有少量液体D,金属E剧烈燃烧,火星四射,生成黑色固体F。
①写出它们的名称 A:_________ B:_________E:_________F:_________ 。
②黑色粉末B在A的反应中起__________作用,是这个反应的_________剂。
③写出金属E在C气体中燃烧的反应的表达式_____________________。
④写出A中加入B后的反应的表达式__________________ 。
(3)请认真回忆物质与其构成粒子之间的关系,回答下列问题:
①金属铁是由_________构成的,氯化钠是由_________构成的,二氧化碳是由_________构成的。(填“原子”、“分子”或“离子”)
②原子得到或失去电子后形成离子.某粒子的结构示意图为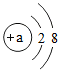 。
。
Ⅰ当a=" _________" 时,该粒子是原子,该原子位于元素周期表中第 _________ 周期。
Ⅱ当a=8时,该粒子是 _________ (填“原子”、“阳离子”或“阴离子”)。
参考答案:
1.C
【分析】Fe、Fe2+、Fe3+三种粒子都是铁元素形成的不同微粒,则它们的质子数相同,它们的电子数不同,化学性质不同。
【详解】A、核电荷数相同,中子数相同,相对原子质量也相同,故A正确;
B、Fe、Fe2+、Fe3+三种粒子是同种元素形成的微粒,则质子数相同,故B正确;
C、金属原子失去电子变为金属阳离子,且Fe2+、Fe3+带电荷不同,原子变为离子失去的电子数不同,则三种粒子的核外电子数不同,故C不正确;
D、Fe、Fe2+、Fe3+三种粒子电子数不同,中子数相同,故D正确。故选C。
【点睛】在原子中,相对原子质量≈质子数+中子数
2.A
【详解】A、决定原子化学牲质的是最外层电子数,最外层电子数小于4容易失去电子,大于4容易得到电子,最外层电子排满不易得失电子。正确;
B、原子是化学变化中最小的微粒,不限于化学变化,原子还可以拆分成原子核和电子。错误;
C、原子中一定有质子和电子,但不一定有中子,如氢原子中没有中子。错误;
D、门捷列夫发现了元素周期律并编制了元素周期表,错误;
故选A。
3.D
【详解】A、根据元素周期表中的单元格信息可知,元素名称下面的数字表示相对原子质量,该元素的相对原子质量为19.00,故A不符合题意;
B、根据元素周期表中的单元格信息可知,左上角的数字表示原子序数,该元素的原子序数为16,核电荷数等于原子序数,故B不符合题意;
C、氟、硫、氯三种元素都不带“钅”字旁,属于非金属元素,故C不符合题意;
D、常温下,硫单质是固体,故D符合题意。
故选D。
4.B
【分析】干冰是指固体二氧化碳,二氧化碳是由分子构成的物质。
【详解】A、铜是由铜原子直接构成的物质,与构成干冰的微粒种类不相同;
B、氨气是由氨气分子构成的物质,与构成干冰的微粒种类相同;
C、金刚石是由碳原子直接构成的物质,与构成干冰的微粒种类不相同;
D、硫酸铜是由硫酸根、铜离子构成的物质,与构成干冰的微粒种类不相同;
答案:B。
5.D
【详解】A、分子相同,性质相同,分子不同,性质各异。A正确。
B、汞由汞原子构成,所以保持汞的化学性质的最小粒子是汞原子。B正确。
C 、一切构成物质的粒子都在不断运动,所以分子和原子都在不断运动。C正确。
D、在化学变化中分子可分,原子不可分。D错。
综上所述:选择D。
6.D
【详解】A、根据元素周期表中的一格可知,中间的汉字表示元素名称,该元素的名称是钔,带“钅”字旁,属于金属元素,故选项说法正确;
B、根据元素周期表中的一格可知,字母表示该元素的元素符号,元素符号为Md,故选项说法正确;
C、根据元素周期表中的一格可知,左上角的数字为101,表示原子序数为101;根据原子中原子序数=核电荷数=质子数,则该元素的原子核内质子数为101;汉字下面的数字表示相对原子质量,该元素的相对原子质量为258;相对原子质量=质子数+中子数,则中子数=258﹣101=157,故选项说法正确;
D、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为258,相对原子质量单位是“1”,不是“克”,故选项说法错误。
故选D。
7.D
【详解】A、由分子构成的物质,保持物质化学性质的最小粒子是分子,水是由水分子构成的,保持水化学性质的粒子是水分子,不符合题意;
B、分子在不停运动,原子也不停运动,不符合题意;
C、质子数决定元素的种类,最外层电子数决定元素的化学性质,不符合题意;
D、原子是化学反应中的最小微粒,符合题意。故选D。
8.C
【详解】A、煤、石油、天然气都属于不可再生能源,乙醇可再生,故选项错误;
B、化合反应和氧化反应不是包含关系,是交叉关系,故选项错误;
C、人体的六大营养物质是:水、无机盐、蛋白质、脂肪、糖类和维生素,故选项正确;
D、地壳中元素的质量分数,由高到低的前五种元素分别是:氧、硅、铝、铁、钙,故选项错误。
故选C。
9.B
【详解】A、原子核由质子、中子构成,正确;
B、花香四溢主要是分子在不断的运动,错误;
C、保持水化学性质的微粒是水分子,正确;
D、化学反应前后原子的种类不会改变,正确。故选B。
10.A
【详解】春天里那个百花香,能闻到花香的原因是分子在不断运动,引起花香的分子四处扩散。
故选A。
11.D
【详解】A.12:00对应的元素为镁元素,汉字偏旁是“金”的属于金属元素,此选项错误;
B.10:00对应的元素是氖元素,氖元素属于稀有气体元素,化学性质稳定,不易形成化合物,此选项错误;
C.9:00对应元素是氟元素,氟原子的最外层有7个电子,在化学反应中易得到1个电子而形成带有一个单位负电荷的氟离子,离子符号为F﹣,此选项错误;
D.由图示可知,该钟表的整点时间与原子结构中的质子数相等。此选项正确。故选D。
12.A
【详解】元素是质子数(即核电荷数)相同的一类原子的总称。故选A。
13.B
【详解】A、纯净物不一定由同种分子构成,由同种原子构成的物质也是纯净物,比如金属,选项错误;
B、元素是质子数相同的一类原子的总称,选项正确;
C、最外层电子数为8的微粒可能是离子,选项错误;
D、混合物由不同物质组成,由不同元素组成的物质可能是纯净物,选项错误。故本题选B。
14.C
【分析】本题考查学生对微观示意图的认识。
【详解】A、甲醛由甲醛分子构成;错误;
B、乙为氧气,属于单质,单质的元素化合价为零;错误;
C、此反应的完整化学方程式为:![]() ;则甲和丁的分子个数比为1:1;正确;
;则甲和丁的分子个数比为1:1;正确;
D、化学反应前后原子种类、数目不变;错误。
故选C。
【点睛】利用化学方程式判断反应中各物质微粒的个数比。
15. ②④⑤⑦ ⑦
【详解】由同种物质组成的是纯净物,由不同种物质组成的是混合物。①冰、水是同种物质,故冰水混合物属于纯净物;②空气由不同种物质组成,属于混合物;③液氧由同种物质组成,属于纯净物;④稀有气体由不同种物质组成,属于混合物;⑤澄清的石灰水由不同种物质组成,属于混合物;⑥二氧化锰由同种物质组成,属于纯净物;⑦实验室加热高锰酸钾后剩余的固体含有锰酸钾、二氧化锰,属于混合物。故以上物质属于混合物的是②④⑤⑦。金属单质、固体非金属单质、稀有气体都是由原子构成的,故属于原子构成的是④。
16.(1)C
(2) 离子 铜(合理即可)
(3) 8 11 失去 
【详解】(1)水是由水分子构成的,因此图甲中①处应填的微粒的是水分子,每个水分子是由两个氢原子与一个氧原子构成的,图示为C,故填:C;
(2)氯化钠是由钠离子与氯离子构成的,因此图甲中②表示的是离子;金属单质、稀有气体单质以及某些固态非金属单质是由原子直接构成的,如铜、氦气、金刚石等,故填:离子;铜(合理即可);
(3)①氯原子的最外层有7个电子,在化学反应中易得到1个电子而形成氯离子,氯离子的最外层有8个电子,即x=8,故填:8;
②由钠原子结构示意图可知,钠原子的质子数为11,最外层有1个电子,小于4,在化学反应中易失去最外层电子,形成阳离子,故填:11;失去;
③根据元素周期表的信息可知,左上角的数字表示原子序数,钠的原子序数为11,右上角的字母表示元素符号,钠的元素符号为Na,具体如图所示 ,故填:
,故填: 。
。
17. 原子核、质子 中子、分子、原子 分子、原子 质子、中子 原子 分子 分子 元素 原子
【详解】(1)带正电荷的粒子有:原子核、质子;不显电性的粒子有:中子、分子、原子;
(2)能直接构成纯净物的粒子有:分子、原子;
(3)决定相对原子质量大小的粒子是:质子、中子;
(4)氦气是稀有气体是由原子构成的,因此氦气是由氦原子构成,分子是保持物质化学性质的最小微粒,因此保持二氧化碳化学性质的最小微粒是二氧化碳分子。
(5)氧气(O2)和臭氧(O3)的分子不同,所以化学性质不同。
(6)水和过氧化氢都含有氢元素和氧元素,是由相同元素组成的物质。
(7)Cl-是氯原子得到了一个电子后形成的粒子,带一个单位的负电荷,失去一个电子后转化为氯原子。
18.(1)分子间存在间隔
(2) 烧杯A中溶液变红,烧杯B溶液不变红 在不断地运动
(3) 胶头滴管 ba
(4)节约药品、不污染空气(合理即可)
【分析】(1)
注射器内气体能被压缩,说明分子间存在间隔,故填:分子间存在间隔;
(2)
该实验中观察到的实验现象是:烧杯A中溶液变红,烧杯B溶液不变红;烧杯A中溶液变红是因为烧杯C中的浓氨水具有挥发性,氨分子运动到烧杯A中造成的,所以该现象说明分子在不断地运动的,故填:烧杯A中溶液变红,烧杯B溶液不变红;在不断地运动;
(3)
吸取少量液体药品用到的仪器是胶头滴管;氨分子向右运动接触到酚酞纱布条,由于氨气的密度比空气的小,氨气先向上运动,所以观察到ba段先变红,故填:胶头滴管;ba;
(4)
改进后的实验属于微型实验,且在密闭体系中进行,具有节约药品、污染小、现象明显等优点,故填:节约药品、不污染空气(合理即可)。
19.(1) 11 12
(2)铁的相对原子质量为: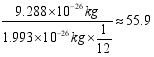
答:铁的相对原子质量为55.9
【解析】(1)
在原子中,质子数=核外电子数=11;
中子数≈相对原子质量-质子数=23-11=12;
(2)
见答案。
20.![]()
【详解】某原子的相对原子质量=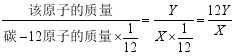 。
。
21.(1) ③④ ①②⑤⑥
(2) 过氧化氢 二氧化锰 铁 四氧化三铁 催化 催化 ![]()
![]()
(3) 原子 离子 分子 10 二/2 阴离子
【详解】(1)由两种或两种以上物质组成的物质叫混合物;由一种物质组成的物质叫纯净物,氮气(N2)、水(H2O)、五氧化二磷(P2O5)都能写出化学式,由一种物质组成,是纯净物,空气、食盐水由多种物质混合组成,是混合物,故填:③④;①②⑤⑥;
(2)①、将一种无色无味的液体A装入试管,用带火星的木条试验,无现象,而向其中加入少量黑色粉末B后,迅速产生气泡,生成了使带火星的木条复燃的气体C,说明A是过氧化氢溶液,B为二氧化锰,C是氧气;使金属E红热并伸入盛有气体C中,在C瓶底有少量液体D,金属E剧烈燃烧,火星四射,生成黑色固体F.说明E是铁,D是水,F是四氧化三铁,故填:过氧化氢;二氧化锰;铁;四氧化三铁;
②、能改变其他物质的反应速率,而本身的质量和化学性质在反应前后不变的物质叫催化剂。二氧化锰是过氧化氢分解的催化剂,故填:催化;催化;
③、铁在氧气中燃烧的表达式为![]() ,过氧化氢分解的表达式为
,过氧化氢分解的表达式为![]() ,故填:
,故填:![]() ;
;![]() ;
;
(3)①、金属铁是由铁原子构成的,氯化钠是由钠离子和氯离子构成的,二氧化碳是由二氧化碳分子构成的,故填:原子;离子;分子 ;
②Ⅰ、同一原子中,质子数=核外电子数=核电荷数,a=2+8=10时该粒子表示原子 ,元素的周期数等于电子层数,所以该元素的原子在第二周期;
Ⅱ、a=8时,质子数小于电子数,带负电荷,是阴离子,故填:阴离子。









