


所属成套资源:【同步教案】人教版化学九年级上册-精优教案
化学九年级上册课题2 原子的结构优秀第1课时同步训练题
展开
这是一份化学九年级上册课题2 原子的结构优秀第1课时同步训练题,共6页。
第三单元 物质构成的奥秘课题2 原子的结构第1课时 原子的构成与核外电子的排布【学习目标】(1)了解原子是由质子、中子、电子构成的。(2)知道原子核外电子是分层排布的。(3)了解原子结构示意图的含义;了解原子最外层电子数与原子种类的关系。(4)初步体会物质构成的奥秘。【学习重点】理解原子结构、各个粒子之间的数量关系及原子结构示意图。【学习难点】掌握原子核外的电子排布特点及规律。![]()
![]() 【教学流程】
【教学流程】 ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 【教学设计】一、创设情境可能同学们都不熟悉原子,但是提起乒乓球大家肯定都不陌生,如果将一个原子跟一个乒乓球相比,就相当于将一个乒乓球跟地球相比。原子之间能够结合成分子的奥秘,正是人们在研究这小小的原子的结构时被逐步揭示出来的。接下来就让我们一起来学习一下神奇的原子结构。二、新课学习知识点1 原子的构成阅读课本P53,观察图3-9,你能发现什么问题?
【教学设计】一、创设情境可能同学们都不熟悉原子,但是提起乒乓球大家肯定都不陌生,如果将一个原子跟一个乒乓球相比,就相当于将一个乒乓球跟地球相比。原子之间能够结合成分子的奥秘,正是人们在研究这小小的原子的结构时被逐步揭示出来的。接下来就让我们一起来学习一下神奇的原子结构。二、新课学习知识点1 原子的构成阅读课本P53,观察图3-9,你能发现什么问题?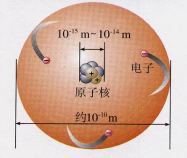 1.原子不是一个实心球体;2.原子是由居于原子中心的原子核和核外电子构成的;3.原子核带正电荷,电子带负电荷。【讲解】科学实验证明,原子是由居于原子中心的原子核与核外电子构成的。原子核是由质子和中子构成的。每个质子带1个单位的正电荷,每个电子带1个单位的负电荷,中子不带电。质子、中子和电子的质量都很小,观察下表你能发现什么?
1.原子不是一个实心球体;2.原子是由居于原子中心的原子核和核外电子构成的;3.原子核带正电荷,电子带负电荷。【讲解】科学实验证明,原子是由居于原子中心的原子核与核外电子构成的。原子核是由质子和中子构成的。每个质子带1个单位的正电荷,每个电子带1个单位的负电荷,中子不带电。质子、中子和电子的质量都很小,观察下表你能发现什么?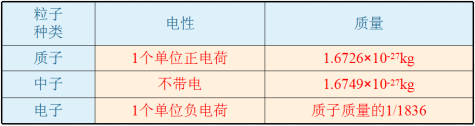 【回答】1.一个质子和一个电子所带的电量相等,电性相反。2.一个质子和一个中子的质量约相等。3.原子的质量主要集中在原子核上。【提问】观察教材P53表3-1,你有什么发现?
【回答】1.一个质子和一个电子所带的电量相等,电性相反。2.一个质子和一个中子的质量约相等。3.原子的质量主要集中在原子核上。【提问】观察教材P53表3-1,你有什么发现?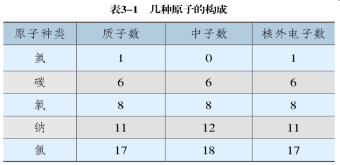 【回答】1.质子数=核外电子数2.质子数不一定等于中子数。3.不是所有的原子都含中子(氢原子没有中子)。4.原子种类不同,质子数不同。【思考】铁、铜等金属都是原子直接构成的,原子中存在带电荷的粒子(质子和电子),那么原子是否显电性?用手接触铁、铜等金属会触电吗?原子核内质子所带电荷与核外电子所带电荷的数量相等,电性相反,因此原子不显电性(即电中性)。可见,原子核所带的正电荷书(核电荷数)就等于核内的质子数,也等于核外电子的数目。知识点2 原子核外电子的排布1.核外电子的分层排布【思考】原子核居于原子中心,它在原子中的体积如何?占很大一部分吗?【讲解】原子核居于原子中心,但比原子小得多,原子核的半径只有原子半径的几万分之一,如果把原子比作一个庞大的体育场,而原子核只相当于一只蚂蚁。因此,原子里有很大的空间,电子就在这个空间里作高速运动。通过前面的学习,我们已经知道,原子是化学变化中的最小微粒。原子是由原子核和核外电子构成的。电子的质量非常小,在核外作高速运动。如核电荷数为1的氢原子,原子核内有一个带正电荷的质子,核外有一个电子。实际上,电子在核外不是在一个平面上运动,而是在空间运动。为了表示方便,把它示意为在一个平面上运动。氢原子核外仅有一个电子,比较简单。在含有多个电子的原子里,电子在核外是如何排布的呢?【提问】观察电子分层排布示意图,你有什么发现?
【回答】1.质子数=核外电子数2.质子数不一定等于中子数。3.不是所有的原子都含中子(氢原子没有中子)。4.原子种类不同,质子数不同。【思考】铁、铜等金属都是原子直接构成的,原子中存在带电荷的粒子(质子和电子),那么原子是否显电性?用手接触铁、铜等金属会触电吗?原子核内质子所带电荷与核外电子所带电荷的数量相等,电性相反,因此原子不显电性(即电中性)。可见,原子核所带的正电荷书(核电荷数)就等于核内的质子数,也等于核外电子的数目。知识点2 原子核外电子的排布1.核外电子的分层排布【思考】原子核居于原子中心,它在原子中的体积如何?占很大一部分吗?【讲解】原子核居于原子中心,但比原子小得多,原子核的半径只有原子半径的几万分之一,如果把原子比作一个庞大的体育场,而原子核只相当于一只蚂蚁。因此,原子里有很大的空间,电子就在这个空间里作高速运动。通过前面的学习,我们已经知道,原子是化学变化中的最小微粒。原子是由原子核和核外电子构成的。电子的质量非常小,在核外作高速运动。如核电荷数为1的氢原子,原子核内有一个带正电荷的质子,核外有一个电子。实际上,电子在核外不是在一个平面上运动,而是在空间运动。为了表示方便,把它示意为在一个平面上运动。氢原子核外仅有一个电子,比较简单。在含有多个电子的原子里,电子在核外是如何排布的呢?【提问】观察电子分层排布示意图,你有什么发现?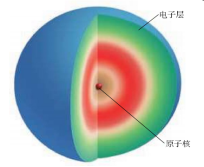 【回答】离核最近的电子层为第一层,次之为第二层,依次类推为三、四、五、六、七层,离核最远的也叫最外层。核外电子的这种分层运动又叫做分层排布。能量低的电子在离核近的区域运动,能量高的电子在离核远的区域运动。2.原子结构示意图由于电子的能量不同,它们运动的区域也不同。知道了原子的核电荷数及核外电子排布,可以画出原子结构示意图。
【回答】离核最近的电子层为第一层,次之为第二层,依次类推为三、四、五、六、七层,离核最远的也叫最外层。核外电子的这种分层运动又叫做分层排布。能量低的电子在离核近的区域运动,能量高的电子在离核远的区域运动。2.原子结构示意图由于电子的能量不同,它们运动的区域也不同。知道了原子的核电荷数及核外电子排布,可以画出原子结构示意图。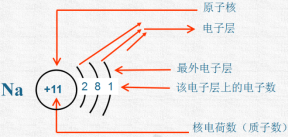 观察课本P54图3-12部分原子的结构示意图,你能发现什么规律?核外电子排布规律:(1)第一层最多排2个,第二层最多排8个,最外层电子数不超过8个,(第一层为最外层时,不超过2个)。(2)核外电子总是先排在离核较近的电子层,排满第一层,再依次排第二层,第三层。【总结】原子种类与原子结构的关系
观察课本P54图3-12部分原子的结构示意图,你能发现什么规律?核外电子排布规律:(1)第一层最多排2个,第二层最多排8个,最外层电子数不超过8个,(第一层为最外层时,不超过2个)。(2)核外电子总是先排在离核较近的电子层,排满第一层,再依次排第二层,第三层。【总结】原子种类与原子结构的关系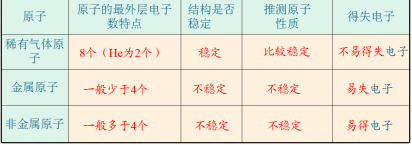 原子的最外层电子数决定原子的化学性质。三、课堂小结一、原子的构成
原子的最外层电子数决定原子的化学性质。三、课堂小结一、原子的构成 核电荷数=质子数=核外电子数二、原子核外电子排布原子中的核外电子是分层排布的,可以用原子结构示意图表示。【教学反思】本节课分析讨论了原子结构及原子核外电子的排布,提高学生的想象力,进一步让学生了解了微观世界中的化学的奥秘,激发了学生学习兴趣,但学生的探究活动少,动手操作活动少,学生缺乏动手操作能力的培养。
核电荷数=质子数=核外电子数二、原子核外电子排布原子中的核外电子是分层排布的,可以用原子结构示意图表示。【教学反思】本节课分析讨论了原子结构及原子核外电子的排布,提高学生的想象力,进一步让学生了解了微观世界中的化学的奥秘,激发了学生学习兴趣,但学生的探究活动少,动手操作活动少,学生缺乏动手操作能力的培养。
相关试卷
这是一份初中人教版课题2 原子的结构优秀第2课时巩固练习,共4页。
这是一份初中化学鲁教版九年级上册第三节 原子的构成第1课时同步练习题,共4页。试卷主要包含了原子的构成,核外电子的排布,下列关于原子的叙述正确的是,钠原子和氯原子的结构示意图如下等内容,欢迎下载使用。
这是一份人教版九年级上册课题2 原子的结构第1课时一课一练,共7页。









