


人教版九年级上册课题 1 质量守恒定律精品第1课时课时练习
展开第五单元 化学方程式
课题1 质量守恒定律
第1课时 质量守恒定律
【学习目标】
(1)通过实验探究认识质量守恒定律,知道化学反应前后的质量关系。
(2)从微观角度认识在化学反应前后原子的种类、数目、质量都没有改变,知道质量守恒的本质原因。
(3)能应用质量守恒定律解释有关现象和解决问题。
【学习重点】
(1)通过实验探究认识质量守恒定律。
(2)质量守恒定律的应用。
【学习难点】从微观角度解释质量守恒定律。
【教学流程】
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
【教学设计】
一、创设情境
课前准备一支蜡烛、两块金属片(同材料,生锈前同质量,一块生锈一块未生锈),课时点燃蜡烛,并观察蜡烛质量的变化,比较两块金属片的质量。
二、新课学习
【引言】蜡烛会越烧越短。化学反应发生后物质的质量是不是变少了?

通过准确测量,发现金属生锈后质量变大了。化学反应发生后物质的质量是不是增加了?


知识点1 质量守恒定律
【板书】 课题1 质量守恒定律 第1课时 质量守恒定律
【讲解】在一定条件下,反应物发生了化学反应生成新的物质,如镁条燃烧生成氧化镁,水电解产生氢气和氧气。那么反应物与生成物的质量之间究竟存在着什么关系呢?
下面请大家分组进行两个探究实验,主要观察反应前后反应物的质量与生成物的质量,列表记录。
探究方案一:红磷燃烧前后质量的测定
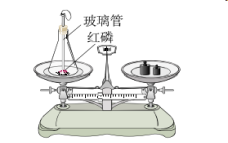
实验步骤:
(1)称量反应前红磷、锥形瓶、橡皮塞、气球的质量总和m1。
(2)将玻璃管下端在酒精灯外焰烧红,迅速塞紧瓶塞,引燃红磷,观察现象。
(3)锥形瓶冷却后,重新放到天平上称量m2。
实验现象:
(1)红磷燃烧,产生大量白烟,生成一种白色固体;气球先膨胀后缩小。
(2)反应后,天平平衡。
【讲解】反应前后物质的质量总和没有发生改变。
探究方案二:铁钉与硫酸铜溶液反应前后质量的测定

实验步骤:
(1)称量反应前盛有硫酸铜溶液的烧杯和用砂纸打磨干净的铁钉的质量总和m1。
(2)把铁钉放入硫酸铜溶液中,观察现象。
(3)称量反应后物质总质量m2。
实验现象:
(1)铁钉表面有红色物质出现,溶液由蓝色渐渐变成浅绿色。

(2)反应后,天平平衡。
【讲解】反应前后物质的质量总和没有发生改变。
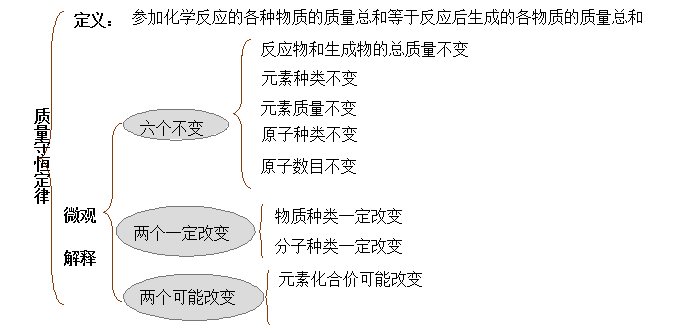
【总结】大量实验证明,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。这个规律就叫质量守恒定律。
对质量守恒定律的理解:
(1)“化学反应”:规定了研究范围,该定律不能用来解释物理变化。
(2)“参加”:没有参加反应的物质和反应后剩余的物质不能算入化学反应中的质量变化内。
(3)“各物质”:不能遗漏任何一种反应物和生成物,特别是气体和沉淀。
(4)“反应生成”:不是反应生成的物质不能算。
(5)“质量守恒”:该定律知识研究化学反应的质量问题,热量、体积变化不在研究范围之内。
【讲解】到底是不是所有的化学反应都遵守质量守恒定律呢?下面我们再进行两个实验。
实验5-1:盐酸与碳酸钠粉末反应前后质量的测定
实验步骤:组织学生实验或利用多媒体播放实验视频。
实验现象:产生大量气体,天平示数减小。
实验5-2:镁条燃烧
实验步骤:组织学生实验或利用多媒体播放实验视频。
实验现象:剧烈燃烧,发出耀眼白光,生成白色固体物质。
【提问】为什么会出现生成物的质量大于或小于反应物的质量这些情况呢?实验5-1、5-2到底遵守不遵守质量守恒定律呢?
【讲解】实验5-1中,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,其中二氧化碳是气体,直接逸散到空气中,其质量不再能被托盘天平称量,故天平放油砝码的一端下沉。实验5-2中,镁和氧气反应生成氧化镁,部分氧化镁以白烟的形式扩散到空气中,质量应该减少,而反应后得到的白色固体的质量大于原来的镁的质量,则是因为氧化镁的质量包括参加反应的镁和氧气的质量。
【板书】一、质量守恒定律
1.概念:大量实验证明,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。这个规律就叫质量守恒定律。
2.运用范围:化学变化。
3.所有的化学反应均遵守质量守恒定律。
知识点2 质量守恒定律的微观解释
【动画演示】氢气与氧气反应生成水的过程。
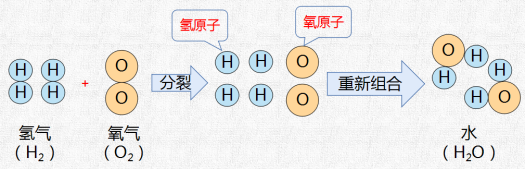
【讲解】化学反应的微观实质:化学反应的过程,就是参加反应的各物质(反应物)的原子重新组合而生成其他物质(生成物)的过程。在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变。
【点拨】质量守恒定律可理解为“六个不变”“两个一定改变”“两个可能改变”。
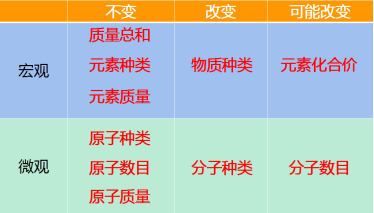
【板书】二、质量守恒定律的微观解释
化学反应的过程,就是参加反应的各物质(反应物)的原子重新组合而生成其他物质(生成物)的过程。在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变。
三、课堂小结
【教学反思】
成功之处:本堂课主要以实验贯穿教学。体现了化学学科的特点(以实验为基础)和新课改要求(学生为主体);学生在老师的引导下自主探究、讨论,使学生在动中学、学中思,将学习和实践有机的结合在一起;知识的获取均以学生自主探索,小组合作获得,体现集体的智慧;同时,增强学生团结合作的意识。
不足之处:应大胆地放手让学生去想、去说,开发学生的想象力和创造力。
化学九年级上册课题 1 质量守恒定律优秀第2课时课后测评: 这是一份化学九年级上册课题 1 质量守恒定律优秀第2课时课后测评,共4页。
初中化学人教版九年级上册课题 1 质量守恒定律课后练习题: 这是一份初中化学人教版九年级上册课题 1 质量守恒定律课后练习题,共7页。
2020-2021学年课题 1 质量守恒定律课时训练: 这是一份2020-2021学年课题 1 质量守恒定律课时训练,共6页。













