






2019苏教版高中化学必修一专题4-4.1.1二氧化硫的性质和应用课件PPT
展开
这是一份2019苏教版高中化学必修一专题4-4.1.1二氧化硫的性质和应用课件PPT,共31页。
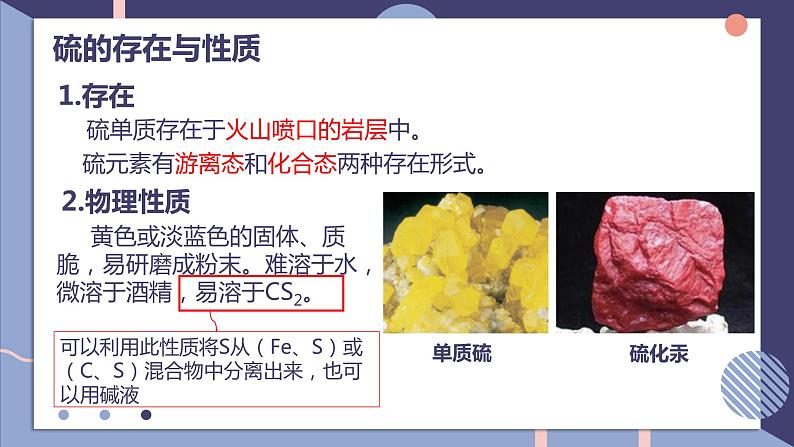
NFSOAI二氧化硫的性质和应用第一单元fashionH目录CONTENTS1硫的存在与性质2二氧化硫的性质和应用硫的存在与性质硫的存在与性质1.存在硫元素有游离态和化合态两种存在形式。2.物理性质 黄色或淡蓝色的固体、质脆,易研磨成粉末。难溶于水,微溶于酒精,易溶于CS2。可以利用此性质将S从(Fe、S)或(C、S)混合物中分离出来,也可以用碱液硫单质存在于火山喷口的岩层中。下列关于硫的叙述正确的是( )A.硫是植物生长所需要的一种元素B.硫单质很脆,易粉碎,易溶于水,加热易熔化C.只能以化合态存在于自然界中D.在火药的爆炸中硫作还原剂(生成K2S )解析:硫难溶于水,B错误;硫在自然界中既有游离态又有化合态,C错误;硫在火药的爆炸中生成K2S,硫的化合价降低,作氧化剂,D错误。A学以致用3.化学性质 硫单质在氧气中剧烈燃烧,发出明亮的蓝紫色火焰,产物是二氧化硫,化学方程式:单质硫既有氧化性又有还原性。思考:硫粉在氧气中燃烧产生什么现象?生成什么物质?二氧化硫的性质和应用2.化学性质 二氧化硫属于酸性氧化物,化学性质较为活泼,通常表现出还原性,还具有漂白性。1.物理性质SO2的性质实验探究SO2的化学性质①溶解性及酸碱性实验记录试管内水的液面上升,气体体积逐渐减小,溶液PHH2CO3实验探究SO2的化学性质③漂白性实验记录振荡,红色褪去;加热时,无色溶液又恢复红色SO2具有漂白性,能使品红褪色,生成的无色物质不稳定,加热时,无色物质又分解恢复为原来的红色注意①SO2能漂白品红、鲜花,不能漂白酸碱指示剂,SO2只能使紫色石蕊溶液变红。③SO2使酸性高锰酸钾溶液、溴水、氯水、碘水褪色表现的是SO2的还原性,加热后溶液颜色不复原。②SO2使品红溶液褪色表现的是SO2的漂白性,加热后溶液颜色复原检验SO2和CO2同时存在的一般流程加入品红溶液,品红溶液褪色加入酸性KMnO4溶液,酸性KMnO4溶液褪色加入品红溶液,品红溶液不褪色加入澄清石灰水,澄清石灰水变浑浊SO2和Cl2的漂白性二氧化硫的检验方法二氧化硫的制备Na2SO3+H2SO4(浓)= Na2SO4+SO2↑+H2O最好用70%的浓硫酸,浓度太大时,C(H+)太小,不利于生成SO2;浓度太小时,不利于SO2的逸出。二氧化硫的用途制备硫酸作食品添加剂作消毒剂、防腐剂漂白纸浆及草编织物某化学兴趣小组为探究 SO2的性质,按如图所示装置进行实验。请回答下列问题:(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学程式为 。(2 )实验过程中,装置B、C中出现的现象分别是 、 ;这些象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 。蒸馏烧瓶溶液由紫红色变为无色无色溶液变浑浊还原性氧化性(3)装置D的目的是探究SO2与品红反应的可逆性,请写出实验操作及现像 。(4)尾气可采用 溶液吸收品红溶液褪色后,关闭分液漏斗的活塞,点燃酒精灯,溶液恢复红色NaOHUHNOAKTY






