



化学必修 第一册第二单元 硫及其化合物的相互转化图文ppt课件
展开
这是一份化学必修 第一册第二单元 硫及其化合物的相互转化图文ppt课件,共26页。
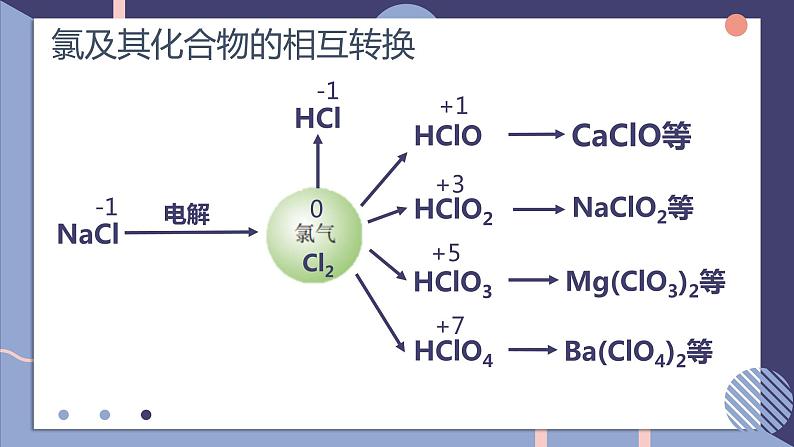
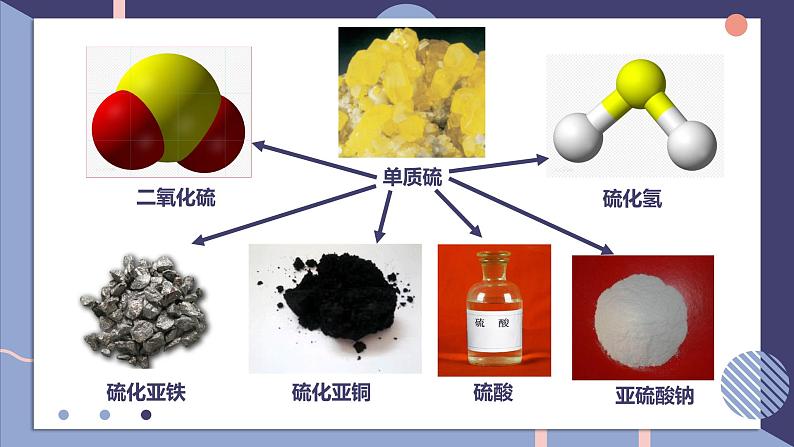
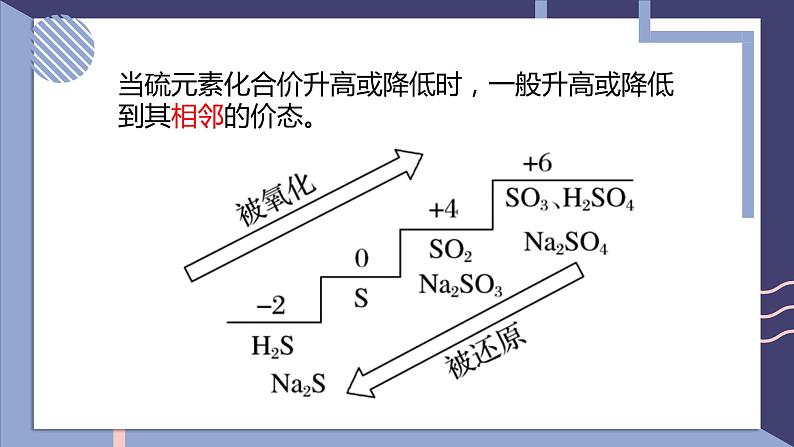
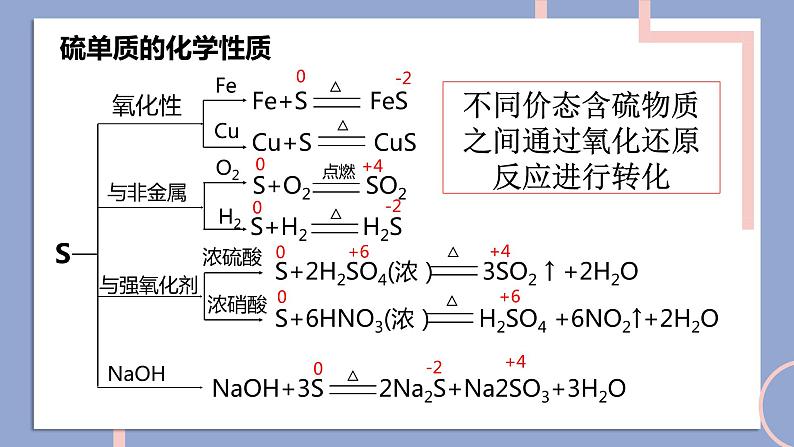
NFSOAI硫及其化合物的相互转换第二单元fashionH含硫物质之间的转化回顾氯气的性质氯及其化合物的相互转换-1-10+1+3+5+7-2价:H2S、Na2S、NaHS、FeS等0价:S+4价:SO2、H2SO3、CuSO4、Na2SO4、BaSO4等+6价:SO3、H2SO4、硫酸盐等思考:硫元素常见的化合价有哪些?常见的含硫化合物有哪些?当硫元素化合价升高或降低时,一般升高或降低到其相邻的价态。硫单质的化学性质SFeCuO2H2浓硫酸浓硝酸不同价态含硫物质之间通过氧化还原反应进行转化0-20+40-20+6+40+6+4-201、在常温下,硫单质能与汞化合生成硫化汞(HgS)。因此,为了除去不慎洒落的汞,人们常将硫黄粉撒在汞的表面。2、长期暴露在空气中的亚硫酸钠会慢慢变成硫酸钠。Hg + S == HgS2Na2SO4 + O2 == 2Na2SO4写出化学方程式:3、实验室中用过量氢氧化钠溶液吸收二氧化硫生成亚硫酸钠。4、二氧化硫在催化剂、加热的条件下与氧气反应生成三氧化硫。SO2 + 2NaOH == Na2SO3 + H2O说明:不同价态的含硫物质之间能否转化,与反应物的性质、反应条件有关。相同价态含硫物质之间通过非氧化还原反应进行转化硫元素的化合价变化典型的硫及其化合物转化④2H2S+SO2 = 3S↓+2H2O⑧2H2SO3+O2 = 2H2SO4典型的硫及其化合物转化 ⑬Na2SO3+H2SO4=Na2SO4+SO2↑+H2O ⑫ SO2(少量)+2NaOH=Na2SO3+H2O⑭2Na2SO3+O2=Na2SO4⑮SO3+2NaOH=Na2SO4+H2O硫元素价态的转化规律(1)-2价是硫元素的最低价态,只有还原性。它与氧化剂反应,其价态一般会升至相邻的价态。如H2S+2FeCl3=2HCl+2FeCl2+S↓。(2)能发生自身氧化还原反应,在反应时分别升至和降至与其相邻的价态。如3S+6KOH=2K2S+K2SO3+3H2O。1、邻位价态转化规律硫元素价态的转化规律(4)最高价+6价,只有氧化性,在化学反应中得到电子,化合价降低,一般降到相邻价态。(3)中间价态的0和+4价硫,既可以被氧化,也可以被还原。硫元素价态的转化规律①其高价态的化合物可能具有氧化性,在氧化还原反应中可作氧化剂;②其低价态的化合物可能具有还原性,在氧化还原反应中可作还原剂;③其中间价态的化合物,在不同的化学反应中可能表现出氧化性,也可能表现出还原性。2、氧化剂和还原剂的判断单元典型例题剖析2、硫元素的几种化合物及单质存在下列转化关系:下列说法不正确的是( )A.反应①中浓硫酸是氧化剂B.反应②表明SO2具有酸性氧化物的性质C.反应③的化学方程式为S+Na2SO3 - NaS2O3D.反应④中稀硫酸是还原剂D1、如下所示, A为单质, B为一种具有还原性的二元含氧酸, C为溶液,且溶液中仅有一种溶质,D为气体,E、F为白色沉淀。物质间转化过程中需要加入的试剂未完全写出。回答下列问题(1)在空格处写出相应物质的化学式:A ;D ;E ;(2)③中所加的试剂应该具有 (填 "氧化"或“还原" )性,可能为 或 。(3)写出B→E的离子方程式: ;写出C→F的离子方程式: 。SSO2BaSO4氧化O2H2O2H2SO3+Ba2++20H- = BaSO3↓+2H2OBa2++SO2-4 = BaSO4↓3、物质的类别和核心元素的化合价是研究物质性质的两个角度。请根据图示回答下列问题:(1)X与Y反应可生成淡黄色固体,反应的化学方程式 。(2)欲制备Na2S2O3,从氧化还原角度分析,下列选项中合理的反应物是 (填字母)。a. Na2SO3与Sb.Na2S与SC. SO2与Na2SO4d. Na2SO3与Na2SO42H2S+SO2 = 3S+2H2Oa课堂小结UHNOAKTY
相关课件
这是一份高中化学苏教版 (2019)必修 第一册第二单元 硫及其化合物的相互转化课文内容ppt课件,共43页。PPT课件主要包含了课堂小结等内容,欢迎下载使用。
这是一份高中化学苏教版 (2019)必修 第一册专题4 硫与环境保护第二单元 硫及其化合物的相互转化背景图ppt课件,共44页。PPT课件主要包含了氧化还原,蓝紫色,有刺激性,√√×,含硫物质之间的转化等内容,欢迎下载使用。
这是一份苏教版 (2019)必修 第一册第二单元 硫及其化合物的相互转化评课课件ppt,共52页。PPT课件主要包含了分点突破1,含硫物质之间的转化,分点突破2,点击此处进入文档,基础全面练等内容,欢迎下载使用。










