





科学九年级上册第2节 金属的化学性质优秀课堂检测
展开第二节 金属的化学性质
【内容来源】九年级浙教版上册第二章
【主 题】第二节金属的化学性质
【课 时】第2课时
一、教学目标
1.知识与技能
通过典型金属和酸以及某些盐的反应,认识金属活动性顺序。
了解置换反应的特点。认识电子在化学反应中的作用。
2.过程与方法
通过实验探究了解常见金属的化学性质。通过典型金属和酸以及某些盐的反应实验,认识金属活动性顺序。从中归纳出置换反应的特点
3.情感态度和价值观
通过学习培养学生的逻辑思维及严谨的科学态度。
二、重点难点
重点:金属的化学性质;金属活动性顺序。
难点:置换反应的特点,探究和认识金属活动性顺序。
三、教学过程:
(一)引入新知
复习回顾:上节课我们学习了金属与氧气、酸的反应,我们现在回忆一下。
思考:为什么镁和锌能与酸反应放出氢气,而铜不能?为什么镁与酸反应放出氢气的速度比锌的快?这说明不同的金属,其化学性质的活泼性是不一样的.那么,我们应该如何比较金属化学性质的活动性呢?
(二)新课教学
探究:金属活动性顺序
【提出问题】
铁、铜、银3种金属的活动性哪一种最强?哪一种最弱?
【建立假设】
一种活动性较强的金属能把另一种活动性较弱的金属从它的盐的水溶液中置换出来。
【设计实验】
1.在盛有硫酸铜溶液的试管里浸入一段洁净的铁丝,过一会儿取出,观察有什么变化____________________________.(铁丝表面有一层红色物质生成)。
化学反应方程式为: Fe+CuSO4==FeSO4+Cu 置换反应
2. 在盛有硫酸亚铁溶液的试管中,进入一段洁净的铜丝,过一会儿取出,观察到______________(铜丝表面没变化)。说明铜与硫酸亚铁溶液没有发生化学变化。
思考:上述两个实验说明了什么?
铁比铜活泼
3. 在盛有硝酸银溶液的试管中,浸入一段洁净的铜丝,过一会儿取出,观察到___________________(浸入硝酸银溶液中的铜丝表面有一层银白色物质生成)
反应的化学方程式为: Cu+2AgNO3==Cu(NO3)2+2Ag 置换反应
思考:根据以上实验事实,比较铜、银、铁的活动性大小的顺序为_______________。
知识迁移:1. 如何设计实验比较镁、锌、铜的活动性,并从大到小列出它们的活动性顺序。
2. 如果把氢也列入其中,应如何排列?
教师协助总结
金属活动性顺序
经过许多实验,人们总结出一些金属的金属活动性顺序如下:
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、H、Cu、Hg、Ag、Pt、Au
![]()
金属活动性由强逐渐减弱
金属活动性顺序的应用
金属活动性顺序的应用规律:
① 在金属活动性顺序里,位于氢前的金属能置换出盐酸、稀硫酸中的氢。
② 在金属活动性顺序里,位于前面的金属能把后面的金属从它们化合物的溶液里置换出来。(K、Ca、Na三种金属除外)
简洁语言归纳:越在前面越活泼,氢前金属置换氢;
金属之间互置换,溶液里面可探寻。
思考与讨论:1.哪些金属不会被酸腐蚀?
2.金属活动性顺序表说明金属具有怎样的化学性质?它对置换反应的发生有什么意义?
教师总结:金属的化学性质,注意:特别活泼的金属 (K、Ca、Na)与可溶盐溶液或酸溶液反应时,先与水发生反应生成 氢气,然后是碱与盐或酸反应。
知识应用:1.金属活动性顺序对置换反应的发生有何意义?
2.根据金属活动性顺序表判断能否用锡壶装酸性物质,并说出理由。
3.能否用铁制的容器配制浸种用的波尔多液(含硫酸铜)?为什么?
介绍:湿法炼铜
湿法炼铜技术是我国古代劳动人民发明的,我国是世界上最早使用湿法炼铜的国家。
原理:先用硫酸将铜矿中的铜转变成可溶性的硫酸铜,再将铁放入硫酸铜溶液中把铜置换出来。
Fe+CuSO4=FeSO4+Cu

化学反应中的电子转移
【知识回顾】:电子、原子、离子的符号及概念。
【实验】:把金属锌放入硫酸铜溶液中,可观察到__________________(银白色的金属锌表面镀上了一层紫红色的铜)。
思考:为什么铜离子会从溶液中析出变成金属铜,而金属锌则变成锌离子进入溶液?
【教师分析】:在上述的化学反应中,金属锌失去电子变成锌离子进入溶液,而铜离子从金属锌表面得到了电子变成了金属铜,上述反应的过程实际上是电子转移的过程。
![]()
![]()
![]()
![]() 2e
2e
Zn + CuSO4 == ZnSO4 + Cu
说明:金属锌失电子的能力比铜强,锌金属活动性比铜强。或者说铜离子得电子得能力比锌离子强,反应就发生了。
结论:在反应物之间电子发生转移的反应,又称为氧化还原反应。置换反应都是氧化还原反应。
(三)课堂练习
1. 下图表示了金属活动性顺序表中铜、锡、铁和铝元素开始被人类大规模开发和利用的大致年限。
铜、锡、铁和铝四种元素中,最先被人类大规模开发和利用的是 ,最后被人类大规模开发、利用的是 。
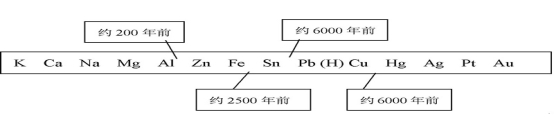
根据图中数据和有关科学知识,你认为导致铜、锡、铁和铝四种元素被人类大规模开发、利用的年代不同的原因可能是 。
2.下列各组金属中,按金属活动性由强到弱顺序排列的是--( )
A、Na、Fe、Mg B、K、Cu、Fe
C、Al、Zn、Hg D、Ca、Ag、Zn
3. 有X、Y、Z三种金属,将X、Y、Z分别浸入稀硫酸中,Z溶解,X和Y不溶解;将X浸入Y的硫 酸盐溶液中,在X的表面有Y析出。则X、Y、Z 的金属活动性由强到弱的顺序为-----------( )
A. Z、Y、X B. Y、Z、X
C. Z、X、Y D. Y、X、Z
4. 锌跟稀硫酸反应时,溶液的质量将-------( )
A.增加 B.减少 C.不变 D.无法确定
5.已知排在金属活动性顺序表最前几位的活泼金属能与水反应生成碱和氢气。请写出下列反应的化学方程式,并推测可能产生的实验现象。
(1)把 1 块绿豆大的金属钠放入 1 小杯滴有酚酞的水中。
(2)把 1 块绿豆大的金属钾放入 1 小杯硫酸铜溶液中。
四、板书设计
第二节 金属的化学性质
一、金属活动性顺序
经过许多实验,人们总结出一些金属的金属活动性顺序如下:
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、H、Cu、Hg、Ag、Pt、Au
![]()
金属活动性由强逐渐减弱
二、金属活动性顺序的应用
湿法炼铜
Fe+CuSO4=FeSO4+Cu
初中科学浙教版九年级上册第2节 金属的化学性质同步测试题: 这是一份初中科学浙教版九年级上册第2节 金属的化学性质同步测试题,共5页。试卷主要包含了选择题,填空题,综合题等内容,欢迎下载使用。
浙教版九年级上册第2节 金属的化学性质复习练习题: 这是一份浙教版九年级上册第2节 金属的化学性质复习练习题,共22页。试卷主要包含了单选题,填空题,实验探究题,解答题等内容,欢迎下载使用。
初中科学浙教版九年级上册第2节 金属的化学性质精品第2课时复习练习题: 这是一份初中科学浙教版九年级上册第2节 金属的化学性质精品第2课时复习练习题,共5页。













