所属成套资源:十年(23-22)高考化学真题分项汇编专题(2份打包,原卷版+教师版)
十年(23-22)高考化学真题分项汇编专题33 电解原理(2份打包,原卷版+教师版)
展开这是一份十年(23-22)高考化学真题分项汇编专题33 电解原理(2份打包,原卷版+教师版),文件包含十年23-22高考化学真题分项汇编专题33电解原理原卷版doc、十年23-22高考化学真题分项汇编专题33电解原理教师版doc等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。
![]()

1.【2022年海南卷】一种采用![]() 和
和![]() 为原料制备
为原料制备![]() 的装置示意图如下。
的装置示意图如下。
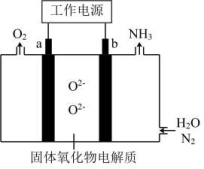
下列有关说法正确的是
A.在b电极上,![]() 被还原
被还原
B.金属Ag可作为a电极的材料
C.改变工作电源电压,反应速率不变
D.电解过程中,固体氧化物电解质中![]() 不断减少
不断减少
2.【2022年6月浙江卷】通过电解废旧锂电池中的![]() 可获得难溶性的
可获得难溶性的![]() 和
和![]() ,电解示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法不正确的是
,电解示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法不正确的是
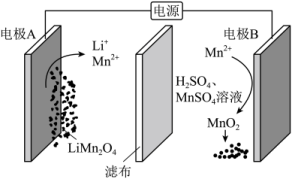
A.电极A为阴极,发生还原反应
B.电极B的电极发应:![]()
C.电解一段时间后溶液中![]() 浓度保持不变
浓度保持不变
D.电解结束,可通过调节![]() 除去
除去![]() ,再加入
,再加入![]() 溶液以获得
溶液以获得![]()
3.(2020·山东高考真题)采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如下图所示。忽略温度变化的影响,下列说法错误的是
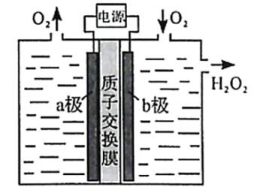
A.阳极反应为![]()
B.电解一段时间后,阳极室的pH未变
C.电解过程中,H+由a极区向b极区迁移
D.电解一段时间后,a极生成的O2与b极反应的O2等量
4.(2020·全国高考真题)电致变色器件可智能调控太阳光透过率,从而实现节能。下图是某电致变色器件的示意图。当通电时,Ag+注入到无色WO3薄膜中,生成AgxWO3,器件呈现蓝色,对于该变化过程,下列叙述错误的是
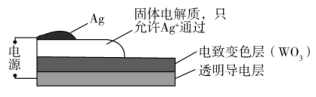
A.Ag为阳极 B.Ag+由银电极向变色层迁移
C.W元素的化合价升高 D.总反应为:WO3+xAg=AgxWO3
5.(2013·天津高考真题)为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2![]() Al2O3+3H2↑电解过程中,以下判断正确的是( )
Al2O3+3H2↑电解过程中,以下判断正确的是( )
| 电池 | 电解池 |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
D |
|
|
6.(2007·全国高考真题)以惰性电极电解足量的CuSO4溶液。若阳极上产生气体的物质的量为0.0100 mol,则阴极上析出铜的质量为( )
A.0.64 g B.1.28 g C.2.56 g D.5.12 g
7.(2014·上海高考真题)如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是
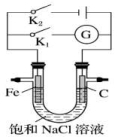
A.K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001 mol气体
8.(2012·安徽高考真题)某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
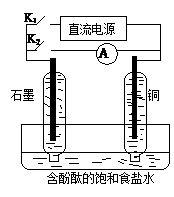
A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl—![]() Cl2↑+H2↑
Cl2↑+H2↑
B.断开K2,闭合K1时,石墨电极附近溶液变红
C.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e—=2Cl—
D.断开K1,闭合K2时,石墨电极作正极
9.(2007·上海高考真题)某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
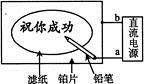
A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生
D.a点是负极,b点是正极
10.(2012·上海高考真题)右图装置中发生反应的离子方程式为:Zn+2H+=Zn2++H2↑,下列说法错误的是
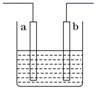
A.a、b不可能是同种材料的电极
B.该装置可能是电解池,电解质溶液为稀盐酸
C.该装置可能是原电池,电解质溶液为稀盐酸
D.该装置可看作是铜-锌原电池,电解质溶液是稀硫酸
11.(2013·浙江高考真题)电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
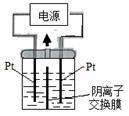
已知:3I2+6OH-=IO3-+5I-+3H2O
下列说法不正确的是
A.右侧发生的电极方程式:2H2O+2e-=H2↑+2OH-
B.电解结束时,右侧溶液中含有IO3-
C.电解槽内发生反应的总化学方程式KI+3H2O=KIO3+3H2↑
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
12.(2012·海南高考真题)下列各组中,每种电解质溶液电解时(惰性电极)只生成氢气和氧气的是
A.HCl、CuCl2、Ba(OH)2 B.NaOH、CuSO4、H2SO4
C.NaOH、H2SO4、Ba(OH)2 D.NaBr、H2SO4、Ba(OH)2
13.(2012·福建高考真题)将下图所示实验装置的 K 闭合,下列判断正确的是
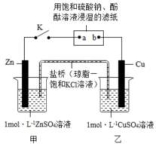
A.Cu 电极上发生还原反应
B.电子沿 Zn→a→b→Cu 路径流动
C.片刻后甲池中c(SO42-)增大
D.片刻后可观察到滤纸b点变红色
14.(2010·全国高考真题)铅蓄电池的工作原理为:Pb+PbO2+2H2SO=2PbSO4+2H2O
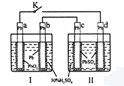
研读右图,下列判断不正确的是
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42-
B.当电路中转移0.2 mol电子时,Ⅰ中消耗的![]() 为0.2mol
为0.2mol
C.K闭合时,Ⅱ中![]() 向c电极迁移
向c电极迁移
D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极
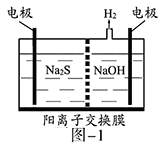
15.(2014·江苏高考真题)硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收H2S后的溶液加入到如题图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e-=S(n—1)S+ S2-=Sn2-。
①写出电解时阴极的电极反应式:__________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成_____________。
16.(2019·江苏高考真题)CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。
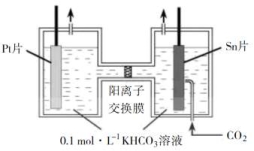
①写出阴极CO2还原为HCOO−的电极反应式:________。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是________。
17.(2015·北京高考真题)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(4)利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。
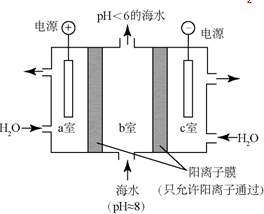
①结合方程式简述提取CO2的原理:_________。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是_______。
18.(2012·全国高考真题)由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:

(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板应是图中电极 (填图中的字母);在电极d上发生的电极反应式为_______;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为______。
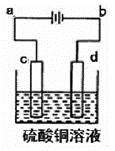
19.(2014·重庆高考真题)氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(4)一定条件下,题11图示装置可实现有机物的电化学储氢(忽略其它有机物)。
①导线中电子移动方向为____________。
②生成目标产物的电极反应式为_________。
③该储氢装置的电流效率![]() =_____(
=_____(![]() =
=![]() ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
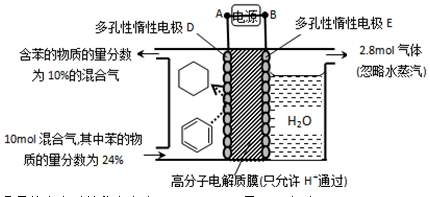
20.(2017·江苏高考真题)铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
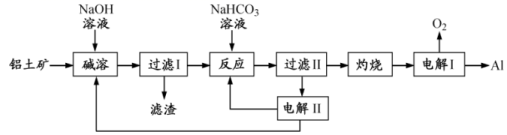
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
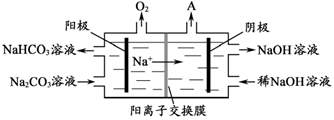
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
21.(2011·天津高考真题)工业废水中常含有一定量的![]() ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
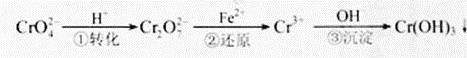
其中第①步存在平衡:
![]()
方法2:电解法
该法用Fe做电极电解含Cr![]() O
O![]() 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)![]() 沉淀。
沉淀。
(5)用Fe做电极的原因为 。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有 。
22.(2010·全国高考真题)右图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的pH变色范围:6.8~8.0,酸色—红色,碱色—黄色)
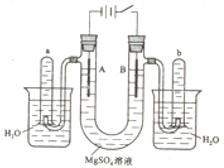
回答下列问题:
(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是________(填编号);
①A管溶液由红变黄;②B管溶液由红变黄;
③A管溶液不变色;④B管溶液不变色;
(2)写出A管中发生反应的反应式:_________________________________;
(3)写出B管中发生反应的反应式:_________________________________;
(4)检验a管中气体的方法是_______________________________________;
(5)检验b管中气体的方法是____________________________________________;
(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是_____________________。
23.(2014·北京高考真题)(15分)用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/LFeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压值:)
序号 | 电压/V | 阳极现象 | 检验阳极产物 |
I | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
II | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
III | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(1)用KSCN溶液检验出Fe3+的现象是_______。
(2)I中,Fe2+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应的方程式_____。
(3)由II推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有_____性。
(4)II中虽未检测出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
序号 | 电压/V | 阳极现象 | 检验阳极产物 |
IV | a>x≥c | 无明显变化 | 有Cl2 |
V | c>x≥b | 无明显变化 | 无Cl2 |
①NaCl溶液的浓度是________mol/L。
②IV中检测Cl2的实验方法:____________________。
③与II对比,得出的结论(写出两点):___________________。
相关试卷
这是一份十年(23-22)高考化学真题分项汇编专题65 离子检验与推断(2份打包,原卷版+教师版),文件包含十年23-22高考化学真题分项汇编专题65离子检验与推断原卷版doc、十年23-22高考化学真题分项汇编专题65离子检验与推断教师版doc等2份试卷配套教学资源,其中试卷共19页, 欢迎下载使用。
这是一份十年(23-22)高考化学真题分项汇编专题53 烃(2份打包,原卷版+教师版),文件包含十年23-22高考化学真题分项汇编专题53烃原卷版doc、十年23-22高考化学真题分项汇编专题53烃教师版doc等2份试卷配套教学资源,其中试卷共16页, 欢迎下载使用。
这是一份十年(23-22)高考化学真题分项汇编专题52 有机实验(选择)(2份打包,原卷版+教师版),文件包含十年23-22高考化学真题分项汇编专题52有机实验选择原卷版doc、十年23-22高考化学真题分项汇编专题52有机实验选择教师版doc等2份试卷配套教学资源,其中试卷共19页, 欢迎下载使用。