










所属成套资源:2024版新教材高考化学全程一轮总复习1物质的组成性质和分类(课件+课时作业+学生用书)
- 2024版新教材高考化学全程一轮总复习9金属材料金属矿物的开发和利用(课件+课时作业+学生用书)(3份) 课件 0 次下载
- 2024版新教材高考化学全程一轮总复习第八章水溶液中的离子平衡第25讲电离平衡(课件+课时作业+学生用书)(3份) 课件 0 次下载
- 2024版新教材高考化学全程一轮总复习第八章水溶液中的离子平衡第27讲酸碱中和滴定(课件+课时作业+学生用书)(3份) 课件 0 次下载
- 2024版新教材高考化学全程一轮总复习第八章水溶液中的离子平衡第28讲盐类水解(课件+课时作业+学生用书)(3份) 课件 0 次下载
- 2024版新教材高考化学全程一轮总复习第八章水溶液中的离子平衡第29讲溶液中“粒子”浓度关系(课件+课时作业+学生用书)(3份) 课件 0 次下载
2024版新教材高考化学全程一轮总复习第八章水溶液中的离子平衡第26讲水的电离和溶液的pH(课件+课时作业+学生用书)(3份)
展开
这是一份2024版新教材高考化学全程一轮总复习第八章水溶液中的离子平衡第26讲水的电离和溶液的pH(课件+课时作业+学生用书)(3份),文件包含2024版新教材高考化学全程一轮总复习第八章水溶液中的离子平衡第26讲水的电离和溶液的pH课件pptx、2024版新教材高考化学全程一轮总复习第八章水溶液中的离子平衡第26讲水的电离和溶液的pH学生用书doc、2024版新教材高考化学全程一轮总复习课时作业26水的电离和溶液的pHdoc等3份课件配套教学资源,其中PPT共40页, 欢迎下载使用。
复 习 目 标1.了解水的电离、离子积常数(Kw)。2.了解溶液pH的含义及其测定方法,能进行pH的简单计算。
考点一 水的电离与水的离子积必备知识整理1.水的电离(1)水是极弱的电解质,其电离方程式为2H2O⇌____________,可简写为H2O⇌__________。(2)25 ℃时,纯水中c(H+)=c(OH-)=________ ml·L-1。
c(H+)·c(OH-)
微点拨 Kw=c(H+)·c(OH-)中的H+和OH-不一定都是由水电离出来的,而是指溶液中的c(H+)和c(OH-),即不仅仅适用于纯水,还适用于酸、碱、盐的稀溶液。
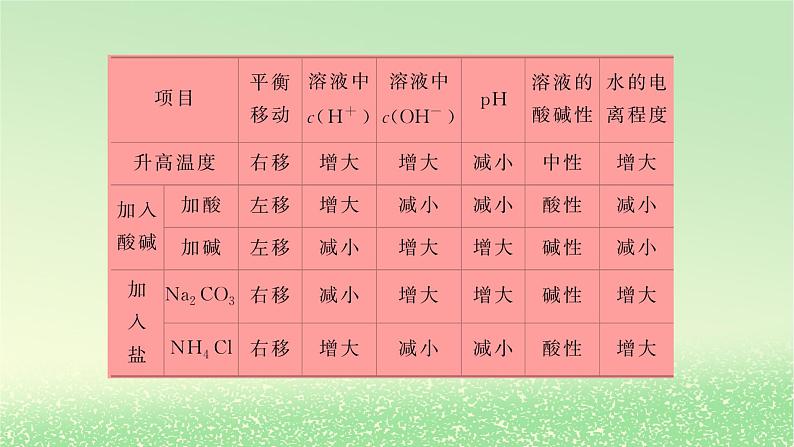
3.水电离平衡的影响因素
[正误判断] (1)温度一定时,在纯水中通入少量SO2,水的电离平衡不移动,Kw不变( )(2)室温下,0.1 ml·L-1的HCl溶液与0.1 ml·L-1的NaOH溶液中水的电离程度相等( )(3)NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同( )
× 二氧化硫与水反应生成的亚硫酸抑制水的电离
× CH3COONH4溶液中的醋酸根离子和铵根离子均能水解,促进水的电离
对点题组训练题组一 影响水电离平衡的因素及结果判断1.25 ℃时,水的电离达到平衡:H2O⇌H++OH-,下列叙述正确的是( )A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低D.将水加热,Kw增大,pH不变
2.(双选)一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )A.升高温度,可能引起由c向b的变化B.该温度下,水的离子积常数为1.0×10-14C.该温度下,加入FeCl3可能引起由b向a的变化D.该温度下,稀释溶液可能引起由c向d的变化
解析: A项,c点溶液中c(OH-)>c(H+),溶液呈碱性,升温,溶液中c(OH-)不可能减小,错误。B项,由b点对应c(H+)与c(OH-)可知,Kw=c(H+)·c(OH-)=1.0×10-7×1.0×10-7=1.0×10-14,正确。C项,FeCl3溶液水解显酸性,溶液中c(H+)增大,因一定温度下水的离子积是常数,故溶液中c(OH-)减小,因此加入FeCl3溶液可能引起由b向a的变化,正确。D项,c点溶液呈碱性,稀释时c(OH-)减小,同时c(H+)应增大,故稀释溶液时不可能引起由c向d的转化,错误。
题组二 溶液中由水电离出的c(OH-)或c(H+)的求算3.25 ℃时,在等体积的下列溶液中,发生电离的水的物质的量之比是( )①pH=0的H2SO4溶液 ②0.05 ml·L-1的Ba(OH)2溶液 ③pH=10的Na2S溶液 ④pH=5的NH4NO3溶液A.1∶10∶1010∶109B.1∶5∶5×109∶5×108C.1∶20∶1010∶109D.1∶10∶104∶109
4.T ℃时0.1 ml·L-1 NaOH溶液的pH=12,则T ℃时pH=10的Na2CO3溶液中c(H+)H2O=________ ml·L-1。
考点二 溶液的酸碱性与pH必备知识整理1.溶液的酸碱性溶液的酸碱性取决于c(H+)与c(OH-)的相对大小,具体内容见下表:
2.溶液的pH(1)表达式:pH=__________。(2)使用范围:pH的取值范围为0~14,即只适用于c(H+)≤1 ml·L-1或c(OH-)≤1 ml·L-1的电解质溶液,当c(H+)≥1 ml·L-1或c(OH-)≥1 ml·L-1时,直接用c(H+)或c(OH-)表示溶液的酸碱性。(3)pH的意义:pH表示溶液酸碱性的强弱。在相同温度下,pH越小,溶液酸性________;pH越大,溶液碱性________。(4)溶液的酸碱性与pH的关系
3.pH的测定(1)pH试纸测定①使用方法:取一小片试纸放在洁净的________或________上,用________蘸取待测液点在试纸的中央,变色稳定后与标准比色卡对照,即可确定溶液的pH。②注意事项:pH试纸使用前不能用蒸馏水润湿,否则待测液因被稀释可能会产生误差;用广范pH试纸读出的pH只能是________。(2)pH计测定:可精确测定溶液的pH,可读取一位或两位小数。
4.溶液pH的计算(1)单一溶液pH的计算强酸溶液:如HnA,设浓度为c ml·L-1,c(H+)=__________ml·L-1,pH=-lg c(H+)=________。强碱溶液(25 ℃):如B(OH)n,设浓度为c ml·L-1,c(H+)=____________ ml·L-1,pH=-lg c(H+)=____________。
[正误判断] (1)酸性溶液中只有H+没有OH-( )(2)pH=7的溶液一定呈中性( )(3)用pH试纸测溶液的pH时,应先用蒸馏水润湿试纸( )
× 水溶液中同时存在H+和OH-
× 水的电离受温度的影响,因而溶液的pH也与温度有关
× 用蒸馏水润湿试纸,相当于稀释待测液
(4)用湿润的pH试纸测溶液的pH一定有误差( )(5)用广泛pH试纸测得某溶液的pH为3.4( )(6)任何温度下,利用H+和OH-浓度的相对大小均可判断溶液的酸碱性( )
× pH试纸使用时不能湿润,但用湿润的pH测定中性溶液的pH不产生误差
× 广泛pH试纸只能读取1~14的整数
对点题组训练题组一 酸、碱混合溶液酸碱性的判断1.常温下,两种溶液混合后酸碱性的判断(在括号中填“酸性”“碱性”或“中性”)。(1)相同浓度的HCl和NaOH溶液等体积混合( )(2)相同浓度的CH3COOH和NaOH溶液等体积混合( )(3)相同浓度的NH3·H2O和HCl溶液等体积混合( )(4)pH=2的H2SO4和pH=12的NaOH溶液等体积混合( )(5)pH=3的HCl和pH=10的NaOH溶液等体积混合( )(6)pH=3的HCl和pH=12的NaOH溶液等体积混合( )(7)pH=2的CH3COOH和pH=12的NaOH溶液等体积混合( )(8)pH=2的H2SO4和pH=12的NH3·H2O等体积混合( )
2.现有室温下四种溶液,有关叙述不正确的是( )A.③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大B.②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)C.分别加水稀释10倍,四种溶液的pH:①>②>④>③D.V1 L ④与V2 L ①混合,若混合后溶液pH=7,则V1<V2
微点拨 酸碱溶液混合后酸碱性的判断规律(1)等浓度等体积的一元酸与一元碱混合的溶液——“谁强显谁性,同强显中性”。(2)室温下c酸(H+)=c碱(OH-),即pH之和等于14时,一强一弱等体积混合——“谁弱谁过量,谁弱显谁性”。(3)已知强酸和强碱的pH,等体积混合(25 ℃时):①pH之和等于14,呈中性;②pH之和小于14,呈酸性;③pH之和大于14,呈碱性。
题组二 pH的简单计算3.将pH=1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比值为( )A.9 B.10 C.11 D.12
0.05 ml·L-1
微点拨 溶液pH计算的一般思维模型
本讲真题研练1.[2022·湖北卷]如图是亚砷酸As(OH)3和酒石酸(H2T,lg Ka1=-3.04,lg Ka2=-4.37)混合体系中部分物种的c-pH图(浓度:总As为5.0×10-4ml·L-1,总T为1.0×10-3ml·L-1)。
2.[2022·浙江1月]已知25℃时二元酸H2A的Ka1=1.3×10-7,Ka2=7.1×10-15。下列说法正确的是( )A.在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者B.向0.1 ml·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013%C.向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-)D.取pH=a的H2A溶液10 mL,加蒸馏水稀释至100 mL,则该溶液pH=a+1
3.[2020·浙江7月]下列说法不正确的是( )A.2.0×10-7 ml·L-1的盐酸中c(H+)=2.0×10-7 ml·L-1B.将KCl溶液从常温加热至80 ℃,溶液的pH变小但仍保持中性C.常温下,NaCN溶液呈碱性,说明HCN是弱电解质D.常温下,pH为3的醋酸溶液中加入醋酸钠固体,溶液pH增大
解析:本题考查电离平衡知识,考查的化学核心素养是变化观念与平衡思想。极稀的溶液中,H2O电离出的H+不能忽略,故c(H+)大于2×10-7ml·L-1,A项错误;水的电离是吸热的,升高温度促进水的电离,氢离子浓度和氢氧根离子浓度均增大,pH减小,但氢离子浓度和氢氧根离子浓度仍相等,溶液呈中性,B项正确;常温下,NaCN溶液呈碱性,说明NaCN是强碱弱酸盐,HCN是弱酸,C项正确;醋酸溶液中加入醋酸钠,醋酸根离子浓度增大,醋酸的电离平衡逆向移动,氢离子浓度减小,pH增大,D项正确。
4.[2023·浙江1月]甲酸(HCOOH)是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分R3N,R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始pH关系如图(已知甲酸Ka=1.8×10-4),
下列说法不正确的是( )A.活性成分R3N在水中存在平衡:R3N+H2O⇌R3NH++OH-B.pH=5的废水中c(HCOO-)∶c(HCOOH)=18C.废水初始pH5,离子交换树脂活性成分主要以R3NH+形态存在
相关课件
这是一份2024版新教材高考化学全程一轮总复习第八章水溶液中的离子平衡第30讲沉淀溶解平衡(课件+课时作业+学生用书)(3份),文件包含2024版新教材高考化学全程一轮总复习第八章水溶液中的离子平衡第30讲沉淀溶解平衡课件pptx、2024版新教材高考化学全程一轮总复习第八章水溶液中的离子平衡第30讲沉淀溶解平衡学生用书doc、2024版新教材高考化学全程一轮总复习课时作业30沉淀溶解平衡doc等3份课件配套教学资源,其中PPT共57页, 欢迎下载使用。
这是一份2024版新教材高考化学全程一轮总复习第八章水溶液中的离子平衡第29讲溶液中“粒子”浓度关系(课件+课时作业+学生用书)(3份),文件包含2024版新教材高考化学全程一轮总复习第八章水溶液中的离子平衡第29讲溶液中“粒子”浓度关系课件pptx、2024版新教材高考化学全程一轮总复习第八章水溶液中的离子平衡第29讲溶液中“粒子”浓度关系学生用书doc、2024版新教材高考化学全程一轮总复习课时作业29溶液中“粒子”浓度关系doc等3份课件配套教学资源,其中PPT共42页, 欢迎下载使用。
这是一份2024版新教材高考化学全程一轮总复习第八章水溶液中的离子平衡第28讲盐类水解(课件+课时作业+学生用书)(3份),文件包含2024版新教材高考化学全程一轮总复习第八章水溶液中的离子平衡第28讲盐类水解课件pptx、2024版新教材高考化学全程一轮总复习第八章水溶液中的离子平衡第28讲盐类水解学生用书doc、2024版新教材高考化学全程一轮总复习课时作业28盐类水解doc等3份课件配套教学资源,其中PPT共32页, 欢迎下载使用。









